RASA1在肾透明细胞癌中的表达及临床意义
2022-08-04热米拉艾海提逯宋梅陈思婷张瑞丽
热米拉·艾海提 逯宋梅 陈思婷 张瑞丽
肾透明细胞癌是泌尿生殖系统较为常见的恶性肿瘤之一。肾癌约占成人全身恶性肿瘤的3%[1],其发病率及死亡率逐年上升[2]。有研究发现,免疫原性强是肾癌的一大特性,常用的放、化疗手段对其治疗效果并不显著[3]。手术切除是应对肾癌相对更为有效的方式,尤其是对于早期肾癌。但仍有30%~35%的患者术后仍会出现局部复发或远处转移[4-5]。目前晚期肾癌患者的一线治疗手段是分子靶向治疗及免疫治疗[6],尽管其延长了患者的生存时间,但因其不同程度的不良反应仍存在较大的应用局限性。由此可知,现有治疗手段对于肾癌的治疗效果仍有待提升。积极寻找能够有助于肾癌诊断以及改善其生存的新靶点有至关重要的意义。本文深入探究肾透明细胞癌组织中RASA1的表达水平与肾透明细胞癌患者临床病理特征及预后之间的关系,为今后在临床上对于诊断和治疗肾癌提供新的思路及方向。
材料与方法
一、标本和资料的收集
本研究以新疆医科大学第一附属医院为样本来源,选取2010年1月1日至2018年12月31日于本院进行手术切除的肾透明细胞癌患者,共91例,并收集其癌组织标本。纳入标准:①患者必须为首次就诊;②患者未接受任何形式的抗肿瘤治疗;③通过病理组织学或细胞学检查明确诊断为肾透明细胞癌。排除标准:①患者确诊为肾癌,但不属于肾透明细胞癌,其中包括嫌色细胞癌、乳头状癌、未分化癌及集合管癌等;②患者的随访资料缺失,无法核实其病史等情况;③具有抗肿瘤治疗史;④通过医院检查及病史调查,发现患者有其他部位的原发恶性肿瘤史。通过住院、门诊及电话随访等方式,获得91例肾透明细胞癌患者的初诊记录,以该时间节点为生存时间计算起点,以月为单位,随访终点计为患者死于肾癌或仍然存活,失访患者以截尾数据处理。随访截止于2021年2月28日。本研究采集的所有肾癌组织标本,均由2名病理医师进行确诊,且所有患者均自愿并签署相关知情同意书。
二、材料与主要试剂
小鼠抗人RAS p21蛋白激活因子1(RAS p21 protein activator 1, RASA1)单克隆抗体(货号ab40677),材料来源于美国abcam公司;DAB显色试剂盒(货号DAB-1031)、兔抗小鼠二抗(货号KIT-5005)均购自福州迈新生物科技有限公司。RASA1阳性对照为已知染色阳性的肾透明细胞癌组织切片,阴性对照用PBS代替一抗。
三、免疫组织化学法检测RASA1的表达水平及其结果判定
本研究采用SP免疫组织化学染色法用以检测RASA1的表达水平。其结果判读:RASA1定位于细胞质中,依据文献[7]对免疫组化结果进行判读。阳性细胞、染色强度的判读标准:①保证染色背景、细胞结构清晰;②确保定位于细胞质内;③如果切取的组织为出血组织或坏死组织等情形,均视为无效。RASA1定位于细胞质内,阳性染色反应为三种情形,分别是黄色、棕黄色和黄褐色。阳性细胞数:阳性细胞数0为0分,数量≤25%为1分,26%~50%为2分,51%以上为3分。染色强度:若未着色或着色不明显为0分,若颜色为黄色、棕黄色和黄褐色,则分别对应为1分、2分和3分。将阳性细胞数、染色强度两项的计分相乘,结果>3分则视作高表达,≤3分则视作低表达。由两位病理医师判读,通常以双盲法为评判依据,如果二人在阴、阳性判断时出现分歧,则再请一名同等级病理科医师进行判读,并以其判读结果为准。
四、统计学方法
将所有临床资料录入统一格式的Excel表格,利用IBM SPSS Statistics 22.0软件进行统计学分析,计量资料若满足正态性检验应用t检验,若不满足则用非参数检验,计数资料则应用χ2检验,不满足χ2检验则用Fisher精确检验;对研究队列随访数据进行Kaplan-Meier分析,多因素分析采用Cox回归模型,P<0.05表示差异有统计学意义。
结 果
一、肾透明细胞癌组织中RASA1蛋白的表达水平
通过免疫组化的方法检测RASA1在91例肾透明细胞癌患者组织标本中的表达,结果显示RASA1均表达于实质细胞的细胞浆中,且90%以上细胞可见染色(评分标准见前述方法),见图1。91例肾透明细胞癌患者中,有51例为T1~2期患者,高表达率为90.2%(46/51);40例为T3~4期患者,高表达率为72.5%(29/40),两者差异有统计学意义(P<0.05)。

A:RASA1高表达;B:RASA1低表达图1 肾癌组织中RASA1的表达情况(HE染色,×400)
二、RASA1表达与肾透明细胞癌患者临床病理特征之间的关系
为了明确RASA1表达水平与肾透明细胞癌患者临床病理特征的关系,本研究分析了91例患者的临床资料,并采用免疫组化法对RASA1表达水平进行了检测。统计学分析结果表明,RASA1表达水平与患者的T分期、M分期具有相关性(P<0.05);与患者的性别、年龄、民族、淋巴脉管是否受侵、肿瘤大小、N分期及病理分级无相关性(P>0.05),见表1。
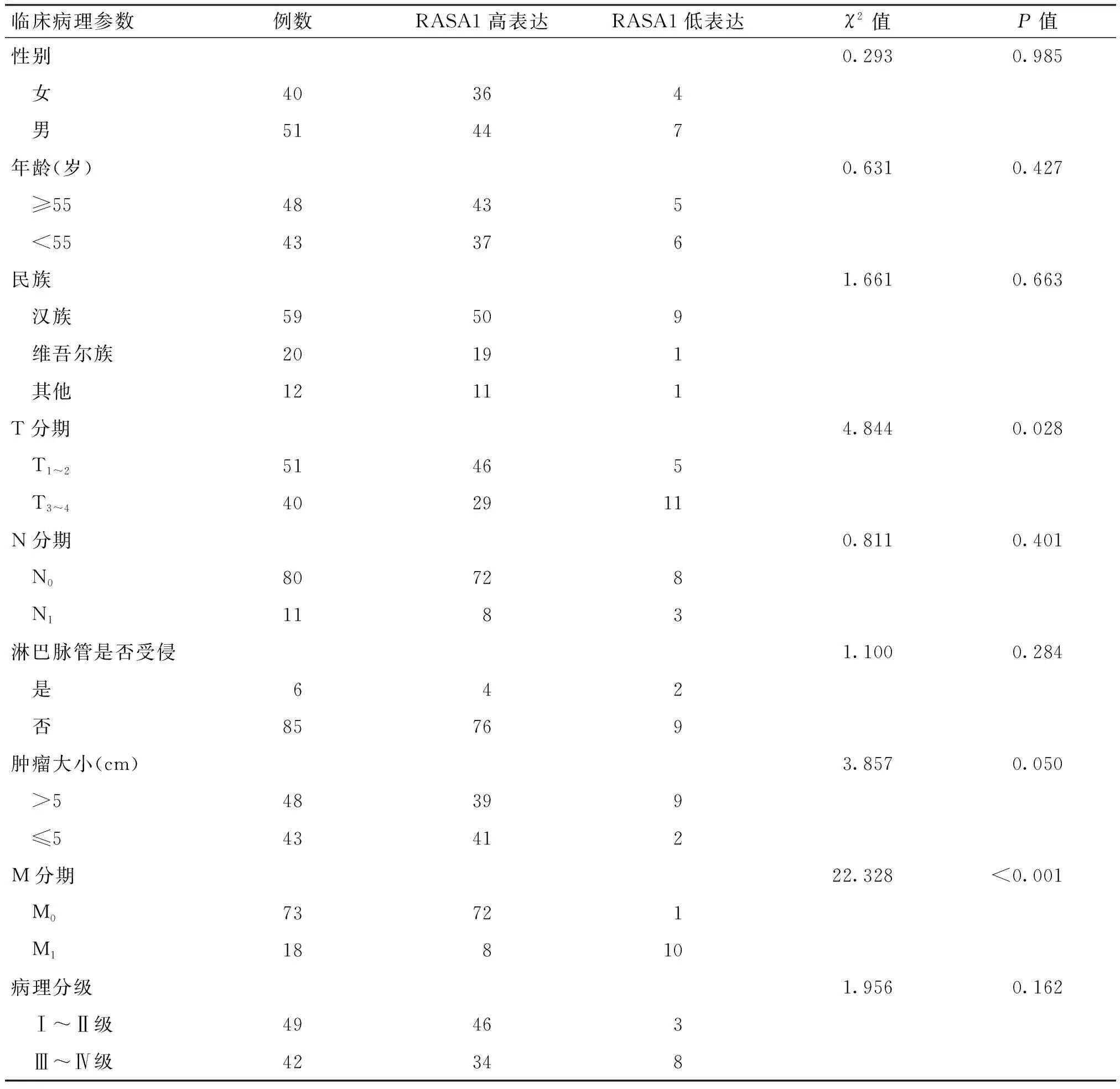
表1 RASA1在肾透明细胞癌中的表达与患者临床病理特征之间的关系
三、RASA1表达水平与患者预后的关系
将91例患者按RASA1的表达水平分为高表达和低表达组,并结合患者的实际预后情况,以Kaplan-Meier法为依据,绘制出患者的生存曲线(图2),分析结果表明,RASA1高表达组患者的生存期显著优于低表达组。高表达组和低表达组的中位生存时间分别为47.4个月和39.5个月。随后对91例肾透明细胞癌患者进行预后影响因素分析,Cox多因素分析显示,T分期、M分期、肿瘤大小、淋巴脉管是否受侵、病理分级以及RASA1表达水平与患者的预后均无明显相关性(P>0.05,表2)。
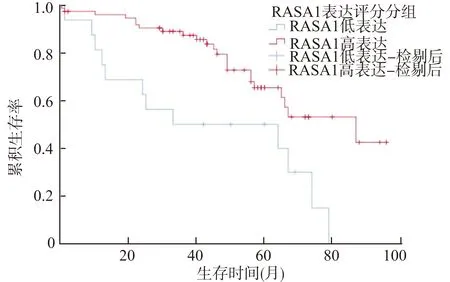
图2 RASA1表达水平与肾透明细胞癌患者预后的关系
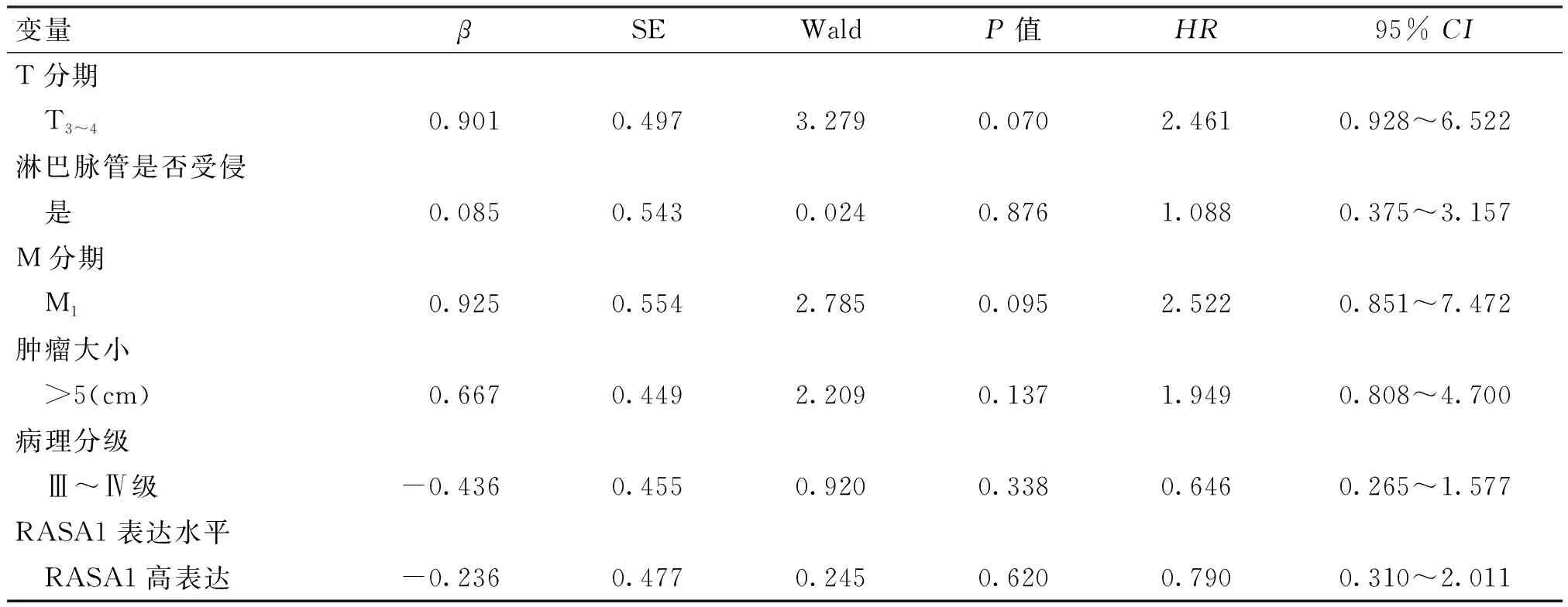
表2 影响肾透明细胞癌患者总生存期的多因素分析
讨 论
根治性肾切除术仍然是目前治疗肾癌最主要的手段,但对中晚期的肾癌患者来说即便是将原发病灶切除,术后也容易出现局部复发,有些患者术后虽然无局部复发,却出现了远处转移,导致患者预后较差。因此,找寻可用于临床、并与肾癌发生、诊断以及恶性程度相关的靶基因有非常重要的意义。
RAS蛋白作为ras基因表达产物,具有重要作用,其在肿瘤细胞生长和增殖过程中起促进作用。RASA1也被称为p120-RASGAP,是一种RASGAP蛋白,其作为信号支架蛋白,调节关键信号级联,具有让RAS蛋白失活从而抑制RAS信号通路的功能。RAS蛋白位于细胞内侧,属于膜结合蛋白。这类蛋白常常充当传感器的角色,用以连接膜表面的感受器和细胞内的效应器。由此可以看出,RAS蛋白在细胞信号转导过程中发挥着“分子开关”的关键作用。研究证实RAS蛋白的活化过程有赖于与三磷酸鸟苷的结合,活化完成后,RAS蛋白经由级联反应激活RAS/RAF/MAPK信号转导通路,有效促进细胞的增殖、分化过程;但碍于RASGAP的作用,这些RAS蛋白会加速失活,以保证细胞的稳定增殖状态[8]。另有研究称,RASA1可通过N端的SH2-SH3-SH4结构域激活RAS-GT-Pase,水解三磷酸鸟苷,使活化的RAS蛋白转为非活化状态,阻止下游信号通路的激活[9]。目前越来越多的研究表明,RASA1表达水平的变化与多种肿瘤的发生、发展相关,且与患者的预后及某些临床病理特征有相关性。ras基因在不同癌症中的平均突变率达到30%[10],然而在肾癌中ras基因的突变率并不高[11]。但同时有研究指出,ras基因介导的RAF/MEK/ERK通路的异常激活,对于肾癌发生有重要作用,因此抑制RAS通路可以有效抑制肾癌细胞生长[11-13]。而RASA1在肾透明细胞癌组织中的表达水平与患者的预后有无相关性尚不明确。因此我们推测,RASA1的异常表达可能与肾透明细胞癌患者的RAS信号通路异常激活有关,对肾透明细胞癌患者的预后有一定影响。已有文献报道,在非小细胞肺癌[12]、结肠癌[13]、胰腺癌[14]中,RASA1均对RAS信号通路产生抑制作用,并且RASA1的表达水平密切影响着肿瘤的发生、发展过程。研究发现,mir-31不仅可以抑制RASA1蛋白的表达,且在结直肠癌组织和细胞中高表达,其高表达与患者结直肠癌患者的TNM分期、有无淋巴结转移及预后显著相关[15]。有相关研究通过对肝细胞癌组织基因测序,检测RASA1和RASGAP家族其他成员,发现RASA1表达下调[16]。进一步预后分析显示,肝细胞癌组织中RASA1的表达与肿瘤大小和分化程度密切相关,RASA1高表达与更大的肿瘤大小呈负相关,与RASA1高表达的肝细胞癌患者相比,RASA1低表达的肝细胞癌患者与较差的生存率相关,因此,RASA1可以作为肝细胞癌患者的独立预后标志物[17]。Kent等[18]报道,RASA1表达水平降低显著促进Capan-1和MiaPaCa2细胞株胰腺癌的进展;秦玉璇等[14]发现RASA1在癌组织中的表达水平明显低于胰腺良性病变组织,说明RASA1在胰腺癌发生中可能起到抑癌蛋白的作用,并发现其表达水平与浸润程度和临床分期有关,说明RASA1的表达水平降低可能是发生在胰腺癌早期的分子事件,而与肿瘤最大直径和术后生存时间均无显著差异,其有待进一步深入研究。另有研究报道,RASA1低表达与braf基因突变的黑色素瘤患者总生存期下降有关[8]。Liu等[19]提到乳腺癌中有7种基因突变,其中包括RASA1突变,RASA1表达水平越低,乳腺癌患者的无进展生存期和总生存期越短。鉴于此,RASA1的低表达水平可以作为评估指标,有效预测乳腺癌患者的预后情况。对接蛋白2 (Dok2)和RASA1都具有肿瘤抑制因子的功能,且已经在几种类型的实体肿瘤中检测到,已有研究表明,Dok2/RASA1低表达与低分化乳腺癌相关,Dok2和RASA1表达的降低与更大的肿瘤大小和转移到腋窝淋巴结的机会增加有关[20]。亦有文献提出,在食管鳞癌细胞中,如果mir-21的表达水平过高,会导致RASA1的表达降低,进而抑制肿瘤生长,由此可以推断RASA1可能是一种抑癌样蛋白[21]。已有研究发现,在肾透明细胞癌中,QKI-5稳定的RASA1 mRNA直接与RASA1 QKI活性元素区结合,并阻止RAS-MAPK信号通路的激活,从而抑制细胞增殖,进一步诱导细胞周期阻滞[22]。另有文献报道,RASA1通过降低miR-223-3p以激发FBXW7的表达,从而抑制肾细胞癌的发展进程[23]。对于RASA1的表达水平与肾透明细胞癌患者的临床病理特征及预后之间的关系则少有报道。
本研究基于不同病理特征的肾透明细胞癌组织标本,采用免疫组织化学染色法,分别检测其RASA1的表达水平,并通过比较分析,深入探究RASA1表达水平与肾透明细胞癌患者临床病理特征及预后之间的关系。最终得出结论:RASA1的表达水平与患者的T、M分期相关(P<0.05)。此结果与罗云春等[15]对于结肠癌中RASA1的表达水平研究结果相一致。但与Liu等[19]关于乳腺癌的研究结果不符,与N分期无关,分析原因可能与本研究样本中N分期阳性病例数较少或本研究的检测手段较局限有关,仍需要更多研究进一步证实。此外,本研究还发现RASA1表达水平与患者的预后相关(P<0.05),RASA1低表达组患者的中位生存时间为39.5个月,而RASA1高表达组为47.4个月,Kaplan-Meier生存分析显示RASA1低表达的肾透明细胞癌患者生存情况较差,这也更加证实了RASA1表达水平可能与患者的生存情况具有相关性。进一步的Cox多因素分析则显示T分期、M分期、肿瘤大小、淋巴脉管是否受侵、病理分级以及RASA1表达水平与患者的预后均无明显相关性(P>0.05),RASA1的表达水平并不是肾透明细胞癌患者的独立预后因素,考虑此结果可能与本研究中总病例数较少有关。
综上所述,RASA1在肾透明细胞癌发生中可能起着抑癌基因的作用,也可认为RASA1的表达水平可能是发生在肾透明细胞癌早期的分子事件,早期检测或干涉肾透明细胞癌中RASA1的表达水平有可能对肾透明细胞癌的早期诊断或防治有一定价值,同时也提示RASA1可以作为肾透明细胞癌相关药物治疗研究的潜在靶点,但有待进一步深入研究。此外,本研究结果还表明,RASA1的表达水平与患者的预后显著相关,RASA1高表达组患者的生存期显著优于RASA1低表达组。由此可以推测,RASA1的表达水平可以作为评估肾透明细胞癌患者预后的有效指标,也进一步反映出RASA1对于肾透明细胞癌发生、发展过程具有较大影响。
