不同激素浓度和培养条件对矾根组培快繁体系的影响
2022-08-04吴海峰陈天烺赫文韬浙江海丰生物科技股份有限公司浙江绍兴312000
刘 丹,王 容,吴海峰,陈天烺,方 萍,赫文韬,陈 炜 (浙江海丰生物科技股份有限公司,浙江绍兴 312000)
矾根()为虎耳草科矾根属,又名珊瑚铃,多年生耐寒宿根草本花卉。矾根原产地为美洲中部,在-15 ℃ 时,虽叶片受冻枯死,根部仍存活,一旦地温回升,照常萌芽。叶色有紫色、绿色、花叶、红色等,叶基生,阔心型,花期4—10月,粉色小花钟状,花径0.6~1.2 cm,复总状花序。因其叶色丰富美丽,成为一种新优地被彩叶植物,逐渐应用于花坛、花境和花带景观配置中,为城市绿化增添了生机盎然的色彩。矾根品种繁多,部分品种可以播种繁殖,但矾根种子细小,出芽率低,且种子发芽慢且不整齐,有些品种通过叶插、分株和组培方式进行无性繁殖,叶插方式受季节限制,繁殖系数低;因矾根生长点低,不易分株,分株繁殖取材困难,繁殖速度慢,很难获得大量种苗,造成市场上矾根品种短缺供不应求。组织培养繁殖方式可以缩短矾根的生长周期,在短期内能够获得大量无菌组培苗。随着矾根在园林绿化上的广泛应用,越来越多的矾根种苗供应商兴起,有关矾根的研究,特别是矾根组培快繁体系的报道越来越多。但不同培养条件对矾根组培苗生长周期的影响研究尚未见报道。笔者以矾根盆栽苗为试验材料,研究了光照、温度等对组培苗生长的影响,以期建立高效的快繁组培体系,为大规模工厂化生产矾根种苗提供技术。
1 材料与方法
矾根盆栽,2021年3月4日购自浙江森里园艺有限公司,试验于浙江省绍兴市柯桥区平水镇浙江海丰花卉有限公司实验室开展。
初代培养。首先用手术刀剥除多余的叶片,切除根部,保留长度为2 cm左右的带腋芽茎段。①用自来水流水冲洗外植体上的泥土,然后用洗衣粉水浸泡20 min,取出用自来水流水冲洗5 min;②多菌灵1 000倍液浸泡1 h,取出用自来水流水冲洗5 min;③将初次处理过的外植体置于超净工作台,用浓度为75%的乙醇溶液浸泡20 s,无菌水冲洗4次,期间用玻璃棒搅拌;然后用有效氯为5%的次氯酸钠溶液处理,处理时间分别设置为4、7、10、13、16 min,共5个梯度,无菌水分别冲洗6次,期间用玻璃棒搅拌。④切除外植体接触药品的部位,每个茎段为1 cm左右,接种于含有诱导腋芽培养基的组培瓶中,每个组培瓶接种1个外植体,共100瓶。于光照培养室培养5 d后定期观察外植体生长情况,15 d后开始统计出芽率和污染率。出芽率=出芽数/接种数×100%,污染率=污染数/接种数×100%。培养条件:培养温度22~25 ℃,光照强度为1 500 lx,光照时间为12 h/d。
不同浓度的6-BA和NAA激素组合对矾根芽增殖的影响。采用双因素完全随机区组试验设计,分别设置激素6-BA浓度为0、0.2、0.4、0.6 mg/L,NAA浓度分别为0.01、0.03 mg/L,组成8个试验处理,MS为基本培养基,选择2 cm生长健壮的无菌苗,切成带芽茎段分别接种于含有增殖幼芽培养基的组培瓶内,每瓶接种5个,每个处理20瓶,共160瓶。蔗糖浓度20 g/L,琼脂5 g/L,pH为5.8。培养条件:培养温度22~25 ℃,光照强度为1 500 lx,光照时间为12 h/d。培养30 d后观察生长情况并统计芽增殖系数。芽增殖系数=芽增殖数/接种数×100%。
矾根无菌幼苗的生根培养。将高约1.0 cm的无菌幼苗,分别接种在含有不同NAA浓度的培养瓶中进行生根培养,1/2 MS为基本培养基,NAA浓度分别为0、0.05、0.10、0.15、0.20、0.25 mg/L,共6个处理,每个处理接种10瓶,每瓶接种3株,所有处理均添加琼脂5 g/L,蔗糖20 g/L,活性炭0.5 g/L,pH 5.8。培养条件:培养温度22~25 ℃,光照强度1 500 lx,光照时间12 h/d。培养7 d后开始观察无菌苗的生根情况,40 d后统计生根率。生根率=生根数/接种数×100%。
培养温度对无菌苗生长情况的影响。将高0.5 cm左右的带腋芽茎段和高1.0 cm左右的幼苗分别接种至前期筛选出的增殖培养基和生根培养基中,置于不同温度的光照培养室中进行培养,培养温度分别为20、22、24、26、28 ℃,光照强1 500 lx,光照时间为12 h/d,培养7 d后观察生长情况,统计芽增殖系数和生根情况。
暗培养对无菌苗生长情况的影响。将高0.5 cm左右的带腋芽茎段和高度1 cm左右的幼苗分别接种至前期筛选出的增殖培养基和生根培养基中,置于暗室中培养,与光照培养(光照强度为1 500 lx,光照时间为12 h/d)作对照,培养温度为23 ℃,培养7 d后观察生长情况,统计芽增殖系数和生根情况。
2 结果与分析
从表1可以看出,以带腋芽茎段作为试验材料诱导幼芽,采用次氯酸钠溶液对外植体进行不同时间的处理,污染率和出芽率差异显著。当处理时间为10 min时,外植体的污染率最低,仅为27.38%,出芽率最高达94.86%。随着次氯酸钠处理时间的延长,外植体的生长情况越来越差,时间越长对外植体的损害程度越大,褐化程度越严重,生长受到抑制。处理③外植体的生长情况最好,且出芽率高,污染率低,是最适合外植体的处理时间(图1A)。
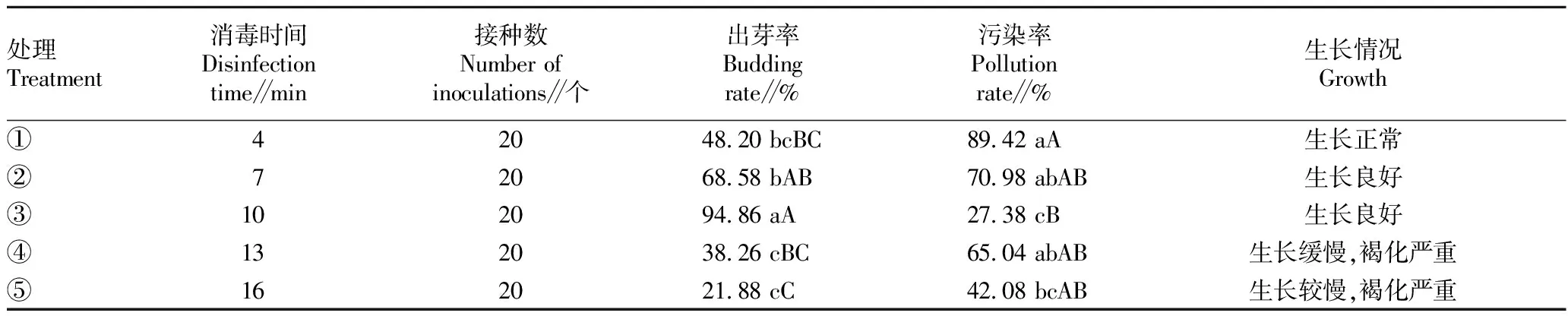
表1 次氯酸钠不同消毒时间对出芽率和污染率的影响Table 1 Effects of different disinfection times of sodium hypochlorite on germination rate and pollution rate
从表2可以看出,以幼芽为材料,采用不同浓度的6-BA和NAA组合对芽增殖的影响效果差异显著。当NAA浓度为0.02 mg/L 时,随着6-BA浓度的增加,增殖倍数越来越大。当6-BA浓度为0.4 和0.6 mg/L时,随着NAA浓度的增加,增殖倍数反而越来越小,由此推断过高的激素水平并不利于植物的增殖。处理③中6-BA和NAA浓度分别为0.6和0.02 mg/L时,矾根芽的增殖倍数极显著高于其他处理,达9.53倍,芽大而绿,生长状态优良(图1B)。因此,MS+6-BA 0.6 mg/L+NAA 0.02 mg/L是矾根芽最佳的增殖培养基。
从表3可以看出,以高约1 cm的幼苗为试验材料,1/2 MS为基本培养基,不同浓度的NAA对无菌苗生根的影响差异显著。随着NAA浓度的提高,无菌苗的生根率不断增加。处理⑤的生根率极显著高于处理①、②、③、④,与处理⑥差异不显著,生根率最高达100%,植株健壮,根系发达粗壮。处理⑤中每株的平均根数和平均根长均极显著高于其他处理,平均根数最高有8~9条,平均根长达12~13 cm(图1C)。因此,1/2MS+NAA 0.20 mg/L是矾根最佳的生根培养基。
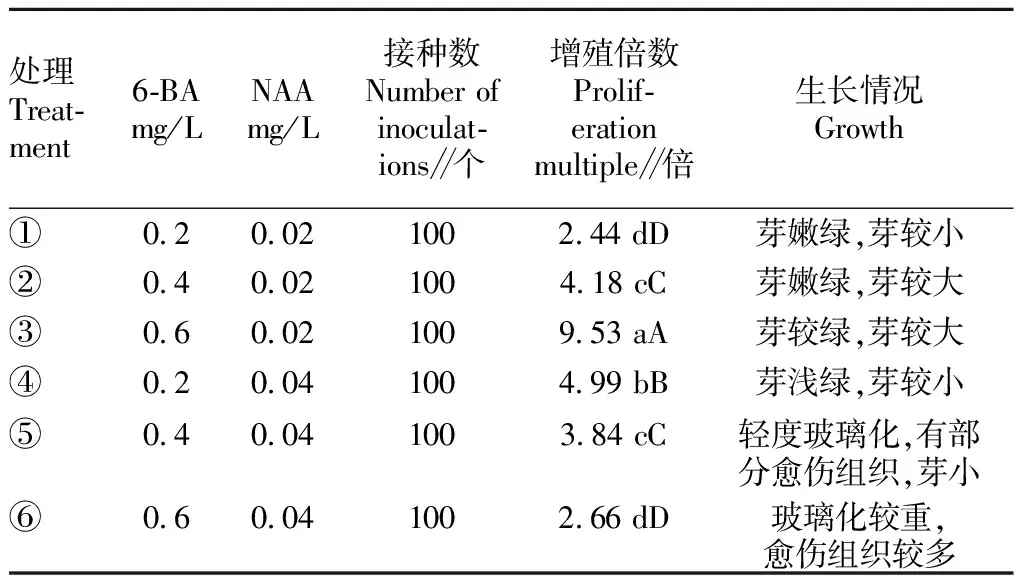
表2 不同浓度的6-BA和NAA组合对矾根芽增殖的影响Table 2 Effects of different concentrations of 6-BA and NAA hormone combination on the proliferation of alum roots and buds
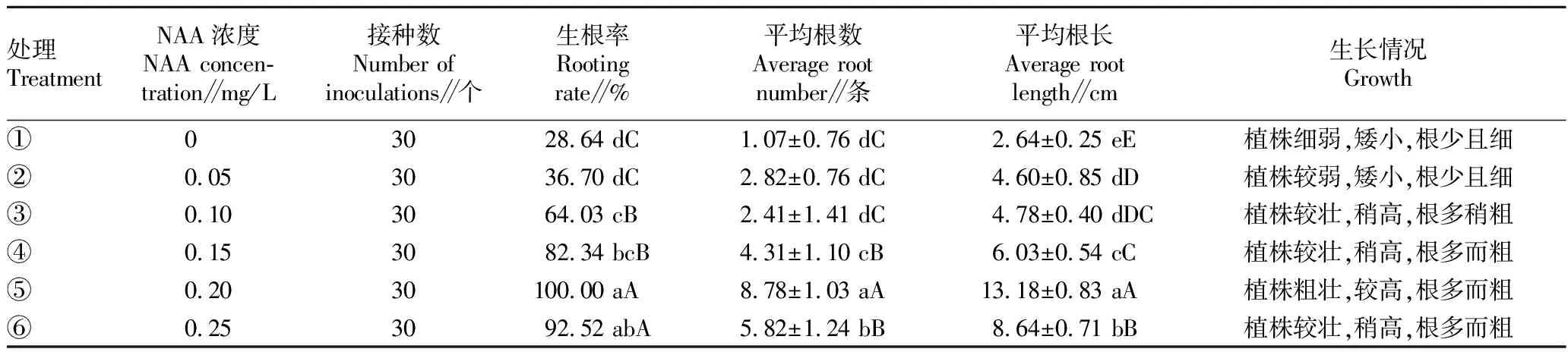
表3 不同浓度的NAA对生根的影响Table 3 Effects of different concentrations of NAA on rooting

注:A.初代培养的幼芽;B.增殖状态;C.生根培养状态 Note: A. Primary cultured buds; B. Proliferative state; C. Rooting culture state图1 不同培养阶段下矾根组培苗的生长状态Fig.1 Growth state of alum root tissue culture seedlings at different culture stages
从表4可以看出,通过使用前期筛选出来的培养基,设置不同温度的培养无菌苗,得出的试验结果差异显著。随着培养温度的升高,芽的增殖倍数不断提高,26 ℃时达到最高为9.5倍;温度为28 ℃时,增殖倍数开始降低。芽的生长速度也随着温度的升高不断加快,24 ℃时芽的高度最高为1.28 cm,26 ℃时芽的生长速度开始减缓,芽高逐渐变低,28 ℃时生长受到抑制,叶片边缘棕红色,与温度过高有很大关系。矾根生根培养与芽增殖相同,在温度为24和26 ℃时生长状态最好,生根率最高达100%,苗高为3 cm左右。因此,矾根增殖和生根阶段最佳的培养温度为24和26 ℃。

表4 不同培养温度对芽增殖和生根的影响Table 4 Effects of different culture temperatures on bud proliferation and rooting
从表5可以看出,使用最佳的培养基,培养温度均为24 ℃,进行光暗培养无菌苗对芽增殖和生根的影响差异显著。光照培养时芽的增殖倍数和生根率均比暗培养高,分别为8.4倍和100%,苗较健壮;暗培养时芽和苗的高度均比光照培养高,分别为2.50和4.09 cm,且生长速度均比光照培养快,苗稍细弱,移至光照下培养可以恢复健壮(图2A和B)。因此,在无菌苗芽增殖和生根培养时可以先进行光照培养15 d,使其获得高倍的芽数和根数;然后进行暗培养10 d,使其快速生长;最后进行光照培养,使其恢复健壮,增殖率和生根率更高,光暗交替培养大大缩短了生长周期(图2C)。

表5 不同培养方式对芽增殖和生根的影响Table 5 Effects of different culture methods on bud proliferation and rooting

注:A.暗培养增殖苗;B.暗培养生根苗;C.暗培养后光照培养下恢复正常的组培苗 Note:A.Dark culture proliferating seedling; B. Dark cultivation rooting seedling; C. Restored normal tissue culture seedlings under light culture after dark culture图2 暗培养后各生长阶段组培苗的状态Fig.2 Status of tissue culture seedlings at each growth stage after dark culture
待矾根组培苗长至约4 cm时,平均根数约5条,平均根长3 cm左右时将其移至大棚炼苗。在大棚内首先拧松组培瓶盖适应1 d后,次日掀开瓶盖,适应4 d后将生根苗取出洗净培养基(图3A),1 000倍液多菌灵浸泡30 min,种植在36孔穴盘中(图3B),基质为蛭石、泥炭和椰糠1∶2∶1混合,温度在20 ℃以上、26 ℃以下,在营养生长期每30 d需施肥2次,定期浇水。30 d后移至12 cm的花盆中继续生长,成活率100%(图3C)。

注:A.洗净培养基的组培苗;B.组培苗穴盘种植的状态;C.12 cm花盆定植的状态 Note:A. Tissue culture seedlings without medium;B.Hole plate planting of tissue culture seedlings;C.Colonization status in 12 cm flowerpot图3 矾根组培苗基地炼苗状态Fig.3 Seedling refining state in alum root tissue culture seedling base
该试验以矾根带腋芽茎段为材料,研究次氯酸钠的不同处理时间对外植体的影响,结果表明,5%的次氯酸钠处理10 min污染率最低,仅为27.38%,出芽率最高达94.86%,这与邹清成等矾根叶片离体快繁及工厂化生产技术研究中2%的次氯酸钠溶液灭菌10 min,污染率16%,出芽率74.67%的结论不同,可能与矾根的品种和次氯酸钠的浓度不同有关。
以无菌幼芽为材料,研究不同浓度的6-BA和NAA组合对矾根芽增殖的影响,结果表明,MS+6-BA 0.6 mg/L+NAA 0.02 mg/L是矾根芽最佳的增殖培养基,增殖倍数为9.53倍,而李小东等矾根组培快繁中MS+6-BA 0.25 mg/L+NAA 0.025 mg/L是最适宜芽丛增殖的培养基,增殖倍数为4~5倍,增殖苗生长正常,比该研究的增殖倍数低。生根培养试验中,1/2MS+NAA 0.2 mg/L+活性炭0.5 g/L是矾根最佳的生根培养基,生根率最高达100%,平均根数8~9条,平均根长达12~13 cm,与束晓春等的最佳生根培养基MS+1.0 mg/L IBA不同,但生根率98.05%,根数6.3条,根长14.35 cm 与该研究的结论接近。高燕等的基础生根培养基1/2 MS与该研究一致。
温度对矾根组培苗的增殖和生根均有显著影响,在20~26 ℃时,芽的增殖倍数和生根率均随着温度的升高而提高,以24~26 ℃最佳,组培苗生长状态最好,分别与郑洪立等和刘雪兰等研究的香蕉组培苗以25~28 ℃最佳和铁皮石斛组培苗以25 ℃最佳的结果相似。
光对植物细胞、组织、器官的生长和分化有极其重要的作用,但也有研究表明,适当的暗培养能够促进愈伤组织、茎芽和根的分化。叶雯等在火焰南天竹茎段离体培养再生体系的优化中分别对火焰南天竹芽诱导、芽增殖和生根培养进行了研究,结果表明,暗培养5 d,诱导率、增殖率和生根率均有显著提高。李素华等在石楠生根培养前期暗培养8 d,可显著提高石楠组培苗的生根率和生根数。该试验分别对矾根芽增殖和生根培养进行了暗培养,与光照培养对比,苗的生长速度显著加快,再次移至光照下培养,增殖倍数和生根率均有所提高,与前人的研究结果一致。该试验结果将为矾根组培快繁体系的研究提供数据支持,为规模化生产矾根种苗提供技术。
