脂肪乳诱导SD大鼠与KM小鼠高脂血症模型的对比研究*
2022-08-03方钰发周艳凯杨琼英何芳雁
孙 航 宁 珑 方钰发 周艳凯 冯 晋 杨琼英 何芳雁
(云南中医药大学 中药学院,昆明 650000)
高脂血症是肥胖症、非酒精性脂肪肝病、糖尿病、高血压、脑中风等疾病的高危险因素[1-5]。近年来,随着社会经济的发展,人民生活方式的改变以及西方饮食的传播,使得我国成年人血脂异常的总体患病率高达40.4%,并呈不断上升趋势[6]。他汀类药物为HGM-CoA还原酶抑制剂,可抑制胆固醇的合成而发挥疗效,临床常用于治疗高胆固醇血症,然而其肝损伤和肌病等不良反应在一定程度上限制了他汀类药物的应用[7-8]。因此寻找安全有效对抗高脂血症的药物仍具有现实意义。
降脂药物的研究与开发需选择适合的动物模型,动物模型是实验研究的基础,其建立方法应尽量吻合病程发展,并具备方法可重复、成本较低、操作简单、便于推广等特点[9]。目前医药界研究高脂血症的动物模型有先天性模型、转基因模型及化学诱导模型。先天性和转基模型因来源困难、价格昂贵导致其使用范围受限[8]。国内应用广泛的是化学诱导模型,造模方法包含化学试剂注射法、高脂饲料喂养法、脂肪乳剂灌胃法[10]。化学试剂注射法虽操作简单、模型复制迅速,但对动物刺激性较大,并且其形成机制与人类高脂血症差别较大,不适用于药物作用机制的研究[11];高脂饮食诱导的高脂血症模型与人类的高脂血症形成过程类似,但存在造模时间长、动物进食个体差异较大造成模型不稳定等缺点;脂肪乳灌胃诱导的高脂血症模型,操作简单,模型成果复制耗时少,并且能保证动物脂质摄取量均一。综合比较,该方法优于高脂饮食法。但目前报道的脂肪乳配方、动物选择及造模时间无统一标准[12]。大鼠、小鼠具有成本低、易于饲养、抗病力强、易于造模、技术方法更成熟等优点。目前,国内常用其复制高脂血症模型,但大鼠、小鼠模型之间仍存在一定差异[11]。因此,本研究进行脂肪乳灌胃诱导大鼠、小鼠高脂血症模型的对比研究,以期为高脂血症发病机制的研究和降脂药物的研发提供动物疾病模型选择的依据。
1 材料和方法
1.1 材料
1.1.1实验动物:SPF级的雄性SD大鼠体质量为(200±10)g,由昆明医科大学提供,许可证号:SCXK(滇)K2020—0004;SPF级的雄性KM小鼠【体质量为(20±3)g】,由昆明医科大学提供【SCXK(滇)K2020-0004】。按照云南中医药大学动物实验伦理审查委员会的相关规定进行实验,伦理委员会审批号:R-06201984。
1.1.2试剂与耗材:胆固醇(上海阿拉丁生化科技股份有限公司,批号:H1926053);丙硫氧嘧啶片(上海朝晖药业有限公司,批号:1907N18);丙二醇(成都市科龙化工试剂厂,批号:2018011701);猪胆酸钠(北京奥博生物技术有限责任公司,批号:20181222);高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)试剂盒(均为南京建成生物工程研究所,批号:03/2019)。低温高速离心机(日本Hitachi Koki公司,型号:cf16rx);脱水机、石蜡包埋机、石蜡切片机(均为赛默飞世尔科技(中国)有限公司,型号分别为:CryoStar NX50、Excelsior AS、HISTOSTATS、Microm HM);生物显微镜(瑞士Tecan公司,日本NIKON公司,型号:Ci-L)。
1.2 方法
1.2.1动物分组与样品采集:雄性SD大鼠,称重后随机分为对照组(灌胃等体积双蒸水)、模型组(灌胃2 mL脂肪乳/100 g体重),每组各10只;雄性KM小鼠,称重后随机分为对照组(灌胃等体积双蒸水)、模型组(灌胃0.2 mL脂肪乳/10 g体重),每组各10只。起初,饲以每只大鼠20 g/d(小鼠5 g/d)普通饲料,第二天称取各组所剩饲料后补齐饲料。根据各组最少进食量来控制各组动物食量。脂肪乳灌胃2周、4周后取材,取材前12 h禁食(不禁水)。各组动物在2周时进行眼底静脉丛取血;4周时,大鼠腹部静脉取血、小鼠采用摘眼球取血后,迅速剥离出肝脏、脾脏、肾脏,在冰生理盐水中涮洗,滤纸拭干水分后称重,拍照观察肝脏的形态学变化。脂肪乳的配制参考文献方案[13-14],分别称取20 g胆固醇、1 g丙硫氧嘧啶片置于乳钵中研细备用;再称取40 g猪油(市场自购)于锅中小火加热烊化呈液态,少量多次地加入研细的胆固醇粉末,混匀后,加丙硫氧嘧啶粉末,充分搅拌混匀,再缓慢加20 mL吐温-80、20 mL丙二醇,全部混匀后,再加20 mL的10%猪胆酸钠溶液(2 g猪胆酸钠加双蒸水定容至20 mL),快速研磨呈乳化状态即可,置于密闭容器中分装冷藏,使用前在37 ℃恒温水浴锅融化。每3天配置1次。
1.2.2血脂四项及肝组织TC、TG的测定:取出血样,肝右叶、中叶加生理盐水(肝组织∶生理盐水=1∶9)匀浆后,分别置于低温离心机(血4 ℃、3 000 r/min,肝组织3 500 r/min)离心10 min,取上清液备用。参照试剂盒说明书测定血清、肝组织匀浆溶液的TC、TG、HDL-C、LDL-C含量。
1.2.3HE染色:动物肝左叶切分成两块,置于10%中性甲醛溶液中固定24 h。固定好的肝组织块经流水冲洗后置于脱水机中进行脱水、透明、复蜡、包埋,而后进行连续切片(切片厚度为5 μm)。肝组织石蜡切片脱蜡、梯度乙醇溶液复水,苏木精染色2 min、返蓝,伊红染色45 s,透明后中性树胶封片,晾干保存。
2 结果
2.1 脂肪乳灌胃诱导大鼠、小鼠高脂血症模型的血脂4项对比
与对照组比较,KM小鼠模型组脂肪乳灌胃2周和4周后血清TC、TG、LDL-C、HDL-C含量均无明显差异;SD大鼠模型组灌胃2周后血清TC、LDL-C明显升高(P<0.001、P<0.01),HDL-C明显降低(P<0.001),TG无明显变化;脂肪乳灌胃4周后,血清TC、TG、LDL-C明显升高(P<0.001、P<0.01),HDL-C明显降低(P<0.001)。详见表1。

表1 大鼠、小鼠高脂血症模型的血脂四项对比(mmol/L,Mean±SD,N=10)Table 1 Comparison of four items of blood lipids in hyperlipidemia models of mice and rats(mmol/L,Mean±SD,N=10)
2.2 脂肪乳灌胃诱导大鼠、小鼠高脂血症模型的肝脏TC、TG对比
与对照组比较,脂肪乳灌胃4周后,昆明种小鼠模型组肝组织TC、TG无明显差异;SD大鼠模型组肝组织TC、TG明显升高(P<0.001、P<0.01)。详见表2。

表2 大鼠、小鼠高脂血症模型的肝脂对比 (mmol/L,Mean±SD,N=10)Table 2 Comparison of liver lipids in hyperlipidemic models in rats and mice(mmol/L,Mean±SD,N=10)
2.3 脂肪乳诱导大鼠、小鼠高脂血症模型的肝组织病变程度对比
2.3.1脂肪乳诱导大鼠、小鼠高脂血症模型的肝脏湿重及指数变化对比:与对照组比较,脂肪乳灌胃4周后,昆明种小鼠模型组肝脏湿重、肝脏指数显著升高(P<0.001、P<0.01);SD大鼠模型组肝脏湿重、肝脏指数显著升高(P<0.001)。详见表3。

表3 大鼠、小鼠高脂血症模型的肝脏湿重、指数变化对比Table 3 Comparison of changes in liver wet weight and index of hyperlipidemia models in rats and mice
2.3.2脂肪乳灌胃诱导大鼠、小鼠高脂血症模型的肝组织病变程度对比:与对照组比较,脂肪乳灌胃4周后,KM小鼠模型组肝脏稍有肿大,颜色发黄,质地柔软且饱满光滑;SD大鼠模型组可见肝脏明显肿大,颜色发黄甚至发白,质地柔软且饱满光滑,切面有油腻感。详见图1。

图1 大鼠、小鼠高脂血症模型的肝组织病变程度对比Fig.1 Comparison of liver pathological changes between hyperlipidemia model rats and mice
2.3.3脂肪乳灌胃诱导大、小鼠高脂血症模型的肝组织病理学变化对比:与对照组比较,脂肪乳灌胃4周后,KM小鼠模型组肝细胞排列紊乱,肝索不清晰,肝血窦狭窄,甚至消失,肝细胞体积增大,细胞核显像清晰,细胞质淡染;SD大鼠模型组肝细胞排列紊乱,肝索不清晰,肝血窦狭窄,甚至消失,肝细胞体积增大,细胞核显像清晰,细胞质淡染,且有明显的脂肪空泡。详见图2。
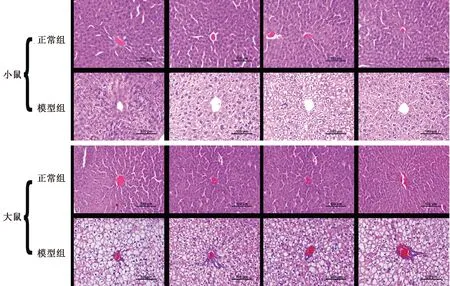
图2 大鼠、小鼠高脂血症模型的肝组织病理改变对比Fig.2 Comparison of hepatic histopathological changes in hyperlipidemia models in rats and mice
3 讨论
高脂血症是指血浆中TG、TC、LDL-C的含量过高,HDL-C含量过低的一种全身脂代谢异常的疾病[15]。灌胃脂肪乳因外源性脂肪吸收增多,可导致血脂升高,超过肝脏对脂质的代谢能力,脂肪在肝细胞内堆积,肝脂升高,肝细胞损伤,产生脂肪泡,最终形成脂肪肝[16-17]。本实验为综合比较脂肪乳诱导的大、小鼠高脂血症模型,以期获得最佳模型复制方法,选用血脂(TG、TC、LDL-C、HDL-C)、肝脂(TG、TC)及肝脏病变程度(肝脏形态、湿重、指数、病理改变)为指标。结果表明,脂肪乳灌胃2周,KM小鼠血脂四项均无明显变化,SD大鼠血清TC、LDL-C明显升高,HDL-C明显降低,TC还未出现明显变化。提示,SD大鼠较早出现血脂异常。脂肪乳灌胃4周,KM小鼠可见肝组织出现轻度病理损伤,但血脂和肝脂仍无明显变化;SD大鼠血清TG、TC、LDL-C明显升高,HDL-C明显降低,并可见肝脏明显肿大,颜色发白,肝组织病变程度较重,有明显的脂肪空泡出现。提示,本脂肪乳配方持续灌胃4周可成功复制大鼠高脂血症模型,而小鼠的高脂血症模型还未复制成功,跟动物种属、造模时间及脂肪乳配方有一定关系。梁红峰等[18]利用脂肪乳剂(100 g/L胆固醇、200 g/L猪油、20 g/L胆酸钠和10 g/L丙基硫氧嘧啶)连续灌胃12周成功诱导昆明种小鼠TC升高为主的单纯性高脂血症。因此,高脂血症发病机制和降脂药物的研发实验可优先选用SD大鼠用该脂肪乳配方灌胃4周。若选用本实验脂肪乳配方及昆明种小鼠为实验动物,可在此基础上延长造模时间,具体时间仍待进一步研究。
