纤维素酶协同超声波辅助提取北沙参多糖工艺优化及其理化性质和免疫调节活性研究
2022-08-03景永帅袁鑫茹代立霞张瑞娟郑玉光吴兰芳
景永帅,袁鑫茹,代立霞,张瑞娟,张 浩,郑玉光 ,吴兰芳
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.石家庄市中医院肛肠科,河北石家庄 050051;3.河北中医学院药学院,河北石家庄 050200)
北沙参(Glehniae Radix)是珊瑚菜(Glehnia littoralisFr. Schmidt ex Miq.)的根,为药食两用资源,其甘、微苦,微寒,归肺、胃经。具有养阴清肺,益胃生津等功效[1]。研究表明北沙参中含有多糖类、磷脂、香豆素类等多种有效成分[2],其中含量最多的是多糖类,也是其主要有效成分之一,具有抗氧化、降血糖和免疫调节等作用[3-4]。
在多糖的研究过程中,多糖的提取是研究的第一步,也是研究过程中的关键环节。目前,多糖的提取方法主要有热水提取法、超声波辅助提取法、微波辅助提取法、酶辅助提取法及联合辅助提取法等,每法各有优劣,如热水提取法在多糖的提取中最为常用,其工艺简单、操作安全、成本较低,但得率不高,且耗时长[5]。微波和超声波提取法具有效率高、时间短、溶剂用量少等优点,但微波和超声波可能会引起多糖的降解,改变多糖分子结构[6]。酶法提取是一种高效、环保的方法,已被证明可提高多糖得率,同时还具有投资成本低、能耗低的优点,但是可能会对多糖各组分之间的比例造成影响[7-8]。多种技术的联合使用,可以充分发挥各自的优势,弥补各法存在的缺点,提高多糖的得率,保证多糖质量稳定。因此,本试验选用纤维素酶协同超声波辅助提取法提取GLP,综合单因素考察结果,利用Box-Behnken 响应面法确定多糖的最佳提取工艺;并进一步探究其理化性质和免疫调节活性,以期为GLP 的后续研究提供数据支持。
1 材料与方法
1.1 材料与仪器
北沙参(批号2019061501) 康美药业股份有限公司;纤维素酶 酶活力1×105U·g-1,宁夏夏盛实业集团有限公司;各单糖标准品 色谱纯,阿拉丁试剂(上海)有限公司;无水乙醇 分析纯,天津大茂化学试剂厂。
101-2AB 型电热鼓风干燥箱 泰斯特仪器有限公司;TGL-15B 型高速离心机 安亭科学仪器厂;HH-2 型恒温水浴锅 金坛宏华仪器厂;KS-300DE型超声波清洗器 昆山洁力美超声仪器有限公司;EYELAN-1100 型旋转蒸发仪 东京理化株式会社;UV-2550 型紫外-可见分光光度计 岛津仪器有限公司;1220 型高效液相色谱仪 安捷伦科技有限公司;JSM-7610F 型场发射扫描电镜 日本电子。
1.2 实验方法
1.2.1 北沙参粗多糖提取工艺流程 取北沙参药材,粉碎,过40 目筛,3 倍体积的95%乙醇回流提取2次,除脂,过滤得到的药渣烘干备用。
称取4.6 g 除脂后的干燥药渣,加入样品重量2%的纤维素酶,加入30 倍体积的蒸馏水,60 ℃提取,提取完成后,将温度调至95 ℃,并维持10 min 使纤维素酶灭活,冷却,再置于数控超声波中50 ℃,210 W 超声提取20 min。重复上述步骤,合并2次提取液,离心(9000 r/min、5 min),收集上清液,过滤,减压浓缩至原体积的1/4,加入4 倍体积的无水乙醇醇沉,冰箱4 ℃静置过夜,抽滤,收集沉淀,真空干燥后即得GLP。
1.2.2 热水提取法制备北沙参粗多糖 称取4.6 g 除脂后的干燥药渣,加入30 倍体积的蒸馏水,于100 ℃水浴锅中回流提取2 h,提取2次,合并2次提取液,其他步骤同1.2.1,得热水提取GLP。
1.2.3 单因素实验 称取4.6 g 除脂后的干燥药渣,蒸馏水作为溶剂,预设料液比1:30 g·mL-1、纤维素酶添加量2%、酶解温度60 ℃、超声时间20 min、超声温度50 ℃、超声波功率210 W 为工艺流程中的常规量,以酶解时间(0.5、1、1.5、2.0、2.5、3.0 h)、料液比(1:20、1:30、1:40、1:50 g·mL-1)、超声时间(20、30、40、50、60 min)、超声温度(40、50、60、70、80 ℃)、纤维素酶添加量(1.0%、1.5%、2.0%、2.5%)5 个单因素变量替换工艺流程中相应的常规量,考察各因素对北沙参粗多糖得率的影响。
1.2.4 Box-Behnken 法优化提取工艺 依据单因素实验结果,进一步采用Box-Behnken 法设计试验,以超声温度(A)、超声时间(B)、酶解时间(C)三个因素为变量,以GLP 的得率为响应值,寻找最佳提取工艺,Box-Behnken 试验因素水平见表1。
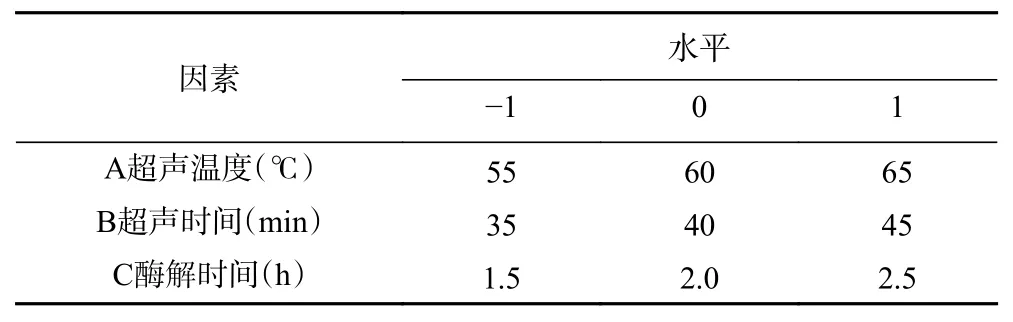
表1 试验因素水平设计Table 1 Factor levels of experimental design
1.2.5 多糖得率的测定 按式(1)计算北沙参粗多糖的得率。

式中:E 为多糖得率,%;m1为粗多糖质量,g;m2为北沙参粉末质量,g。
1.2.6 北沙参多糖的理化性质分析
1.2.6.1 微观形态观察 将GLP 溶液超声分散后,滴于样品台上,经喷金处理后,采用SEM 进行分析,加速电压3.0 kV,分辨率7.2 mm,分别放大不同的倍数进行观察[3]。
1.2.6.2 热稳定性分析 称取GLP 2.0 mg,利用TGA-DSC 进行热重分析,由室温升至800 ℃,升温速率为10 ℃/min[9]。
1.2.6.3 官能团分析 利用FT-IR,在4000~500 cm-1范围内进行扫描[10]。
1.2.6.4 单糖组成测定 根据文献[11],Eclipse XDBC18色谱柱(4.6 mm×250 mm,5 μm);检测波长245 nm;柱温30 ℃;上样量20 μL;流速1 mL/min;流动相为磷酸盐缓冲液(0.1 mol/L,pH6.85)-乙腈(83:17,v/v);洗脱方式为等度洗脱。
1.2.7 免疫调节活性
1.2.7.1 RAW 264.7 巨噬细胞的细胞培养 RAW 264.7 小鼠巨噬细胞购自中国科学院上海细胞库,基于37 ℃和5% CO2条件下培养(完全培养基:基本培养基:FBS:双抗=100:10:1),24 h 后,更换新鲜培养液并继续培养。当细胞长至培养瓶底面积的80%~90%,且细胞形态良好时,传代培养。
1.2.7.2 细胞种板 调整细胞浓度2×105个/mL 后接种于96 孔板中,每孔100 μL 置于细胞培养箱中培养。
1.2.7.3 GLP 对RAW 264.7 巨噬细胞的影响 通过MTT 法[12]进行测定:待孵育24 h,细胞完全贴壁后,按GLP 浓度0、0.5、1、10、50、100、250 μg·mL-1给予GLP 孵育24 h,每组5 个复孔;孵育24 h 后,每孔加入5 mg·mL-1的MTT 储备液10 μL,继续孵育4 h;孵育结束后,用注射器小心吸弃上清,再加入150 μL 二甲基亚砜,于震板仪上充分溶解甲臜结晶10 min 后,在波长为490 nm 处测吸光度,对数据进行处理,并用SPSS 进行统计学分析。
1.2.7.4 GLP 对LPS 诱导的RAW 264.7 巨噬细胞的影响 分别加入浓度为0、0.5、1、10、50、100、250 μg·mL-1的GLP 继续孵育24 h,用终浓度为1 μg·mL-1的LPS 刺激后[13],按上述方法检测。
1.3 数据处理
单因素实验数据均为3次重复试验的平均值,细胞试验均为5次重复试验的平均值,并用平均值±标准差表示,采用Excel 对试验数据进行整理,响应面试验设计及相关分析由Design Expert 8.0 软件完成,采用SPSS 16.0 软件进行显著性分析,用Origin 8 进行绘图。
2 结果与分析
2.1 单因素实验
2.1.1 酶解时间对北沙参粗多糖得率的影响 由图1可知,在0.5~1.0 h 范围内,随着酶解时间的增加,多糖的得率显著增加(P<0.05),在1.0~1.5 h 范围内,多糖的得率无显著性差异(P>0.05),在1.5~2.0 h 范围内,多糖的得率又呈现出显著性差异(P<0.05),再延长酶解时间时,得率反而下降。由于在一定时间内,随着纤维素酶酶解时间的增加,可能导致部分含有β-1,4 葡萄糖糖苷键的多糖降解,从而使得率降低[14]。所以将最优酶解时间定为2.0 h。
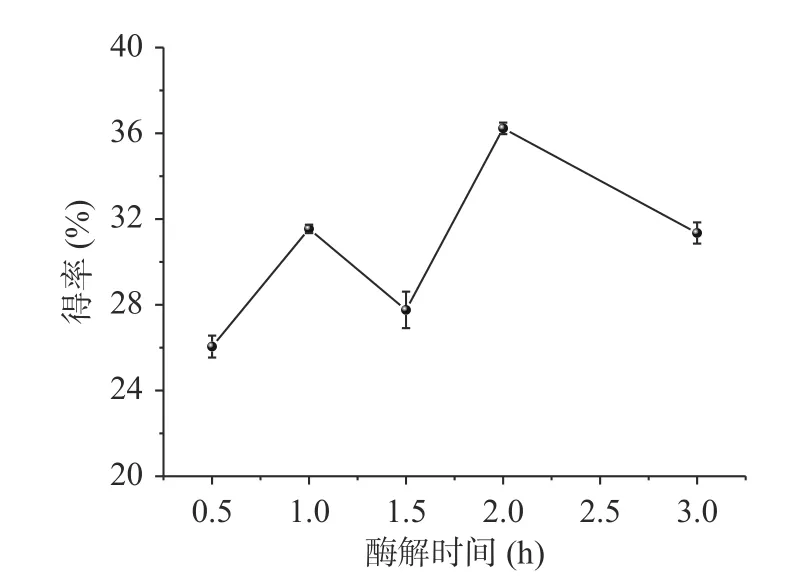
图1 酶解时间对得率的影响Fig.1 Effect of enzymolysis time on the yield
2.1.2 料液比对北沙参粗多糖得率的影响 从图2可以看出,多糖得率随着料液比先增加后降低,而当料液比为1:30 g·mL-1时,多糖的得率达到最大,这是因为增大溶剂量,会增大北沙参颗粒与溶剂接触面积,使多糖充分溶解,而当料液比由1:30 g·mL-1增加到1:40 g·mL-1时,多糖的得率显著下降(P<0.05),由于其他成分溶出的影响,以及溶液中的多糖被北沙参残渣吸附,多糖的得率有所降低[15]。所以将最优料液比定为1:30 g·mL-1。
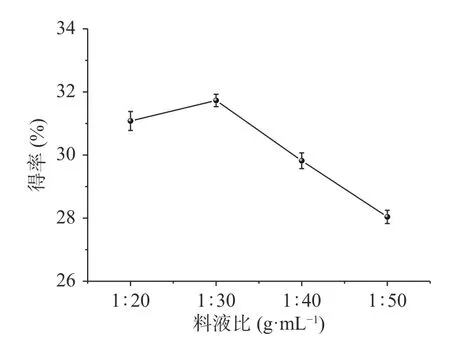
图2 料液比对得率的影响Fig.2 Effect of material-to-liquid ratio on the yield
2.1.3 超声时间对北沙参粗多糖得率的影响 由图3可知,在20~40 min 内,随着超声时间的增加,多糖的得率显著提高(P<0.05),再继续增加超声时间,得率反而下降。可能由于超声时间过长,多糖发生降解,分子量变小,醇沉时得到的多糖沉淀变少,导致得率降低[16]。而在60 min 时多糖的得率增加,可能是因为超声时间越长,少部分剩余北沙参残渣的细胞壁破碎,使得细胞内多糖类物质溶解在溶剂中,因此得率有所升高。综合分析,为了降低耗能,节约资源,方便操作,选取得率最高时的时间40 min 为最佳超声时间。

图3 超声时间对得率的影响Fig.3 Effect of ultrasonic time on the yield
2.1.4 超声温度对北沙参粗多糖得率的影响 由图4可以看出,在40~60 ℃时,多糖得率基本随着温度的升高呈上升趋势,超过60 ℃时,得率显著降低(P<0.05),由于超声波提取过程中温度过高,会导致多糖在超声波的作用下发生降解,糖苷键断裂,分子量降低,得率会显著降低[17],所以将超声温度选定为60 ℃。

图4 超声温度对得率的影响Fig.4 Effect of ultrasonic temperature on the yield
2.1.5 纤维素酶添加量对北沙参粗多糖得率的影响由图5 可以看出,在1.0%~2.0%范围内,酶量越大,得率越高,而当酶量为2%时,得率达到最大值。超过2.0%后,得率显著下降(P<0.05)。因为纤维素酶能够有效破坏植物细胞壁,利于多糖的释放。而当酶量继续增加时,有限的底物浓度抑制酶解过程或者过量的酶包吸附在北沙参颗粒表面,阻止多糖进一步溶出[18],从而使多糖的得率下降。所以将最优纤维素酶添加量定为2.0%。

图5 酶量对得率的影响Fig.5 Effect of enzyme addition on the yield
2.2 Box-Behnken 法优化试验结果
2.2.1 响应面试验结果 由以上几组单因素实验结果可知,酶解时间、超声温度和超声时间对工艺的影响较大,而酶量和料液比则可固定为2%和1:30 g·mL-1。根据三因素三水平的原则,将超声温度定为55、60、65 ℃;超声时间定为35、40、45 min;酶解时间定为1.5、2.0、2.5 h,设计17 组试验(表2)。

表2 多糖得率的Box-Behnken 试验设计与结果Table 2 Box-Behnken experimental design and results of the yield of polysaccharide
采用Box-Behnken Design(BBD)试验设计方法,通过多元二次方程来拟合因素和响应值之间的函数关系,对回归方程进行分析寻求最优工艺参数[18]。拟合回归方程为:
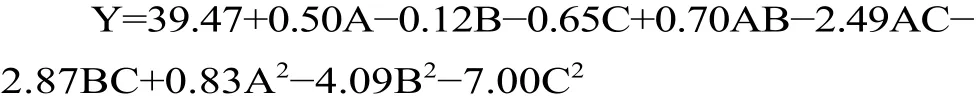
对该方程的方差分析结果见表3。
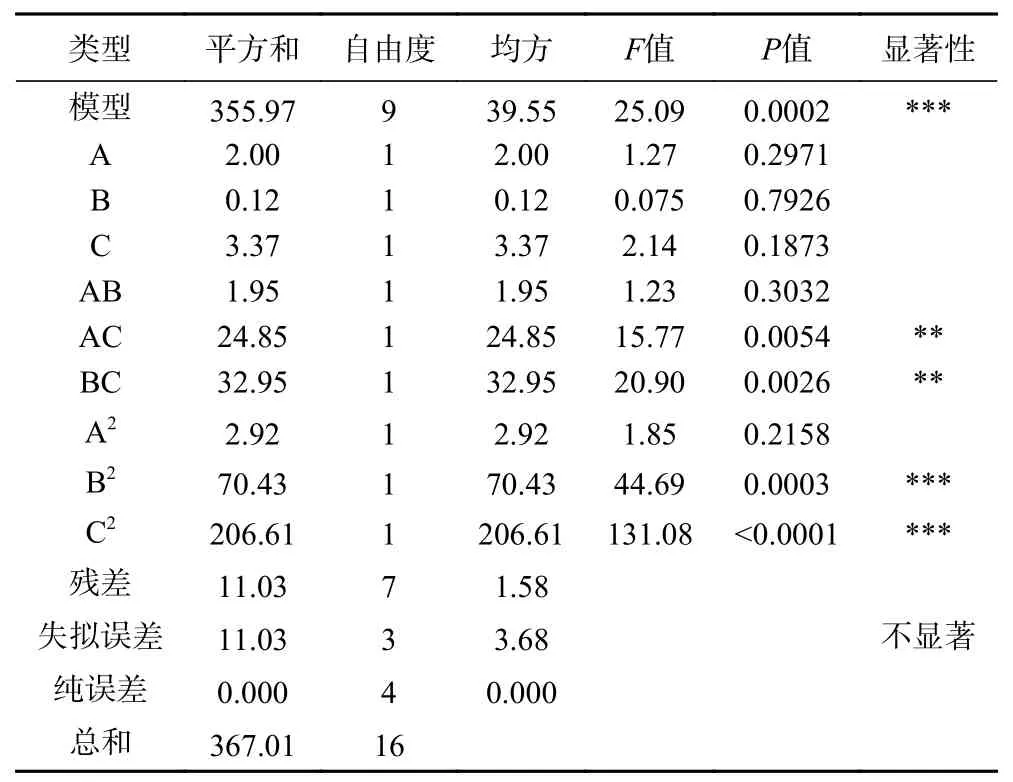
表3 响应面方差分析Table 3 ANOVA for response surface quadratic model
由表3可知,此模型的P=0.0002,说明本试验模型是具有显著性的。失拟误差P为3.68,不显著,则说明该模型对试验的拟合情况较好。拟合系数R2值为0.9699,可以认为模型解释了96.99%响应值的变化。由此说明,可以用此模型对纤维素酶协同超声波辅助提取GLP 的工艺进行分析和预测[19]。显著性结果表明,交互项AC、BC 及二次项B2、C2的P值均小于0.01,对响应值影响极为显著。根据表3 得出,对GLP 得率的影响大小为C>A>B。
2.2.2 等高线图和响应曲面分析 等高线图中心椭圆越接近圆形,表明因素的交互作用越不明显;曲面图越陡峭,说明交互作用越显著[20]。由图6可知,当超声温度一定时,随着超声时间的增长,多糖的得率先上升后下降。当超声时间一定时,随着超声温度的升高,多糖的得率呈现缓慢上升的趋势。由图7可知,当酶解时间一定时,多糖的得率随着超声温度的升高而缓慢提高。当超声温度一定时,在一定范围内,酶解时间越长,多糖的得率越高,超出这个范围,多糖的得率则呈下降的趋势。由图8可知,当酶解时间一定时,多糖的得率随着超声时间的增加呈现先升高后缓慢下降的趋势。相反,当超声时间一定时,多糖的得率随着酶解时间的增加呈缓慢上升趋势。由以上可以看出,酶解时间和超声时间的交互作用对得率影响的响应面图等高线图为椭圆形,曲面图陡峭,结合表3 中的方差分析显示,酶解时间和超声时间的交互作用对得率的影响较为显著。

图6 超声温度与超声时间交互作用对得率的影响Fig.6 Effect of ultrasonic time and ultrasonic temperature on yield

图7 超声温度与酶解时间交互作用对得率的影响Fig.7 Effect of ultrasonic temperature and enzymolysis time on yield
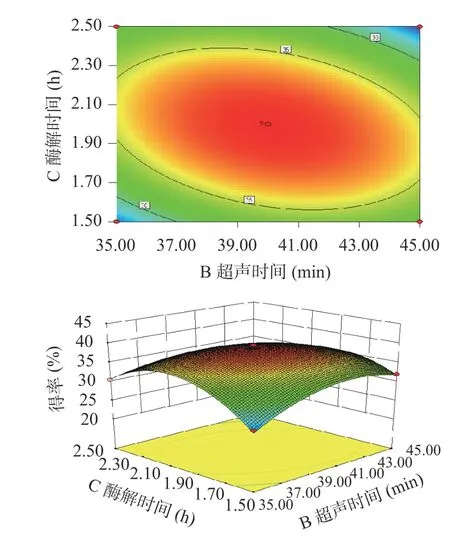
图8 超声时间与酶解时间交互作用对得率的影响Fig.8 Effect of ultrasonic time and enzymolysis time on yield
2.2.3 优化模型后的验证 采用Design-Expert 8.0软件,最优工艺为:超声温度65 ℃,超声时间40.80 min,酶解时间1.87 h,此时预测的GLP 得率为41.25%。为了说明优化结果的真实性,需要对其进行验证。考虑实际操作,将超声时间定为41 min,酶解时间定为112 min。在纤维素酶添加量2%、料液比1:30 g·mL-1、超声功率210 W、超声温度65 ℃、超声时间41 min和酶解时间112 min 的条件下进行三组平行试验,最终得到的多糖得率为39.58%±0.90%。较预测值41.25%误差为1.62%<2%,说明该模型能够很好地预测GLP 的提取工艺。课题组前期研究表明,超声波提取的多糖得率为12.13%[21],热水回流提取的多糖得率为23.93%[22],而纤维素酶协同超声波辅助得率为39.58%±0.90%,多糖得率明显提高。采用苯酚-硫酸法测定[6]可溶性总糖含量,得到的标准曲线为b=9.1a+0.0824(R2=0.998),经计算样品中总糖含量为90.40%。因此,新的提取技术在多糖提取中具有良好的应用前景。
2.3 理化性质分析
2.3.1 北沙参多糖的微观形态 由图9 可以看出,GLP 表面孔洞较少,表面不平整。而之前的研究表明,采用传统的热水提取法得到的北沙参粗多糖,外观光滑平整。相反,超声波辅助提取得到的多糖表面粗糙,孔洞较多。纤维素酶提取的多糖呈块状[23],这些结果与本研究不同。可能是由于和纤维素酶协同超声波的作用,多糖的平面和链状结构被降解聚集成小分子碎片堆积起来,使其生物活性显著增强[24]。

图9 GLP 扫描电子显微镜图Fig.9 Scanning electron microscope of GLP
2.3.2 热稳定性分析 由图10 可以看出多糖的吸热和放热的情况。根据热重分析曲线,可以了解GLP的热裂解温度和失重率[25]。从热重曲线可知,GLP分为三个阶段。第一阶段为10~150 ℃,失重率为6.98%,这个阶段是主要是自由水的流失;第二阶段为150~500 ℃,失重率为63.18%,说明GLP 受热分解,化学键被破坏;第三阶段为500~800 ℃,失重率为2.43%,失去的主要是总灰分中的有机物质[26]。由此可见,GLP 的热降解温度约为300 ℃,总失重率约为73%,因此GLP 具有良好的热稳定性。
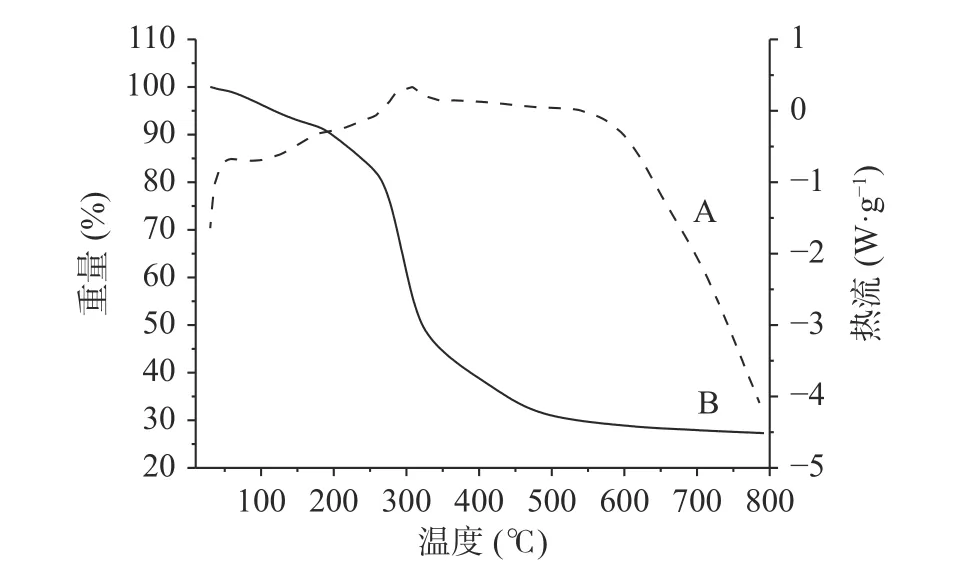
图10 GLP 差示扫描量热曲线图Fig.10 Thermogravimetric analysis-differential scanning calorimetry curves of GLP
2.3.3 红外光谱分析 由图11 可以看出,样品具有多糖的特征吸收峰,在3400 cm-1处出现的强宽峰是O-H 伸缩振动引起的;2930 cm-1处的吸收峰是C-H 的伸缩振动;1637 cm-1附近可能是O-H 引起的弯曲振动吸收峰、C-O 吸收峰或COO-不对称伸缩振动吸收峰;1021 cm-1处特征吸收峰为醚键的弯曲振动;849 cm-1为α-葡萄糖苷键的吸收峰[27]。

图11 GLP 红外光谱图Fig.11 Fourier transform infrared spectroscopy of GLP
2.3.4 单糖组成 由图12可知,与标准品对比,GLP主要由葡萄糖组成。于钦辉等[4]通过DEAE-52 纤维素柱对北沙参粗多糖进行分离纯化,得到的D1 组分只含有葡萄糖,与本研究结果一致。
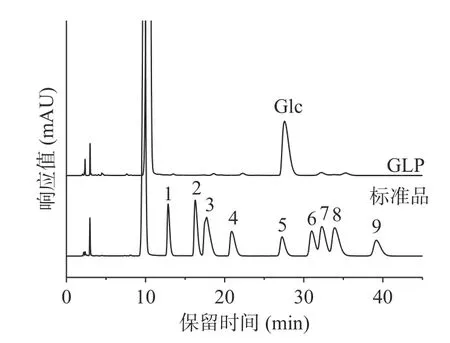
图12 单糖标准品及GLP 高效液相色谱图Fig.12 HPLC of monosaccharide standard and GLP
2.4 免疫活性调节
由图13a可知,不同浓度多糖均能促进RAW 264.7 巨噬细胞的增殖,显著高于空白对照组(P<0.05),且浓度为10、50 μg·mL-1时,对巨噬细胞的增殖效果最好。另外,可以看出北沙参多糖在试验范围内(0.5~250 μg/mL)对RAW 264.7 细胞没有明显毒性。巨噬细胞在LPS 的诱导下,不仅细胞增殖能力和吞噬能力明显增强,而且还能够释放大量的细胞因子、炎症介质,如一氧化氮、肿瘤坏死因子(TNF-α)、白介素-1β(IL-1β)等,这些介质会对病原微生物的入侵产生抵御作用,但是过量分泌则会引发炎症反应,因此LPS 诱导巨噬细胞活化模型被用做炎症模型[28]。由图13b 可以看出,经LPS 处理后,巨噬细胞明显活化,加入多糖样品后,多糖能够缓解LPS 诱导的过度活化。与LPS 组相比,在0.5~250 μg·mL-1浓度范围内均能显著抑制LPS 诱导的细胞过度活化(P<0.01)。这可能是因为多糖与细胞表面受体结合,竞争性抑制LPS 与细胞受体结合,防止LPS 过度诱导细胞活化[13]。与空白对照组相比,在低浓度范围内(0.5、1、10 μg·mL-1),使其恢复到正常水平,且无显著性差异(P>0.05),而在高浓度范围内(50、100、250 μg·mL-1),使其低于正常水平,出现抑制现象。因此,低浓度的GLP 能够缓解LPS 诱导的巨噬细胞细胞过度活化。Du 等[29]分离纯化了一种新的多糖GRP(北沙参多糖),结果显示GRP 对A549 细胞增殖和RAW 264.7 细胞NO 生成有抑制作用,对小鼠脾淋巴细胞和RAW 264.7 细胞增殖有促进作用。由此可见,GLP 具有潜在的免疫调节活性。
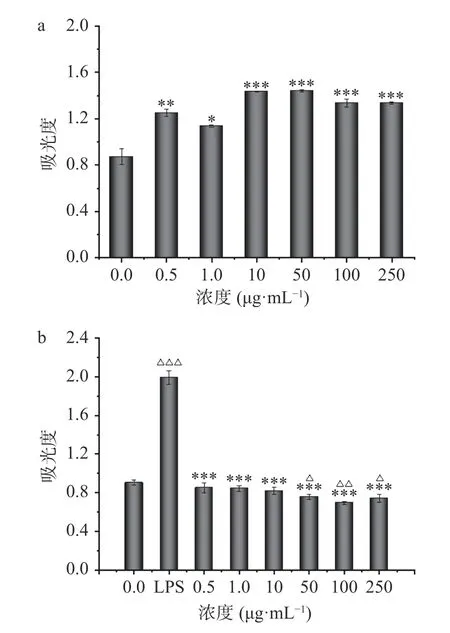
图13 多糖的免疫调节活性Fig.13 Immunomodulatory activity of polysaccharides
3 结论
本研究采用纤维素酶协同超声波辅助法提取GLP。采用响应面法优化提取工艺优化条件,得出最佳提取工艺为:超声功率210 W,酶解时间112 min,料液比1:30 g·mL-1,超声温度65 ℃,超声时间41 min,纤维素酶添加量2%。在此条件下,GLP 的得率为39.58%±0.90%,理化性质分析结果表明,GLP 具有多糖的特征吸收峰和良好的热稳定性,主要由葡萄糖组成。以上结果表明,该法提取得到的多糖得率较高,且稳定性好,为其他多糖的提取提供了一定的参考价值。
巨噬细胞积极参与宿主对外源性病原体和微生物的免疫防御,是免疫细胞分化成多种功能细胞并在免疫应答中发挥相应作用的前提与基础。体外免疫活性研究结果表明,在0.5~250 μg·mL-1浓度范围内,GLP 均能显著促进RAW 264.7 巨噬细胞的增殖(P<0.05)。其中,在10、50 μg·mL-1时,其对RAW 264.7巨噬细胞的增殖效果最好。而在低浓度时(0.5、1、10 μg·mL-1),GLP 能够缓解LPS 诱导的RAW 264.7巨噬细胞的过度活化,说明北沙参多糖可作为一种免疫调节剂,在食品和医药行业具有潜在的应用前景。
