介入再生医学中干细胞治疗研究进展
2022-08-03关斯文
关斯文 刘 旋 刘 刚∗
1(广西医科大学广西生物医药协同创新中心,广西组织器官修复医用生物材料工程技术研究中心,南宁 530021)
2(厦门大学公共卫生学院,分子影像暨转化医学研究中心,福建厦门 361102)
引言
干细胞可以分化为多种不同类型的细胞,并对疾病微环境进行调节,在促进老化损伤或疾病损害的组织功能恢复与再生方面显示出巨大应用前景。然而,干细胞在临床治疗中的潜力尚未完全发挥,其中一个重要但常被忽视的原因就是干细胞的递送途径。 研究表明, 通过不同途径对相同的干细胞进行递送,其治疗效果会大不相同[1-3]。 干细胞通过常规的静脉注射进入人体后,大多数会聚集于肺部、脾脏和肝脏等器官中,从而严重影响其疗效[2]。然而,通过动脉内注射、腔内注射或直接注射等方式将干细胞递送至靶组织能够显著提高其治疗效果[1-2,4]。
介入再生医学(IRM)旨在通过影像引导微创手术与干细胞的局部递送方式结合,将干细胞直接递送至靶部位,从而提高干细胞治疗效果,以促进受损组织器官的修复和再生。 IRM 的起源和发展与介入肿瘤学类似,实体肿瘤的化疗药物通常是经静脉递送,使药物全身分布,从而导致严重的毒副作用和较差的治疗效果。 为了解决这个问题,引入介入方式,开发出图像引导的微创手术,通过不同的局部介入方式,将有强烈毒副作用的药物直接递送到肿瘤部位。 例如,通过动脉血供,经动脉化学栓塞,将化疗药物直接递送至肝肿瘤区域,可以显著改善临床疗效,降低手术切除或器官移植的需求。
基于过去几十年来研究者们对体内各器官药物递送方式的不断探索,以及临床微创手术、介入技术的进步和成像设备、辅助导航产品的开发,未来IRM 也将为干细胞治疗与器官再生开辟新的途径。 本文将对干细胞靶向递送的新概念、干细胞来源和递送途径进行综述。
1 临床再生治疗常用的干细胞来源
目前,在前临床和临床研究中,间充质干细胞(mesenchymal stem cells, MSCs) 与单个核细胞(mononuclear cells,MNCs)已被广泛用于不同疾病中器官、组织的修复和再生,是基于干细胞再生治疗的两种最常用的细胞来源。
1.1 间充质干细胞
MSCs 是一种可以分化为不同类型细胞的多能干细胞,能够从骨髓(bone marrow-derived MSCs,BM-MSCs)、脂肪(adipose-derived MSCs,AD-MSCs)、外周血(peripheral blood-derived MSCs,PB-MSCs)、胎盘组织和脐带(umbilical cord-derived MSCs,UCMSCs)中获取,在脐带内MSCs 可以从Wharton′s Jelly 结缔组织中获取(Wharton′ s Jelly-derived MSCs,WJ-MSCs)。 MSCs 在体内通过血液和淋巴循环进行迁移或通过生长因子、趋化因子、细胞因子从组织基质和微血管中迁移至损伤部位,随后在靶部位分泌调节宿主先天性和适应性免疫应答的细胞因子以促进血管生成、调节细胞外基质和结缔组织的沉积,进而参与组织修复和再生[5]。 鉴于其在多种疾病状态中具有旁分泌作用与较低的免疫原性[6],MSCs 是目前干细胞再生治疗最常用的细胞来源。
1.2 单个核细胞
MNCs 是从骨髓(bone marrow-derived MNCs,BM-MNCs) 或外周血( peripheral blood-derived MNCs,PB-MNCs)中分离出来具有单个细胞核的细胞总称。 MNCs 包含多种细胞,如多种干细胞、祖细胞、免疫细胞、前体细胞等。 与需要在使用前进行体外扩增的MSCs 相比,MNCs 易于通过干细胞采集术和密度梯度离心法被大量地分离获得。 从外周血中分离MNCs 不需要麻醉,与分离骨髓MNCs 相比侵入性较小,分离后可以使用细胞分选等方法针对特定细胞类型进一步纯化。
2 干细胞局部递送方式的应用
2.1 心脏病
随着对干细胞研究的逐步深入,采用生物学技术将不同组织来源的干细胞通过体外分离、培养、扩增,经不同递送途径进行干细胞移植治疗,以期替代修复或改善受损心肌组织生物学功能的心肌细胞重塑治疗,于临床应用中显示出良好前景。 其中,寻找干细胞移植的理想种子细胞是心肌细胞重塑治疗的关键所在。 当前,心脏病(cardiac disease,CD)的干细胞治疗通常采用MSCs、MNCs 和人类诱导多能干细胞(human induced pluripotent stem cells,hiPSCs)。 其中,MSCs 是CD 临床研究中使用最多的一类干细胞,其对心脏的治疗作用主要依赖于旁分泌机制,在组织损伤修复中MSCs 发挥的作用机制可能与其分泌的多种生物活性因子相关,包括生长因子、细胞因子、趋化因子与激素等。 旁分泌效应在对抗心肌凋亡以及血管生成等方面发挥重要作用。 研究表明通过基因修饰可以增强MSCs 的治疗作用[7]。
目前在CD 的干细胞治疗中,经外周静脉注射是最简单的干细胞递送途径,但须经血液循环方能到达靶部位,因而使较多的干细胞滞留于外周组织。 研究表明,经静脉输入的干细胞早期主要滞留在肺内,并于肺循环中被大量破坏,故递送效率低下。 经冠状动脉注射和心肌内注射是干细胞移植治疗CD 最常用的给药途径。 随着CD 介入治疗的日益进展,心导管介入治疗被逐渐引入了心脏干细胞移植领域。 经冠状动脉注射是通过经导丝球囊导管的中心腔注射干细胞,该方式侵入性较小,具有较高的安全性与可行性。 在心肌梗死的急性期,炎性细胞的浸润和炎症介质的参与导致梗死区毛细血管的通透性增加,使经冠状动脉递送的干细胞易于透过毛细血管壁进入心肌内,从而为干细胞的归巢提供了良好条件,同时,该方式因能与冠状动脉介入术同步进行而备受青睐。 但对于晚期缺血性心脏病患者,干细胞无法通过增厚的冠状动脉,该方式疗效可能欠佳。 与之相比,经心肌内注射干细胞通常需要心内通路或外科手术干预,然而这种方式可使干细胞的心肌滞留增加3~5 倍[9]。 有研究表明,通过心内膜递送干细胞可确切地判断梗死区域,较其他方法更为准确地将干细胞注射到缺血的心肌组织内,治疗后表现出最大的梗死面积减少和LVEF 改善,而经冠状动脉递送治疗后没有出现明显改善[4]。 在此基础上,Silva 等[10]利用磁性靶向技术优化干细胞递送方式,以便减少手术的侵入性,增加干细胞递送后的滞留。 然而,有报道指出,经心内膜注射干细胞和冠状动脉内注射干细胞的疗效相同[11]。 近年来,在干细胞治疗CD 的临床试验中,有25 项采用了干细胞的局部递送方式,详见表1。

表1 局部递送干细胞治疗心脏病的临床试验Tab.1 Clinical trials of locoregional delivery of stem cells for the treatment of cardiac disease
2.2 脑卒中
干细胞治疗脑卒中(stroke)是神经病学研究的前沿课题之一,通过介入途径进行干细胞移植治疗使该领域飞速发展,并被临床充分证实为有效治疗手段。 近年来,脑卒中的干细胞介入治疗采用了除多能神经祖细胞和神经干细胞之外的MNCs、MSCs等非神经干细胞。 MNCs 或MSCs 主要通过旁分泌介导的机制和分泌因子发挥抗炎、免疫调节、神经保护和血管生成等作用[12]。
在动物实验中干细胞治疗脑卒中的细胞递送方式主要有脑立体定位注射及经静脉、动脉、鼻内、鞘内注射等,临床实验中多采用立体定向脑内注射以及经外周静脉注射和颈动脉注射(见图1)。 脑立体定位注射可将干细胞精准递送至病灶区域,使梗死区及周边蓄存更多的干细胞,从而利于干细胞成活和分化,进而促进损伤组织的修复与再生。 然而,立体定向脑内注射需要进行颅骨切开术,是一种有创性操作,易引起颅内感染、发热或局部损伤等不良反应,因而导致其临床应用受限[13]。 与之相比,经静脉和动脉递送具有侵入性小、可重复操作等特点。 相对于经外周静脉递送,颈动脉递送干细胞无需经其他器官而大量受损,可更快速、更直接地将干细胞递送至病灶部位。 但是,因BM-MSCs 体积较大,可能形成微栓子,有引起新发梗死的风险。Yang 等[14]和Vasconcelos dos-Santos 等[15]发现通过动脉内和静脉内两种途径递送干细胞达到了相似的疗效。 另有研究者发现,通过动脉、静脉和脑内3种途径分别递送BM-MSCs,均可以促进梗死侧胼胝体区域轴突髓鞘的重建,且经动脉递送途径介入治疗的患者神经功能恢复的速度最快、程度最好[16]。鼻内给药是一种非侵入性递送途径,药物通过嗅球的细胞迁移, 从而绕过血脑屏障(blood-brain barrier,BBB)[17],避免了经血管内递送药物导致的干细胞被周围器官捕获和动脉闭塞无法递送等问题。 在表2 所示干细胞治疗脑卒中的临床试验中,有8 项采用了干细胞的局部递送方式(见表2)。

表2 局部递送干细胞治疗脑卒中的临床试验Tab.2 Clinical trials of locoregional delivery of stem cells for the treatment of stroke

图1 干细胞治疗脑卒中的局部给药途径示意Fig.1 Locoregional routes of administration of stem cells to treat stroke.
2.3 阿尔茨海默病
目前,阿尔茨海默病(Alzheimer′s disease,AD)的治疗主要以口服药物缓解症状为主,无法降低其致残率并提升患者生活质量。 随着干细胞移植技术的日趋成熟,为AD 的干细胞治疗提供了全新方向。 研究表明干细胞介入治疗能够修复受损神经元,恢复神经功能,减少药物不良反应并改善患者生活质量。 其中,MSCs 通过分泌CCL5 促进小胶质细胞的M2 活化,来增强神经保护、减少氧化应激、增加Aβ 肽清除、减少炎症并促进神经发生;还通过分泌可溶性ICAM-1 等因子以及抑制M1 小胶质细胞促炎活性,来上调Aβ 降解酶,进一步促进Aβ 斑块的分解,从而改善AD 相关的损伤[18-19]。
目前在动物实验中,干细胞治疗AD 的细胞递送方式主要有尾静脉注射和脑立体定位注射两种,其中以脑立体定位注射海马区居多,该方式可使BM-MSCs 在功能区达到较高的细胞浓度,然而这种方法具有侵入性,不利于重复进行介入治疗,在临床应用中受到一定的限制。 通过尾静脉多次注射BM-MSCs 也能够在一定程度上减轻AD 小鼠症状,但该方式的疗效收益仍需要进一步验证与评估。Santamari 等[20]近期发现了经鼻腔内的非侵入方式递送MSCs 分泌物,同样可以缓解AD 小鼠的认知障碍,该方法可多次吸入给药,是新的备选方法,但需进一步验证其疗效。 在临床实验中,经大脑实质内注射可将MSCs 直接递送至靶部位,但需在全身麻醉下进行脑部手术,因此不易定期重复。 相比之下,将MSCs 经动脉递送可降低脑创伤且可重复介入,经动脉注射的MSCs 进入脑循环后可以穿过BBB 并离开脉管系统到达脑实质。 对于正常人,MSCs 不会穿越BBB 进入大脑,但对AD 患者,其BBB 的结构和功能发生了改变,因此有助于MSCs进入大脑[21]。 表3 所示的干细胞治疗AD 的临床试验,有3 项采用了局部递送方式(见表3)。

表3 局部递送干细胞治疗阿尔茨海默病的临床试验Tab.3 Clinical trials of locoregional delivery of stem cells for the treatment of Alzheimer′s disease
2.4 2 型糖尿病
2 型糖尿病(type 2 diabetes mellitus,T2DM)的发生、发展与胰岛β 细胞功能缺陷和胰岛素抵抗紧密相关,免疫介导的炎症反应在其中发挥重要作用。 然而,现有T2DM 的临床治疗措施尚存在一定局限性,随着病情进展,较多患者虽采取了联合多种口服降糖药与胰岛素干预,仍不能达到长期良好控制血糖并防治其他各类慢性并发症的目的,还存在体重增加与低血糖等风险,临床治疗现状不容乐观。
鉴于干细胞具有多向分化潜能,且具有旁分泌作用和免疫调节特性,因此通过干细胞局部递送,有可能实现修复胰岛β 细胞并改善胰岛素抵抗,为今后T2DM 的基础和临床研究提供了新方向。 研究表明MSCs 通过上调靶组织中葡萄糖转运体4 的表达,增加胰岛素受体底物1 的酪氨酸磷酸化和蛋白激酶B 的磷酸化,并抑制促炎性细胞因子TNF-α 的分泌,从而提高胰岛素敏感性[22]。 由于MNCs 与MSCs 可能通过不同机制发挥治疗作用,二者联合应用有望对T2DM 患者产生更大疗效。 报道显示利用MNCs 和MSCs 联合治疗T2DM 后,C 肽浓度升高,糖基化血红蛋白(HbA1c)百分比与每日胰岛素需求量降低[23],且BM-MNCs 与WJ-MSCs、UC-MSCs的疗效相同[24](见图2)。
胰腺动脉附近的侵入性介入给药可以将MSCs直接引导至胰腺,而其他途径(静脉注射、肌肉注射或阴茎注射)导致大多数MSCs 被困在肺、肝、脾和骨髓中。 受损的胰岛细胞通过发送相应的求救信号使MSCs 分泌有益的生长因子、细胞因子和细胞外囊泡来修复损伤,归巢胰腺的MSCs 还可能发送包含隧道纳米管的线粒体以增强修复过程[24](见图2)。 Sood 等[25]利用正电子发射断层扫描示踪剂18氟-氟代脱氧葡萄糖标记BM-MNCs 并对其迁移和保留做以研究,发现经常规的静脉内递送干细胞治疗后,HbA1c 和胰岛素需求量减少不明显,而经胰十二指肠上动脉或脾动脉靶向递送,可使干细胞更大程度地归巢胰腺。 然而,另一研究却显示动脉内递送方式并未显著降低胰岛素需求量[26]。 表4 显示,在干细胞治疗T2DM 的临床试验中,有1 项采用了干细胞的局部递送方式。

图2 MSC 注射治疗T2DM 的作用机制[24]Fig.2 Mechanism of action of MSC administration in T2DM healing[24]

表4 局部递送干细胞治疗2 型糖尿病的临床试验Tab.4 Clinical trials of locoregional delivery of stem cells for the treatment of type 2 diabetes mellitus
2.5 肝脏疾病
在肝脏疾病治疗中,干细胞可通过归巢、转分化、直接分化为肝细胞、旁分泌效应以及免疫调节等机制修复损伤肝脏。 临床研究表明MSCs 移植后,宿主纤维化肝星状细胞(hepatic stellate cells,HSLCs)诱导MSCs 产生的旁分泌因子会局部抑制HSLCs 增殖并减弱胶原蛋白合成,且MSCs 与HSLCs 之间的直接接触可通过Notch1 信号传导促进HSLCs 凋亡[27]。 在急性肝损伤中,MSCs 还通过抑制单核/巨噬细胞、肝天然杀伤性细胞、树突状细胞,以及消耗浸润CD4+T 细胞并抑制其炎症信号,在适应性免疫和先天免疫中发挥调节作用[27-28]。
干细胞可经门静脉、外周静脉、肝动脉介入途径以及肝内、脾内、腹腔注射等途径实现递送。 大量的动物实验证实,通过不同介入途径移植的干细胞均可以向肝脏迁移,但是迁移的细胞数量与递送途径是否有关,少见相关文献报道。 尽管经静脉递送是干细胞治疗肝病最常用的给药途径[2],但这种方式会导致大量的MSCs 在脾脏和肺脏中积聚[29]。研究显示经门静脉递送和肝动脉递送可使更多的干细胞到达受损肝脏[2,30]。 Zhao 等[2]发现,经肝动脉局部递送干细胞治疗后的MELD 评分、白蛋白浓度和总胆红素浓度与经静脉递送相比,临床改善出现较早。 但Sang 等[31]报道,在猪急性肝功能衰竭模型中通过门静脉递送干细胞,治疗效果优于其他途径。 因此,需要进一步的临床研究,基于递送靶部位的干细胞滞留和临床疗效来评估MSCs 的最佳局部递送方式。 表5 显示,在干细胞治疗肝脏疾病的临床试验中,有4 项采用了干细胞的局部递送方式。
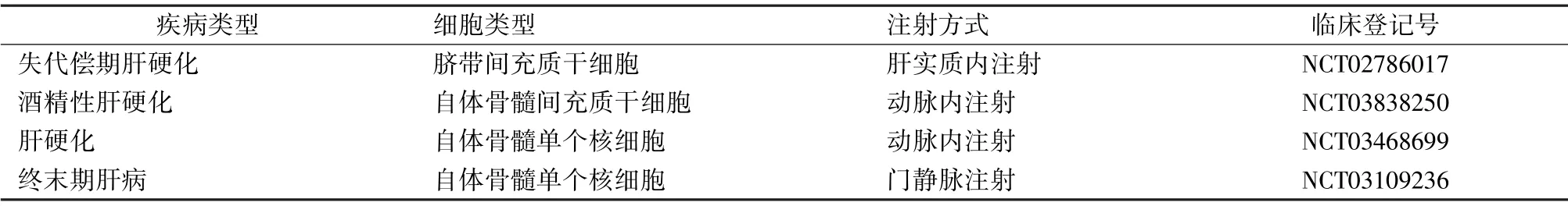
表5 局部递送干细胞治疗肝脏疾病的临床试验Tab.5 Clinical trials of locoregional delivery of stem cells for the treatment of liver disease
2.6 外周动脉疾病
作为组织工程学研究领域的重点与热点课题之一,干细胞移植治疗外周动脉疾病(peripheral arterial disease,PAD)从前临床研究到临床实践,亦有长足进展。 外周动脉阻塞性疾病晚期表现出严重肢体缺血,严重降低患者的生活质量。 虽有部分患者可以通过外科手术或介入治疗重建血流,但仍有很多患者因手术治疗或介入治疗失败,或远端流出道差等原因无法进行血流重建,因而面临截肢,甚至因坏疽感染而失去生命的危险。 近年来,通过许多学者对干细胞来源、分离方法及递送途径等方面的积极探索,干细胞介入治疗PAD 取得了可喜的成果。 研究显示BM-MNCs 通过局部增加多种血管生成因子,如血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)和血管生成素-1(Ang-1),以及肿瘤坏死因子(TNF)、白细胞介素-1(IL-1)等,发挥旁分泌作用,以增强宿主血管新生。 据报道,通过移植自体MNCs 进行血管再生的介入治疗方式可以改善受PAD 影响的缺血肢体的血流灌注[32-33]。
在PAD 介入治疗中,干细胞通常经腓肠肌或股动脉进行注射,肌内注射能够将干细胞瞬时沉积到缺血组织中,有利于促进旁分泌信号传导和干细胞进入宿主脉管系统[34];而动脉内递送可使干细胞进入富氧和富营养的缺血区域周围,有利于促进干细胞活性[35]。 Andrej 等[36]报道,基于这两种递送方式的治疗效果没有差异,而其他研究则显示肌内给药在降低患者截肢率、提高无截肢生存率与促进伤口完全愈合等方面比动脉内给药疗效更为显著[32-33]。 表6 显示,在干细胞治疗PAD 的临床试验中,有9 项采用了干细胞的局部递送方式。

表6 局部递送干细胞治疗外周动脉疾病的临床试验Tab.6 Clinical trials of locoregional delivery of stem cells for the treatment of peripheral arterial disease
2.7 急性肾损伤
急性肾损伤(acute kidney injury,AKI)是由多种病因引起的以肾功能迅速下降为特征的临床综合征,若缺少及时有效的治疗,将危及患者生命。 目前AKI 的治疗主要以控制原发病为主,虽然透析和肾脏移植也可以在一定程度上减缓其症状,但无法从根本上治疗AKI。 干细胞作为一类具有自我复制和多向分化潜能的原始未分化细胞,可以通过旁分泌效应或直接分化等方式对肾脏起到保护作用。干细胞治疗AKI 的主要细胞来源是MSCs。 据报道,MSCs 可下调纤维蛋白信号转导子、转录激活因子3(ATF3)、基质金属蛋白酶9(MMP-9),以及可抑制肾小管上皮细胞间充质转分化为成纤维细胞,并阻止下游纤维化因子的释放,通过上述调节达到有效预防肾脏纤维化[37]。 较传统方法相比,干细胞治疗在AKI 领域表现出明显优势,随着介入再生医学的发展,有望通过干细胞的局部递送为AKI 的治疗带来巨大前景。
虽然Zhuo 等[38]发现,在缺血再灌注引起的肾功能不全治疗中, 通过不同途径递送干细胞的治疗效果无显著差异,但有研究表明与经肾实质和静脉递送相比,通过肾动脉递送干细胞疗效最佳[3]。 据报道,对15 名AKI 患者进行介入治疗,将BM-MSCs经肾上腺主动脉递送能够有效避免肺部卡压及术后和晚期肾功能恶化,同时缩短住院时间并降低住院率[39]。 然而,另有研究发现,对156 例心脏病术后AKI 患者进行介入治疗,将MSCs 经动脉递送,肾功能指标没有显著改善[40-41]。 目前尚无临床试验采用干细胞局部递送方式靶向介入治疗AKI。
3 总结与展望
当前,干细胞治疗用于组织、器官的修复和再生日趋受到关注。 基于IRM,经血管内注射、腔内注射或直接注射,将干细胞局部靶向递送至组织或器官,已在包括心脏病、卒中、阿尔兹海默病、2 型糖尿病、肝病、外周动脉疾病、肾脏损伤在内的多种疾病治疗中展现出巨大前景。 未来IRM 将通过微创手术将干细胞直接靶向递送至受损器官,与常规的全身递送相比,靶向递送途径能使更多干细胞到达靶器官,更有效避免了干细胞在体内的流失,或在非靶器官蓄积。 同时,通过介入医师进行干细胞移植,可作为实体全器官移植的有效补充,可缩减手术程序和时间,可提高器官耐受性,可大大降低临床成本和减少手术的侵袭性。 干细胞移植有望作为器官移植前的临时措施,从而显著增加获益患者的数量,在临床治疗与护理中发挥极为重要的作用。
然而,IRM 在医疗保健领域中的发展仍面临诸多挑战。 前临床研究中动物模型与人类疾病之间存在的差异,使干细胞介入疗法的临床转化受到限制。 因此,尚需要对干细胞的来源、剂量、运输时间、培养条件与患者队列以及给药途径和给药方案等因素进行标准化,以便实现干细胞介入治疗的广泛实施与可持续发展。
随着IRM 临床应用的发展,,需要专门针对干细胞治疗研发专用递送系统,构建所需的临床基础设施,以便标准化控制输注过程中施加于细胞的压力,保证干细胞精准定位于靶区域,并提高靶部位的干细胞滞留率,从而优化干细胞活性和治疗效果。 干细胞介入疗法的改进同时要求开发出能够标记、监测和跟踪植入干细胞的新型成像方式或造影剂。 新型成像方式须在高时空分辨率与高灵敏度、高对比度之间取得平衡;新型造影剂不得影响植入干细胞的增殖、迁移、分化潜能和生存能力,并需要进一步验证其长期毒性、生物降解、光稳定性和不良免疫反应等。
作为一门交叉学科,IRM 向前发展需要将干细胞生物学、转化医学、临床专业知识和医院基础设施紧密结合,未来通过介入医师、生物学家、工程师与临床医生的共同努力和协同创新,IRM 有望成为再生医学的重要组成部分。
