牡丹种间远缘杂交不亲和的细胞学与生理机制研究
2022-08-03张翔宇贾文庆何松林邱永杰王乔健史来琨刘会超
张翔宇,贾文庆,何松林,邱永杰,王乔健,胡 缓,史来琨,刘会超
(河南科技学院园艺园林学院,河南 新乡 453003)
远缘杂交是新优种质培育的主要途径,野生种质与栽培种进行远缘杂交在改良栽培品种以及培育新异种质中起着重要作用[1-3],如我国小麦育种专家李振声团队利用小麦(Triticum aestivum L.)与长穗偃麦草(Elytrigia elongata (Host) Nevski)杂交培育出抗病性强的‘小偃6号’等系列远缘杂交小麦品种,成功解决抗“小麦癌症”条锈病的世界育种难题[4],Moshe Feldman和Emest R.Sears也曾提出“未来的谷物改良寄希望于野生基因资源的利用”[5]。牡丹(Paeonia suffruticosa Andr.)为世界著名花卉,也是中国的一张名片,在中国影响之深远是其他花卉所不可企及的;但牡丹现有栽培品种中纯正花色少,黄色、橙色花缺乏,株型较低,大多对白粉病易感。长期以来,由于牡丹远缘杂交不亲和或亲和性差,牡丹育种多集中在品种群内进行常规杂交,遗传基础狭窄和多样性亲本资源的缺乏成为了限制牡丹育种取得突破的瓶颈。
栽培品种中,由杨山牡丹(P.ostii T.Hong et J.X.Zhang sp.nov.)演化出的‘凤丹’(P.ostii‘Feng Dan’)植株高大、生长势强、花量大,生态适应性极广泛,是杂交育种最常用的亲本[6-7];牡丹野生种保康牡丹(Paeonia baokangensis Z.L.Dai et T.Hong sp.Nov.)[8],花桃红,色泽纯正、明亮,花期长,抗白粉病,是亟待开发的优良野生资源之一。解析牡丹‘凤丹’与保康牡丹远缘杂交的不亲和性机制,对于克服受精障碍,完善牡丹远缘杂交技术体系,培育花色纯正、抗白粉病的牡丹新品种具有重要意义。
植物远缘杂交研究发现,花粉萌发及花粉管生长情况、内源激素水平、保护酶活性及可溶性蛋白含量等是远缘杂交亲和性强弱的重要指标。郭朋辉等[9]在紫斑百合(Lilium nepalense D.Don)远缘杂交亲和性研究中发现,紫斑百合远缘杂交过程中多出现受精前障碍,胼胝质沉积,花粉管扭曲缠绕,阻碍伸长生长是其受精前障碍的主要表现;王保成等[10]在芸芥(Eruca sativa Mill)亲和性研究中发现,SOD、POD及CAT三种保护酶的活性变化与自交亲和基因的调控相关;杨晓玲等[11]在百合(Lilium brownie F.)亲和性研究中发现,高水平的IAA、GA3、ZR对花粉在柱头的识别黏附及萌发有促进作用;Kovaleva L等[12]表明,ABA含量较高是导致矮牵牛(Petunia hybrida L.)授粉不亲和的原因;牡丹与芍药(Paeonia lactiflora Pall.)杂交后也显示相关保护酶活性及内源激素含量与授粉亲和性相关[13]。目前,有关牡丹种间杂交不亲和机制尚未见报道,基于此,本研究以牡丹‘凤丹’为母本,以野生保康牡丹为父本进行了种间杂交,探讨花粉萌发、花粉管生长、雌蕊保护酶活性、可溶性物质及内源激素含量变化与远缘杂交不亲和性的关系,以期为解析牡丹种间远缘杂交不亲和性机制以及完善牡丹远缘杂交技术体系提供理论及试验依据。
1 材料与方法
1.1 材料
母本‘凤丹’种植于河南科技学院牡丹资源圃,父本保康牡丹采自洛阳国家牡丹园野生资源圃,二者植株健壮,均可正常开花结实。于露色期对母本材料进行去雄,挂上标签并做隔离处理,4 d后用准备好的花粉进行人工授粉。
1.2 花粉萌发及花粉管生长荧光观察
分别于授粉后1、3、6、8、12、24、36、48、72、96 h,取雌蕊10~15个(分别取自不同花朵)迅速放入卡诺固定液中,固定24 h以上转入70%酒精于4 ℃ 冰箱存放,之后用8 mol·L−1NaOH 60 ℃条件下软化4 h,漂洗后于0.5%苯胺蓝染液避光染色6 h以上,压片并于荧光显微镜进行观察、拍照(图1A~I及L×40倍;J及K×100倍)。

图1 花粉萌发及花粉管生长荧光观察Fig.1 Fluorescence observation of pollens germination and pollen tubes growth
1.3 生理指标测定
取未授粉及授粉后1、3、6、8、12、24、36、48、72、96 h的雌蕊,每处理0.2 g,重复3次,液氮速冻后于−80 ℃冰箱中保存。分别采用氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性,硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量,考马斯亮蓝G-250法测定可溶性蛋白含量,苯酚法测定可溶性糖含量。
1.4 内源激素测定
取样同1.3节,每处理0.3 g。采用酶联免疫吸附法(ELISA),参照试剂盒附带说明,分别测定吲哚乙酸(IAA)、赤霉素(GA3)、异戊烯基腺苷(IPA)、脱落酸(ABA)及茉莉酸(JA)含量。
2 结果与分析
2.1 花粉萌发及花粉管生长荧光显微观察
远缘杂交与自交授粉后不同时期雌蕊荧光显微观察如图1,授粉后1 h,远缘杂交授粉雌蕊花粉粒黏附极少,未见萌发(图1A);自交授粉花粉粒黏附较多,花粉萌发花粉管生长正常(图1B)。授粉6 h,远缘杂交花粉粒黏附增多,花粉粒萌发,花粉管有扭曲、分枝现象,伴有大量胼胝质沉积(图1C、D);自交雌蕊花粉管生长迅速,有序向花柱生长(图1E)。授粉后12 h,远缘杂交授粉花粉管多扭曲,部分伸长到柱头1/2到2/3部分(图1F);自交授粉花粉管生长正常,伸长到花柱部分(图1G)。授粉36 h,远缘杂交授粉个别花粉管伸长到子房(图1H);自交授粉花粉管成束有序穿过花柱,伸长到子房(图1I)。授粉72 h,远缘杂交授粉少量花粉管伸长到胚珠,伴有胼胝质沉积(图1J),柱头上花粉粒大多开始干瘪(图1L);自交授粉花粉管正常生长到胚珠(图1K)。后期观察发现,自交授粉能正常结实,结实率高,种荚饱满(图1M、N);远缘杂交授粉结实率低,种荚大多干瘪(图1O、P)。整体表明,远缘杂交受精前障碍明显,花粉粒萌发晚,花粉管内胼胝质沉积是其不亲和原因。
2.2 自交与远缘杂交授粉后雌蕊SOD活性变化
授粉后不同时间,自交与远缘杂交授粉雌蕊SOD活性变化(图2)表明:授粉后1 h,自交雌蕊SOD活性急速上升,远缘杂交雌蕊活性稍有上升,此时自交雌蕊花粉萌发,花粉管生长迅速,远缘杂交雌蕊未见花粉萌发;1~3 h自交雌蕊SOD活性继续急速显著上升(P<0.05),在3 h达到顶峰84.57 U·g−1,3 h之后活性稍有下降,此后保持在较高水平,并在72 h达到另一高峰75.05 U·g−1,此时花粉管伸入胚珠部分。远缘杂交雌蕊SOD活性1~3 h同样急速上升,在3 h达到一个峰点74.78 U·g−1,此时远缘杂交雌蕊个别花粉萌发;3 h后稍有下降,在24 h达到另一峰值81.97 U·g−1,之后保持在较高水平。表明高活性SOD对花粉萌发及花粉管生长有促进作用,尤其在授粉前期,高活性SOD有助于花粉-柱头的识别作用,对自交授粉花粉粒在柱头的黏附萌发促进作用显著。

图2 授粉后雌蕊 SOD 活性及MDA 含量变化Fig.2 Changes of SOD activity and MDA content in pistils after pollination
2.3 自交与远缘杂交授粉后雌蕊MDA含量变化
授粉后,自交与远缘杂交授粉雌蕊不同时间MDA含量变化(图2)表明:授粉后1 h,自交雌蕊MDA含量显著上升(P<0.05),1 h达最大67.03 μmol·g−1,此时自交雌蕊花粉萌发,花粉管生长迅速;1 h之后MDA含量下降,并在8 h之后保持在较低水平,随后波动不大,显微特征表现为花粉管有序向花柱及子房生长,推测此时雌蕊内部达到平衡状态,雌蕊自身适应花粉落在柱头所带来的刺激作用。远缘杂交授粉雌蕊MDA含量在授粉后1~3 h急速下降,此时花粉未见萌发;6 h之后MDA含量开始急速显著上升(P<0.05),12 h含量达到最大 72.87 μmol·g−1,此阶段花粉管出现扭曲,并伴有胼胝质沉积,花粉管生长受阻,可能原因在于柱头对外来花粉识别后排斥作用明显,诱导MDA急速增加,进而打破雌蕊内部动态平衡,细胞功能受损;在授粉后24 h之后MDA快速下降,并在48 h之后保持稳定,推测此时雌蕊应激响应达到平衡,整体处于稳定状态。
2.4 自交与远缘杂交授粉后雌蕊可溶性蛋白、可溶性糖含量变化
授粉后不同时间,自交与远缘杂交授粉雌蕊可溶性蛋白、可溶性糖含量变化(图3)表明:自交与远缘杂交授粉0~36 h,可溶性蛋白及可溶性糖含量均表现为波动上升趋势,自交与远缘杂交的可溶性蛋白含量分别在24、36 h达最大,分别为52.90、50.48 mg·g−1,可溶性糖含量分别在 12、8 h 达到最大,分别为 30.17、31.64 mg·g−1;授粉36 h后,二者含量相对稳定。由此说明,可溶性蛋白及可溶性糖在柱头识别及应对外来刺激作用中起着重要作用,其中,可溶性糖较可溶性蛋白含量变化小,表明在柱头识别及应对外来刺激作用中,可溶性蛋白起着主导作用。出现此现象可能的原因是,在柱头识别阶段,可溶性蛋白作为识别蛋白的重要组成,积极参与柱头的识别作用。此外,授粉作为外来刺激,雌蕊内部平衡破坏,加速雌蕊代谢,进一步提高了可溶性蛋白及可溶性糖含量,而表现出升高的趋势,随着刺激减弱,二者含量也相对保持平稳。

图3 授粉后雌蕊可溶性蛋白含量及可溶性糖含量变化Fig.3 Changes of soluble protein content and soluble sugar content in pistils after pollination
2.5 自交与远缘杂交授粉后雌蕊IAA、GA3含量变化
图4表明:自交与远缘杂交授粉雌蕊IAA、GA3含量变化整体表现为上升-下降-上升趋势。整体上自交授粉雌蕊较远缘杂交授粉雌蕊IAA含量高,尤其在授粉前期表现较显著。自交授粉雌蕊IAA、GA3含量上升趋势较远缘杂交早,授粉后3~6 h自交授粉雌蕊IAA含量便急速显著上升(P<0.05),并在 6 h 达最大 45.28 ng·g−1;自交授粉GA3含量在授粉后1~3 h快速上升,高于远缘杂交授粉雌蕊,此阶段自交授粉花粉萌发多,花粉管生长迅速。随着远缘杂交授粉GA3含量的升高,远缘杂交授粉雌蕊花粉开始萌发,花粉管伸长生长。表明高水平IAA、GA3对花粉在柱头的识别及花粉萌发、花粉管的生长起促进作用,IAA、GA3作为中间物质,起着传递生长信号的作用。
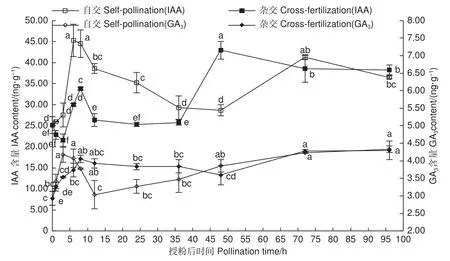
图4 授粉后雌蕊 IAA 及GA3 含量变化Fig.4 Changes of IAA and GA3 content in pistils after pollination
2.6 自交与远缘杂交授粉后雌蕊IPA含量变化
图5表明:自交与远缘杂交雌蕊授粉后IPA含量均表现出先升高后下降趋势。授粉后1~36 h,自交授粉雌蕊IPA含量处于较高水平且保持相对稳定,远缘杂交授粉雌蕊IPA含量呈波动上升,同样保持在较高水平,其中,授粉后3~8 h,自交授粉雌蕊IPA含量高,显微特征表现为花粉管迅速伸长生长,远缘杂交授粉雌蕊IPA含量较低,显微镜观察发现花粉管有胼胝质沉积及扭曲缠绕现象,推测高水平IPA对花粉管的伸长生长有促进作用;36 h之后均急速下降,之后保持相对稳定,花粉管生长也趋于稳定状态,自交授粉含量依然高于远缘杂交授粉。

图5 授粉后雌蕊 IPA 含量及(IAA+GA3)/ABA 变化Fig.5 Changes of IPA content and (IAA+GA3)/ABA in pistils after pollination
2.7 自交与远缘杂交授粉后雌蕊(IAA+GA3)/ABA变化
图5表明:自交授粉雌蕊(IAA+GA3)/ABA显著高于远缘杂交授粉雌蕊。授粉0~36 h,远缘杂交授粉雌蕊(IAA+GA3)/ABA仅在授粉后6 h有上升趋势,此时远缘杂交授粉雌蕊处于花粉萌发、花粉管快速生长阶段,此时ABA含量依然较高,花粉管扭曲严重;自交授粉雌蕊(IAA +GA3)/ABA仅在授粉后36~48 h较低,此时花粉管已伸入子房。
2.8 自交与远缘杂交授粉后雌蕊ABA、JA含量变化
图6表明:授粉0~24 h,自交与远缘杂交授粉雌蕊ABA含量变化趋势相反,自交授粉雌蕊ABA含量稍下降,远缘杂交授粉雌蕊则急速显著上升(P<0.05),并保持在较高水平,此阶段自交授粉花粉萌发,花粉管生长迅速,远缘杂交授粉花粉管扭曲严重,胼胝质沉积较多;授粉0~3 h,自交与远缘杂交授粉雌蕊JA含量均上升,远缘杂交授粉上升趋势更显著,此时自交授粉花粉少量萌发,远缘杂交授粉花粉未见萌发;授粉3~12 h,JA含量均呈下降趋势,此时花粉管处于快速生长阶段;12 h之后,自交授粉雌蕊JA含量保持相对稳定,远缘杂交授粉雌蕊JA含量再次上升,授粉72 h之后保持稳定,此时花粉管已伸长到胚珠部分;24~36 h期间,自交与远缘杂交授粉雌蕊ABA含量均有大幅度上升,48 h之后呈现轻微下降趋势,显微镜观察发现花粉管伸长生长到子房部分。整个授粉受精期间,远缘杂交授粉雌蕊ABA含量远高于自交雌蕊,JA含量整体上也较自交授粉雌蕊高。推测在花粉-柱头识别阶段,JA含量的升高影响了花粉黏附及花粉的水合作用,进而阻碍了远缘杂交雌蕊花粉的萌发;同时,伴随着ABA含量的快速增加,高含量ABA致使远缘杂交授粉花粉管胼胝质沉积较多,阻碍花粉管进一步伸长生长,表现出扭曲缠绕生长停滞。
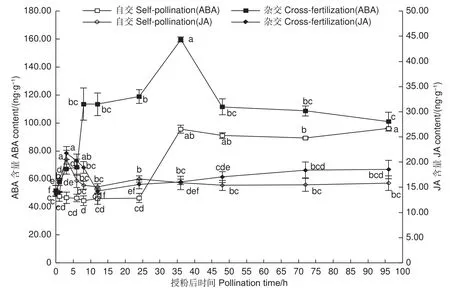
图6 授粉后雌蕊 ABA 及JA 含量变化Fig.6 Changes of ABA and JA content in pistils after pollination
3 讨论
受精前障碍是多数植物远缘杂交天然生殖障碍的主要原因[14-15],相关研究表明,胼胝质大量积累是远缘杂交不亲和受精前障碍的主要细胞学原因之一,绒毡层的花粉外壁蛋白与柱头乳突细胞质膜蛋白相互识别,亲和性授粉,柱头会分泌囊泡,提供花粉萌发所需的水合物质;不亲和授粉,胼胝质产生积累在乳突细胞,扰乱花粉水合作用,进而抑制花粉萌发[16]。李辛雷等[17]在菊属(Chrysanthemum L.)植物远缘杂交研究中发现,不亲和杂交组合柱头上花粉粒黏附少,花粉萌发率低,花粉管生长异常,难以进入花柱;高山杜鹃(Rhododendron lapponicum (L.) Wahl.)远缘杂交后,花粉管、花柱、胚珠等产生大量胼胝质,导致受精障碍而无法结实是其不亲和的主要原因[18];牡丹芍药远缘杂交也因花粉管扭曲、缠绕、分枝、胼胝质沉积等表现为受精前障碍[19-21]。本试验研究结果表明,‘凤丹’与保康牡丹远缘杂交受精前障碍明显,胼胝质沉积在其中起着主导作用,原因可能是远缘杂交授粉引起的胁迫反应,干扰了花粉管细胞发育过程中细胞壁内层胼胝质的正常合成,引起胼胝质异常累积,从而造成花粉管生长紊乱,出现扭曲缠绕现象。
授粉作为一种外来刺激,会在柱头及子房内引起酶活性及渗透调节物质含量变化。SOD作为植物防御系统里重要的抗氧化酶,通过清除过量的活性氧来保护植物免受外界刺激产生的伤害,高水平SOD有利于花粉-柱头的识别、黏附及花粉在柱头的萌发[13]。吴能表等[22]在对甘蓝(Brassica oleracea var.capitata L.)杂交授粉研究中发现,授粉后雌蕊SOD活性会显著上升,亲和性授粉较不亲和性授粉上升更显著;在芸芥(Eruca sativa Mill.)自花授粉研究中,自交亲和授粉雌蕊SOD活性变化较自交不亲和变化更显著[10]。本研究结果表明,授粉亲和雌蕊SOD活性升高明显,特别在授粉前期花粉管迅速生长阶段,SOD活性急速显著升高(P<0.05),推测此时雌蕊内部清除活性氧系统迅速加强,外界刺激诱发的活性氧被迅速清除,为花粉管正常生长提供了便利环境。MDA作为膜脂过氧化最终产物,其含量高低可直接反映细胞受伤害程度[23]。张雪梅等[24]在苹果(Malus pumila Mill.)自花授粉研究中发现,授粉前期自交亲和雌蕊MDA含量较自交不亲和高,48 h之后随着自交亲和雌蕊MDA含量下降,花粉管持续生长,自交不亲和雌蕊MDA含量升高,花粉管在花柱内停止生长;Ren等[25]对芍药花粉冷冻保存研究发现,冷冻过程中细胞膜脂过氧化加剧促使MDA含量的增加,细胞功能受损,细胞凋亡率升高,花粉萌发率下降。本试验结果显示,花粉萌发、花粉管的生长诱导MDA含量快速升高,同时伴随MDA含量的急速显著升高(P<0.05),远缘杂交授粉花粉管扭曲缠绕并伴有大量胼胝质沉积,推测出现此现象的原因可能是雌蕊细胞膜脂过氧化,导致柱头及花柱细胞功能受阻,引导花粉管有序生长的信号物质减少,致使花粉管无序生长,进而出现扭曲缠绕,无法顺利穿过花柱进入子房完成受精。可溶性蛋白和可溶性糖既是渗透调节物质又是柱头识别物质的主要成分,在植物授粉过程中有着重要作用。此外,蛋白质代谢是连接植物体内三大代谢的枢纽,在植物抗逆生理中具有重要作用[26]。吴能表等[22]在甘蓝杂交研究中发现,自花或异花授粉,均能引起甘蓝体内生理生化反应,伴随花柱内蛋白含量的升高,促进甘蓝体内代谢改变。本研究结果表明,授粉后自交与远缘杂交雌蕊可溶性蛋白含量均表现为先升高后下降趋势,可溶性糖含量在小范围波动,整体远缘杂交雌蕊可溶性糖含量较自交雌蕊含量高,原因可能是远缘杂交花粉对柱头刺激作用更加明显,柱头对花粉识别及排异作用加强,加速了雌蕊代谢作用,排异物质增加,花粉管生长受阻,显微特征表现为花粉管内胼胝质的沉积及花粉管扭曲缠绕。
GA3、IAA、ABA、JA等是植物花粉萌发及花粉管生长中的重要调控物质[27-29],张鹏等[30]在加杨(Populus×canadensis Moench)自交和与银腺杨(P.alba×P.glandulosa)杂交授粉时发现,亲和性授粉GA3、IAA、ZR含量较不亲和授粉含量高,ABA含量较不亲和授粉含量低;刘懿瑶[31]研究表明,茉莉酸信号转导参与了油茶(Camellia oleifera Abel.))的自交授粉过程,进而参与植物防御过程,花柱中花粉管缓慢生长时,子房接收到JA信号,启动抑制自交授粉亲和的分子机制,花粉管生长受阻;低水平的IPA、ZR、GA3含量引起花粉管尖端膨大、扭曲折叠,是同源四倍体黑皮冬瓜(Benincasa hispida (Thunb.)Cogn.)自交低稔的原因之一[32]。本研究结果表明,在前期花粉-柱头识别阶段,自交授粉雌蕊IAA含量显著高于远缘杂交授粉雌蕊,随IAA含量显著升高(P<0.05),花粉萌发、花粉管生长迅速,表明高水平IAA对亲和性授粉过程中花粉萌发有促进作用。授粉前期,自交授粉IPA、GA3含量较高,远缘杂交授粉花粉开始萌发时IPA、GA3含量升高,推测高水平IPA、GA3有利于花粉管生长,这与贺丹等[13]在芍药牡丹远缘杂交研究结果相似。Kim等[33]研究表明,JA与ABA相互作用来调节植物反应和对非生物胁迫的耐受性,同时JA激活ABA合成基因,促进了ABA的生物合成。Rajesh 等[34]研究表明,ABA调控CALLOSE SYNTHASE 1(CALS1)基因表达上调,抑制分解胼胝质的葡聚糖酶,从而诱导细胞内胼胝质堵塞,限制获得促进生长的信号达到对杨树芽休眠的效果。本研究结果表明,在授粉过程中,远缘杂交授粉雌蕊JA含量高于自交授粉雌蕊,远缘杂交授粉雌蕊ABA含量远高于自交授粉雌蕊,特别在授粉后6 h,ABA含量急剧显著升高(P<0.05),此时远缘杂交雌蕊胼胝质沉积较多,花粉管扭曲严重,推测ABA含量的升高是伴随JA含量升高延迟发生的,二者共同作用,诱导花粉管细胞内胼胝质堵塞,对花粉管伸长生长起抑制作用。此外,低水平(IAA+GA3+ZR)/ABA是自交不亲和的特征表现[35],高水平(IAA+GA3)/ABA有利于授粉亲和[12],本研究也证实了这一点,亲和性授粉(IAA+GA3)/ABA远高于不亲和授粉,这说明在杂交不亲和中起决定作用的是生长素和赤霉素与脱落酸的比值,而不是含量的绝对值。
4 结论
受精前障碍是‘凤丹’与保康牡丹远缘杂交不亲和的主要原因,具体体现在花粉-柱头的识别作用及花粉管能否正常伸长生长。Fu等[14]通过盐溶液处理柱头以破坏柱头识别作用,有效克服了亚洲百合(Lilium Asiatica Hybrida)与东方百合((Lilium spp.) Oriental hybrids)受精前障碍;Chen等[15]对烟草(Nicotiana tabacum L.)进行延迟授粉,避开柱头识别功能强效阶段,从而克服烟草杂交不亲和受精前障碍;郝津藜等[36]通过对柱头施加外源GA3,大幅提高牡丹远缘杂交结实率,在一定程度上克服了牡丹远缘杂交受精前障碍。结合本试验,推测通过施加外源IAA、GA3、IPA类植物激素及通过对柱头识别功能的破坏,或可有效克服‘凤丹’与保康牡丹受精前障碍,有效提高育种效率,但实际效果有待进一步研究论证。
