云南4种野生猕猴桃基因组大小测定与比较
2022-08-03王连润李坤明沙毓沧丁仁展
王连润,陶 磅,万 红,陈 霞,李坤明,沙毓沧,丁仁展
(云南省农业科学院园艺作物研究所,昆明,650205)
基因组大小(或称C值)是指一个物种单倍体核的DNA含量,通常用质量(pg)或核苷酸碱基对数目(Mb)表示,1 pg相当于978 Mb[1]。基因组反映了物种全部和特定的遗传信息,测定物种的基因组大小可为植物的基因组学及其亲缘进化关系等研究提供参考依据[2-3]。孚尔根染色法和流式细胞术(flow cytometry,FCM)是目前测定基因组大小最常用的方法,其中FCM因简单便捷、分析速度快、灵敏度高、可靠性好等优点而被广泛用于生物学研究[4-5],如用于茉莉、越橘及草莓等植物基因组大小及倍性研究[3,6-7]。
猕猴桃属(Actinidia)植物全世界有66种,约118个种下分类单位(变种、变型)[8],果实具有较高的经济价值和药用价值,在医药、食品加工等方面有着广泛的用途[9-11],果实以富含维生素C、风味好而受到消费者青睐。云南野生猕猴桃资源丰富,分布有猕猴桃属56个种、变种及变型[12-13],种类之多居全国之首[14],在研究该属植物的系统分类及资源利用等方面具有重要价值。目前,关于云南猕猴桃属资源基因组大小的研究鲜见报道,对其基因组学的研究还相对匮乏。对云南省丰富的野生猕猴桃资源开展深入研究是筛选新的育种种质资源,扩展育种遗传基础的重要途径。本研究对收集保存的4种云南野生猕猴桃资源的基因组大小进行了测定和比较分析,可为进一步开展云南猕猴桃资源的基因组学及种群进化研究等提供参考。
1 材料与方法
1.1 试验材料
供试猕猴桃材料见表1。2020年9—10月在健康、无病虫害的野生猕猴桃植株上采集枝条嫁接保存,2021年3月22日在嫁接苗上采集幼嫩叶片用于基因组大小测定分析。对照红阳幼嫩叶片采自屏边县源盘果业有限公司猕猴桃种植基地。作为内参的玉米(Zeamays)B73(基因组大小为2.40 pg)和番茄(Solanumlycopersicum)(基因组大小为0.92 pg)幼嫩叶片由中国科学院昆明植物研究所提供。每个材料设3个重复。

表1 供试猕猴桃材料及采集地
1.2 仪器设备及试剂
美国Becton-Dickinson(BD)公司生产的FACSCalibur流式细胞仪。荧光染料碘化丙啶(propidium iodide,PI),购自西格玛奥德里奇(上海)贸易有限公司。MgCl2·6H2O、MOPS[3-(N-吗啡啉)乙磺酸,CAS:1132-61-2)、柠檬酸钠、PVP 40(聚乙烯醇吡咯烷酮40,CAS:9003-39-8)、Triton X-100(曲拉通X-100,CAS:9002-93-1)、Na2EDTA(乙二胺四乙酸二钠)和β-巯基乙醇等试剂,购自生工生物工程(上海)股份有限公司。所用试剂均为分析纯。
1.3 试验方法
1.3.1 细胞解离液制备 选用mGb解离液[45 mmol/L MgCl2·6H2O,20 mmol/L MOPS,30 mmol/L柠檬酸钠,1%(w/v)PVP 40,0.2%(v/v)Tritonx-100,10mmol/L Na2EDTA,20μL/mLβ-巯基乙醇],将解离液pH值调至7.5。
1.3.2 细胞核悬浮液制备 取供试植物材料的新鲜嫩叶,用去离子水洗净表面灰尘,用滤纸吸干后每个材料各取3份,每份约0.5 g,分别置于0.8 mL预冷的细胞解离液中,迅速用锋利的刀片将组织垂直切碎,使其在解离液中冰上静置10 min,接着用400目滤网过滤,即得细胞核悬浮液。
1.3.3 DNA染色 在细胞核悬浮液中,同时加入适当体积的预冷的PI和RNAase溶液,置于冰上,避光染色0.5~1 h。PI和RNAase的母液浓度均为1 mg/mL,工作液浓度均为50 μg/mL[15-17]。
1.3.4 流式细胞仪检测 分别以番茄和玉米为内参,将待测样品和内参样品染色后的细胞核悬浮液按适当比例混合。流式细胞仪预热15 min后,样品上机检测。采用488 nm的蓝光作激发,收集560~650 nm的荧光信号,每次检测收集10 000个颗粒,变异系数(CV)控制在5%以内,每个样品3次重复。使用流式细胞仪自带的Modifit 3.0分析软件作图分析。
1.3.5 基因组大小计算 PI是一种荧光染料,能均匀嵌入到双链核酸碱基对中,可以对DNA进行特异性染色。在488 nm激发光下,PI发出的荧光可被流式细胞仪检测且PI在着色过程中的嵌入量与DNA量呈正比关系,因此荧光强度可以表示出基因组DNA的相对含量。观察待测样品和内参植物PI-DNA复合体的荧光峰值,即可得出两种植物核DNA含量比值,再乘以内参植物核DNA含量(已知),即可计算出待测植物核DNA含量。计算公式:待测样品核DNA含量1C值(pg)=内参样品核1C值×(待测样品的荧光峰值/内参样品的荧光峰值)[17]。
2 结果与分析
2.1 细胞解离效果
试验结果看出,猕猴桃材料与内参植物的细胞核清晰集中且无交叉(见图1),获得的荧光峰图清晰,杂峰较少、无重叠峰且区分度良好,表明用基因组大小已知的番茄和玉米作为内标测定猕猴桃基因组大小是可行的,结果准确。
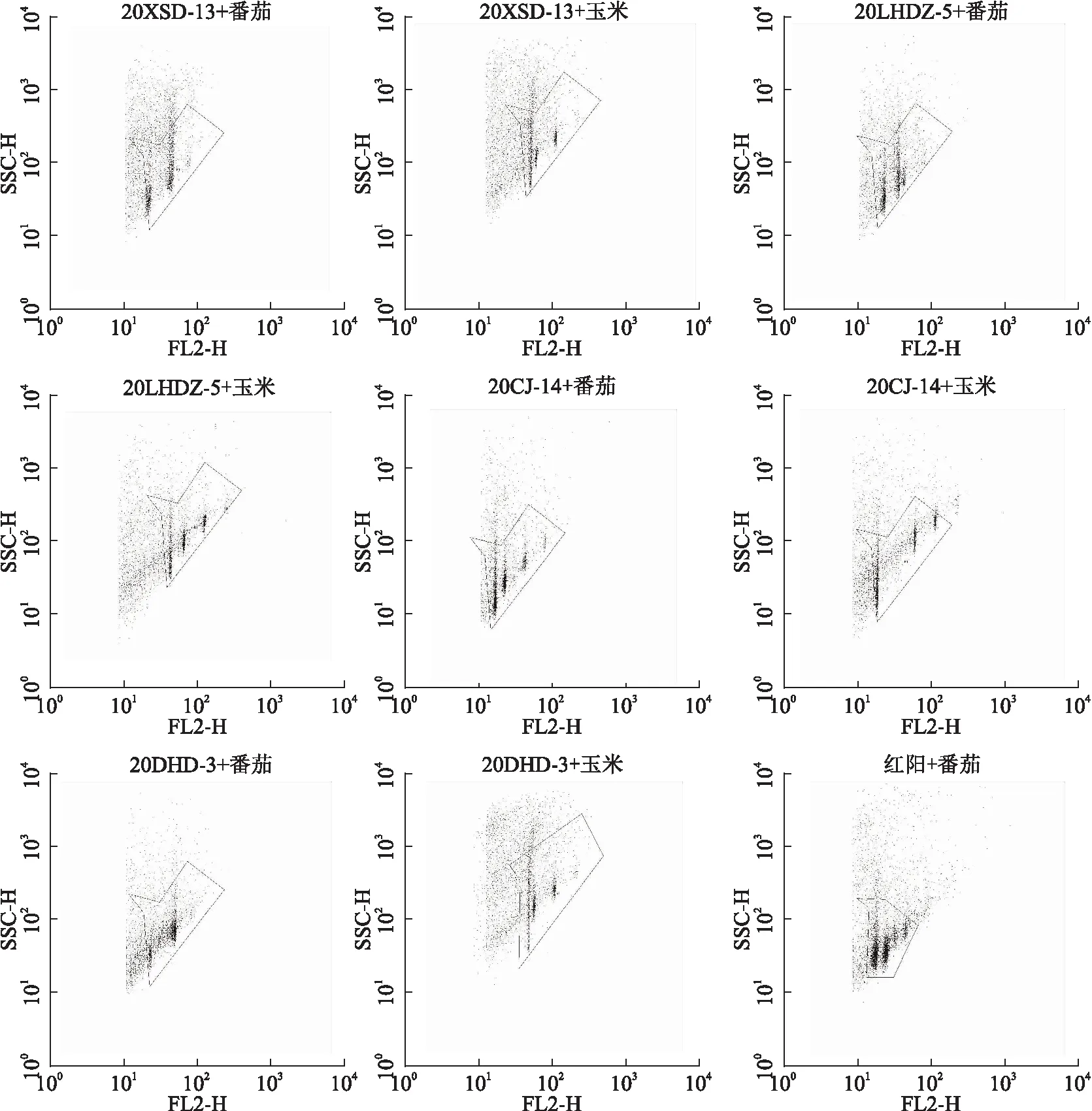
注:FL2-H为荧光信号,代表荧光信号相对强度;SSC-H为侧向散射光,代表颗粒密度及复杂度。
2.2 基因组大小
试验结果表明,供试猕猴桃材料的基因组大小关系为:美味猕猴桃20DHD-3(1.92 pg)>中华猕猴桃20XSD-13(1.89 pg)>京梨猕猴桃20LHDZ-5(1.49 pg)>显脉猕猴桃20CJ-14(0.70 pg)>中华猕猴桃红阳(0.65 pg),两两间差异显著(见表2)。
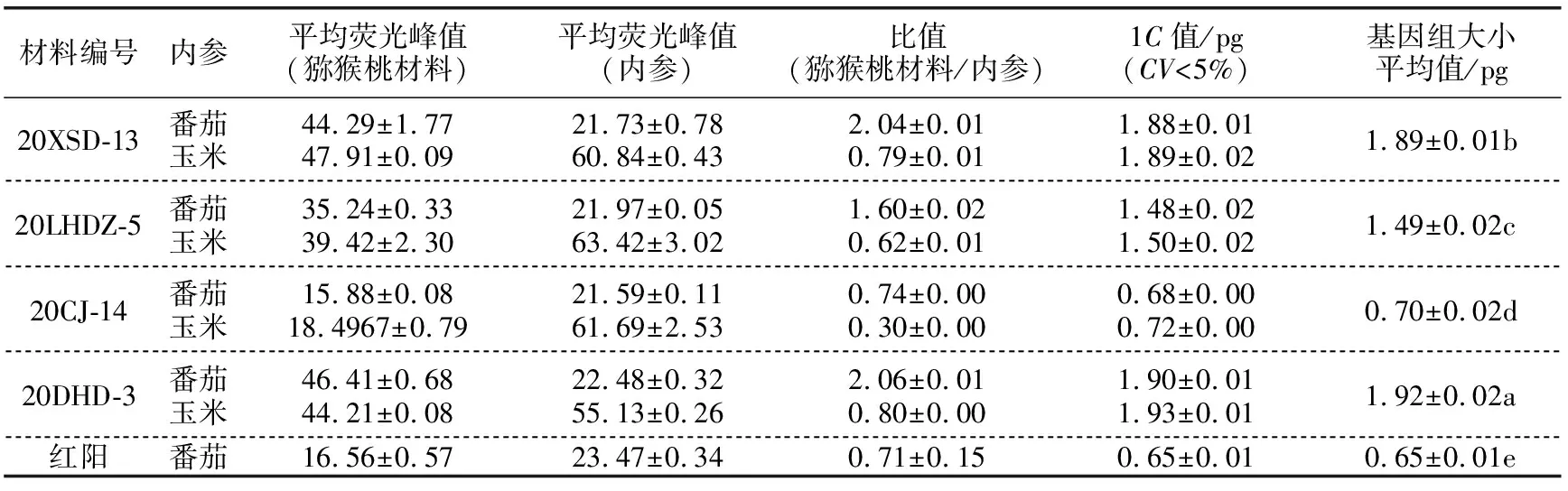
表2 4种野生猕猴桃基因组大小测定结果
3 讨论
Bennett等[18]对24种被子植物种内DNA含量变化的研究发现,种内DNA含量变化是很普遍的现象,种内DNA含量变化在4%~28%之间。张俊环等[19]对杏属植物基因组大小的测定结果表明,同一种内不同变种类型的基因组大小差异也较大。在本研究中,野生中华猕猴桃20XSD-13基因组大小(1.89 pg)与对照品种中华猕猴桃红阳的基因组大小(0.65 pg)存在显著性差异。染色体的多倍化、B染色体、非整倍体、染色质变异及基因重复与丢失等都可能会对种内DNA含量变异有一定的作用[20]。植物基因组DNA含量会被某种特定的选择力影响,如纬度、气候、海拔及地区差异都有可能造成DNA含量的变异[21-22]。中华猕猴桃野生资源20XSD-13和栽培品种红阳的基因组大小差异巨大的原因有待进一研究。
基因组大小与其表型性状之间有着复杂的关系,目前比较确定的观点认为,基因组大小与细胞大小呈正相关关系[23-24]。本研究结果表明,4种野生猕猴桃的基因组大小之间存在显著性差异,同时,4种野生猕猴桃在果形、果实大小、果皮颜色等方面也存在较大差异。4种野生猕猴桃基因组大小与细胞大小之间的关系尚不清楚。
本研究对4种野生猕猴桃的基因组大小进行了测定和比较分析,丰富了猕猴桃种质资源的生物学信息,为进一步开展野生猕猴桃种质资源基因组学及系统进化研究等奠定了基础。
