NCF1基因突变与不明原因复发性流产关联性的初步研究
2022-08-02李蕾蕾顾恒刘晓华李龙毓陈海红钟兴明
李蕾蕾,顾恒,刘晓华, 李龙毓,陈海红,钟兴明
不明原因复发性流产(unexplained recurrent spontaneous abortion,URSA)因其发病机制不明,治疗效果及预后均不佳,已成为妇产科疾病中诊治的难点。近年来,对胚胎植入及母胎界面发生机理的认识已深入到分子层面。妊娠过程就是一种同种异体移植的免疫耐受过程,从胚胎种植到成功分娩,在很大程度上依赖于母胎界面免疫耐受的形成[1]。遗传因素可能是其病因之一,关于URSA的母体遗传因素基因的荟萃分析显示:共有37个基因的53个遗传多态性与URSA有显著相关性[2],遗传因素与炎症免疫机制在疾病发生过程中的作用得到越来越多的关注。发现并鉴定与炎症免疫过程相关的基因,将其与 URSA进行关联性研究,是确定URSA易感基因的重要手段。
基于此,我们对70例URSA患者进行全外显子测序,筛选其与炎症免疫机制相关的高频致病候选突变。参考2015年美国制定的解读标准和指南[3],最后发现,36例患者(51%)检出意义未明的NCF1c.269G>A,p.R90H(rs201802880)杂合变异。查在线数据库结果显示:该位点在ExAC数据库中的人群频率为低频频率,千人数据库中未收录,HGMD数据库中有文献收录提示其与中华人群系统性红斑狼疮的高易感性相关,同时使用4种生物学软件进行预测,3种(Mutation Taster、CADD、SIFT)提示均为有害突变。查阅文献发现该位点变异位于NAPDH氧化酶的活性位点,与多种自身免疫性疾病相关。前期研究结果提示:NCF1基因突变可能是URSA的易感基因之一。然而关于NCF1基因突变与URSA发病的关系,研究却非常少见,尚未发现相关报道。本研究提出NCF1基因rs201802880位点突变可能与URSA发病相关,通过病例对照研究遗传关联分析,希望能进一步揭示NCF1基因突变与URSA的相关性。
1 资料与方法
1.1 研究对象
收集2019年1月至2020年10月在广东省计划生育专科医院就诊的102例患者为病例组。纳入标准:20~40岁;与同一性伴侣发生在28周前≥2次的自然流产,包括生化妊娠。
排除标准:① 拷贝数变异检测胚胎染色体异常引起的流产;② 夫妻双方任何一方染色体异常;③ 生殖器官畸形,排除经B超或造影确实有生殖器官畸形者;④ 生殖道感染或全身感染;⑤ 内分泌异常,排除甲状腺功能异常、多囊卵巢综合征、黄体功能不全、糖尿病等疾病;⑥ 自身免疫性疾病,排除系统性红斑狼疮、抗磷脂抗体综合征等自身免疫性疾病;⑦ 男方精液异常。
同期纳入在广东省计划生育专科医院就诊的53例妇女为对照组,纳入标准为月经规则,至少生育过1个健康胎儿,无不良妊娠史以及妊娠并发症者。排除标准:① 有家族遗传病史的患者;② 有严重内科疾病,如心、肝、肾功能障碍者;③ 有自身免疫性相关疾病及代谢性疾病者。
1.2 临床资料收集
收集两组研究对象的基本临床信息,包括年龄、生育史,家族史、身高、体重,计算孕前体质量指数(body mass index,BMI)、不良生活习惯(吸烟史、饮酒史)等情况。
1.3 实验方法
1.3.1 引物设计 针对目标片段设计引物,最终引物由Invitrogen公司进行合成。NCF1 rs201802880目标位点巢式PCR引物序列:上游:GCTTTCCCCCAGGTGTAC,下游:CCTTCCCTCTCCCACCT。实时定量PCR引物序列上游:CAGCTCCCAAGTGGTTTGACGG,下游:GGTGGGCAGGCTCATGA。TagMan荧光探针引物序列:探针1:CCCTGGCGGTTCTC,探针2:CCCTGGTGGTTCTC。
1.3.2 目的片段PCR扩增 提取血液DNA,采用巢式PCR方法扩增,再行RT-PCR进行目标片段扩增,结合TaqMan荧光探针技术检测NCF1基因位点rs201802880,检测基因分型。
1.4 统计学方法
2 结果
2.1 两组一般临床特征比较
两组的年龄、孕前BMI、吸烟、饮酒史等一般临床资料比较,差异无统计学意义(P>0.05),详见表1。
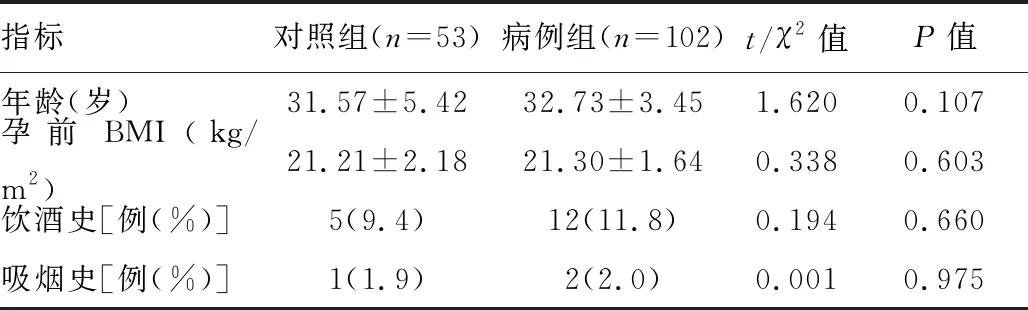
表1 两组一般临床特征比较
2.2 NCF1基因的不同基因型测序图示例

2.3 NCF1基因的Hardy-Weinberg(H-W)平衡检测
NCF1基因rs201802880位点基因分布经过H-W检测,符合H-W平衡(P>0.05)。详见表2。

表2 NCF1基因的H-W平衡检测
2.4 NCF1基因不同基因型在两组的分布分析
病例组中NCF1基因rs201802880位点GG型发生频率为68.6%;GA型为28.4%,较少;AA型仅有2.9%。对照组中多数为GG型(88.7%),其次为GA型(11.3%),未见AA型病例,将GA型与AA型合并,在病例组中的分布频率为31.4%,显著高于对照组的11.3%,差异有统计学意义(P<0.05)。G、A等位基因在病例组的分布频率为82.8%和17.2%,在对照组的分布频率为94.3%和5.7%,两组比较差异有统计学意义(P<0.05)。详见表3。
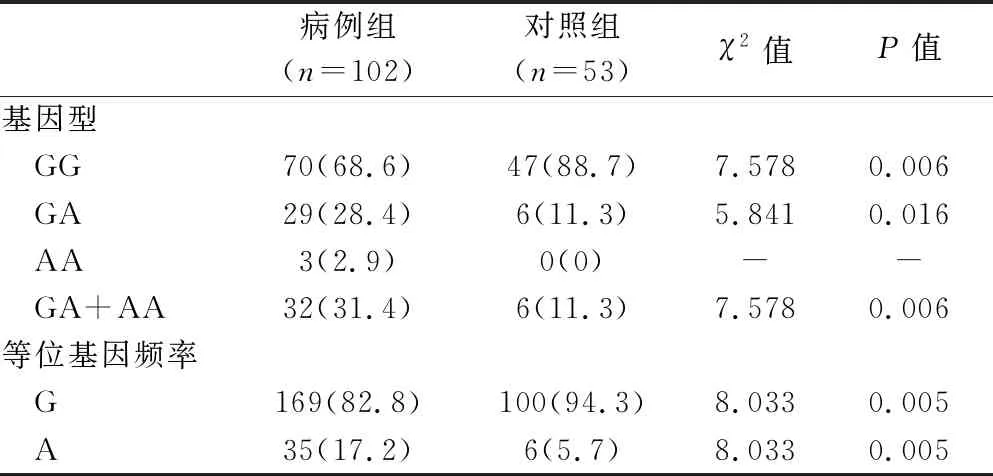
表3 NCF1基因不同基因型在两组的分布[例(%)]
2.5 NCF1 基因不同基因型与不明原因复发性流产的危险性分析
将GG型设为参考组(OR值为1),GA型与AA型合并后发现,携带GA型和AA型的对象发生URSA的危险性比携带GG基因型的高,OR值为3.581(95%CI:1.389-9.232),P<0.05。详见表4。
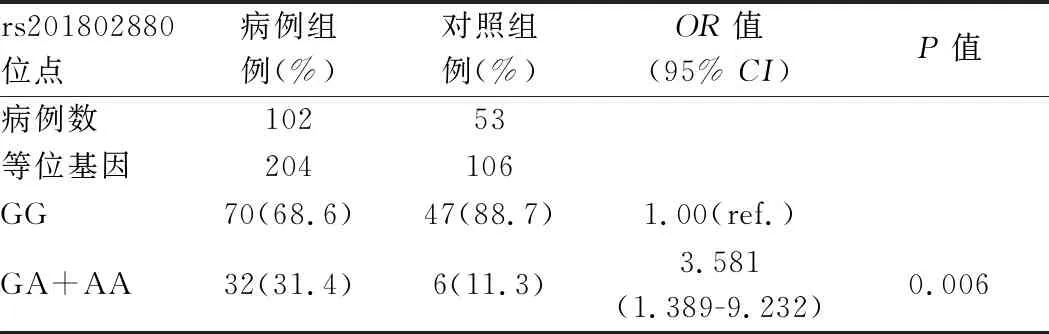
表4 NCF1基因不同基因型与URSA的危险性分析
2.6 病例组中不同流产次数对象之间的资料分层分析
将病例组按不同自然流产次数分为3组:2次、3次及3次以上。对所有患者的年龄、孕前BMI、是否生育过活胎、流产周数及等位基因频率等资料进行分层分析,流产周数以孕12周为界,<12周为早期流产,反之为晚期流产。结果显示不同流产次数对象的年龄、孕前BMI、是否生育过活胎比较,差异无统计学意义(P>0.05),早期流产分层未分析出统计学结果。不同流产次数等位基因频率对比,差异有统计学意义(P<0.05),详见表5。
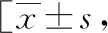
表5 病例组中不同流产次数对象之间的资料分层分析例(%)]
3 讨论
3.1 NCF1基因
NCF1基因编码的蛋白为中性粒细胞胞质因子-1(NCF1),也称为p47-phox,是还原型辅酶Ⅱ(NADPH)氧化酶的最为重要且关键亚基,在病原菌入侵的情况下,p47-phox分子构象发生改变,中性粒细胞中的NADPH氧化酶会被激活,产生大量活性氧(reactive oxygen species,ROS),介导对入侵的病原菌实行清除[4]。p47-phox的缺失会造成吞噬细胞NADPH氧化酶功能丧失[5],以致于无法产生大量的ROS作为一种天然免疫过程来杀死入侵的细菌和真菌。研究证明:NCF1的错义突变(G.74779296 G>A;P.Arg90His),使其编码吞噬细胞NADPH氧化酶的p47-phox亚基发生变异,导致ROS生成减少,妇女易患系统性红斑狼疮[6]。另有研究发现:p47-phox 缺陷型的小鼠,被细菌感染后,会形成致死性感染和严重的肉芽肿炎症,小鼠体内的这种肉芽肿炎症反应和慢性肉芽肿患者的十分相似[7]。
3.2 NCF1基因突变与URSA的相关性
通过对NCF1基因 rs201802880位点进行H-W平衡检测:各基因实际检出例数均与预计频率相当接近,说明群体符合H-W平衡,群体遗传平衡,所选择的群体具有群体代表性。
根据分析结果显示:NCF1基因rs201802880位点不同基因型在两组的分布存在统计学差别,GA+AA基因型在病例组中的分布显著高于对照组。与对照组相比,病例组中A等位基因的分布较多,G等位基因的分布较少,差异均有统计学意义。将GG型设为参考组(OR值为1),GA型与AA型合并后发现,携带GA、AA基因型的对象发生自然流产的危险性比携带GG基因型的高。由此可推断,NCF1基因rs201802880位点可能与URSA相关,GA、AA基因型可能是其易感基因。
把病例组不同流产次数对象资料进行分层分析,发现不同流产次数的等位基因频率差异有统计学意义,随着流产次数增多,A等位基因比例越高,G等位基因比例越低。在纯合A突变的3例患者中,流产次数均≥3次,其中一例3次,一例5次,另一例7次,且均没有生育过活胎,纯合子A基因型病例流产次数较多,无活产,提示纯合A突变可能与URSA关系更密切。
如前言所述,成功妊娠很大程度上依赖于母胎界面免疫耐受的形成。NCF1基因突变引起NADPH 氧化酶复合物缺陷而不能正常活化,导致ROS生成改变,进而影响NF-κB信号通路[4]。炎症通路的激活,可导致滋养细胞凋亡增加,增值减少[8-9],妊娠期滋养细胞炎症细胞因子升高与流产相关[10],NCF1基因是否通过此机制及路径导致母胎界面免疫失衡,促使了炎症发生,进而导致反复自然流产?这些问题尚未清楚,有待进一步深入研究。
本研究主要在基因层面上初步探究NCF1基因rs201802880位点G→A突变与URSA之间的关系,研究表明NCF1基因rs201802880位点与URSA相关,GA基因型、AA基因型的个体发生URSA的风险增加,A等位基因可能是其危险因素。局限与不足:未进一步探究NCF1基因突变具体通过什么机制、什么通路来导致URSA;还需设计严密、多中心、大样本并在不同人群中进行深入研究来进一步验证NCF1基因突变与URSA的关系,将会有更强的说服力。
