胡黄连葫芦烷型四环三萜类化合物及其生物活性的研究进展
2022-08-02吉海杰郝淑兰王淑敏王晞星唐旭东
吉海杰,郝淑兰,吕 林,王淑敏,王晞星*,唐旭东, 4*
胡黄连葫芦烷型四环三萜类化合物及其生物活性的研究进展
吉海杰1, 2,郝淑兰1,吕 林3,王淑敏1,王晞星1*,唐旭东3, 4*
1. 山西省中医药研究院&山西省中医院,山西 太原 030012 2. 中国中医科学院博士后流动站,北京 100700 3. 中国中医科学院西苑医院,北京 100091 4. 中国中医科学院,北京 100700
胡黄连为中医临床清虚热要药,目前一般认为其功效与环烯醚萜类、苯乙醇糖苷类和酚苷类化合物相关,而对于胡黄连所含葫芦烷型四环三萜类化合物及其生物活性关注较少。研究表明含有α,β-不饱和酮结构的葫芦烷型四环三萜属于迈克尔反应受体小分子,具有抗肿瘤等重要药理活性。对胡黄连中的葫芦烷型四环三萜类化合物进行综述,一方面比较了2种基原胡黄连所含葫芦烷型四环三萜类化合物的差异,另一方面对此类化合物的生物活性研究进行总结,为深入探索胡黄连功效的物质基础提供参考。
印度胡黄连;西藏胡黄连;葫芦烷型四环三萜;2--glucoside-picracin;细胞毒性;免疫调节
胡黄连为中医临床常用的清虚热药,其性寒,味苦,归肝、胃、大肠经,具有清热凉血、燥湿消疳等功效[1]。《唐新修本草》记载胡黄连“出波斯国,生海畔陆地,八月上旬采”。宋代《开宝本草》则记载胡黄连为“割孤露泽”。20世纪70年代以前我国所用胡黄连为主产印度的玄参科胡黄连属植物胡黄连Royle ex Benth的干燥根茎,又称印度胡黄连。1965年我国生药学家在西藏和云南西北部发现了其同属近缘植物胡黄连Pennell,因该植物根茎在生药形态、组织、苦味度及化学成分等方面与印度胡黄连非常相似,被命名为西藏胡黄连[2]。《中国药典》从1977年版开始以西藏胡黄连取代印度胡黄连,从而结束了胡黄连依赖进口的历史。
大量研究表明,2种基原胡黄连均含有环烯醚萜、葫芦烷型四环三萜、苯乙醇糖苷和酚苷等化合物,另外还含有酚酸如香草酸和肉桂酸等[3-4]。现代药理学研究表明,胡黄连具有保肝利胆、调节血脂、抗哮喘、抗炎和降血糖等作用[5]。目前多认为胡黄连功效与环烯醚萜、苯乙醇糖苷和酚苷类等化合物相关,而对葫芦烷型四环三萜类化合物及其生物活性关注较少。葫芦烷型四环三萜作为一类天然存在的迈克尔反应受体小分子,广泛存在于天花粉、瓜蒂、雪胆、药西瓜、罗汉果等多种中药[6],具有抗肿瘤、保肝、抗炎、抗生育及胃肠刺激等作用[7],提示胡黄连中葫芦烷型四环三萜类化合物的研究应该得到重视。既往文献对胡黄连的化学成分及药理研究均未严格区分基原,本文重点对2种基原胡黄连中的葫芦烷型四环三萜类化合物及其生物活性的研究进行系统综述。
1 化学成分
葫芦烷型四环三萜是一类19-甲基结合在C-9位的高度氧化植物次生物质,由氧化鲨烯演变为甾体的中间体,再经葫芦素烷醇合成酶生成葫芦素烷醇,进一步氧化形成[8]。葫芦烷型四环三萜的基本骨架为9β-甲基-19-降羊毛甾烷-5-烯,见图1。其结构特点为C8-β-H、C9-β-CH3、C10-α-H、C13-β-CH3、C14-α-CH3以及C17-α侧链。根据C-2、C-3、C-11的官能团及C-17侧链差异可分为12大类,包括葫芦素A~T等[9]。
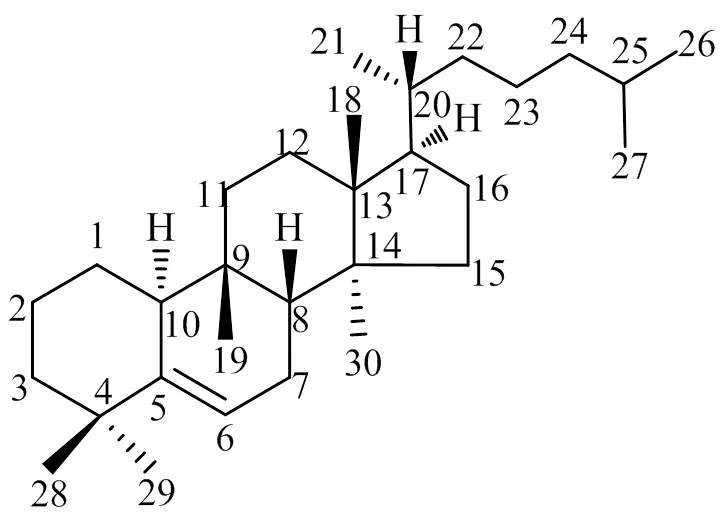
图1 葫芦烷型四环三萜的基本骨架
胡黄连中葫芦烷型四环三萜多采用甲醇或乙醇提取,浓缩后经氯仿或醋酸乙酯萃取进一步经硅胶或氧化铝柱色谱分离。根据其所含α、β-不饱和酮结构在228~230 nm处有最大吸收的特点,可采用高效液相色谱-紫外检测法进行纯化及含量测定。如图2所示,目前从胡黄连中共分离鉴定出29个葫芦烷型四环三萜类化合物,母核结构中C-2、C-3、C-16位均被氧化,如C-2位均为β-OH,C-3位为β-OH或羰基,C-16位则均为α-OH,而部分化合物C-11位为羰基,其中C2-OH性质活泼易与葡萄糖形成2β--吡喃葡萄糖氧四环三萜类葫芦烷型皂苷。根据C-2、C-3、C-11和C-16氧化程度及C-17侧链中C-22、C-23和C-25官能团差异可将胡黄连葫芦烷型四环三萜进一步分类:化合物3~5、16和28属于葫芦素B族衍生物,如化合物3为葫芦素B葡萄糖苷,化合物4为二氢葫芦素B葡萄糖苷,化合物5为去乙酰氧基葫芦素B葡萄糖苷;化合物10~12及18属于葫芦素D族衍生物,如化合物18为葫芦素D葡萄糖苷;化合物13~15及17属于葫芦素F族衍生物,其中化合物17为葫芦素F葡萄糖苷;化合物1、2、6~9、19~27及29均属于O、P和Q族衍生物,其中化合物6为葫芦素Q葡萄糖苷。另外因C23-C24位不饱和键的存在可出现顺反异构体,同侧者为型,异侧者则为型。由图2可以看出,胡黄连中葫芦烷型四环三萜类化合物多为E型,如化合物1、3、6~9、17、18和25,属于Z型的包括化合物10、15、19,而化合物1与化合物19则互为顺反异构体,这也提示在提取分离此类化合物时需要注意顺反异构体的转化。
从基原角度来看,印度胡黄连中分离出的首个葫芦烷型四环三萜为化合物1[10],这也是西藏胡黄连中报道的首个葫芦素[11],其C-25位脱去乙酰基则为化合物7,2种基原胡黄连也均有报道[12-13],但上述2个化合物相应的苷元化合物8和化合物9仅在西藏胡黄连有报道[14],印度胡黄连含有25种葫芦烷型四环三萜,而西藏胡黄连仅含有11种。构效关系研究表明,葫芦烷型四环三萜C11-OH处于α构型则味甜,处于β构型或C-11为羰基则味苦[15]。印度胡黄连所含25个化合物的C-11为羰基或饱和烃,而西藏胡黄连中11个化合物的C-11则均为饱和烃,均具有苦味。另外,印度胡黄连所含化合物11~14的R3侧链上C-20与C-24形成环氧结构[16],其余则均为支链结构。有研究采用高效液相色谱-质谱方法从印度胡黄连中可同时检测出已报道25个葫芦烷型四环三萜中的18个化合物[17],提示可围绕这些化合物的差异构建基原鉴别方法,另一方面也可以采用DNA分子标记技术探索两者的基因差异,以丰富传统基原鉴定方法[18]。另有研究报道采用薄层色谱方法发现印度胡黄连抗肿瘤活性部位含有葫芦素B和E等[19],但因未分离出相应单体化合物,故未收录。胡黄连中的葫芦烷型四环三萜类化合物见表1和图2。

表1 胡黄连中的葫芦烷型四环三萜类化合物
a-印度胡黄连 b-西藏胡黄连
>a-b-
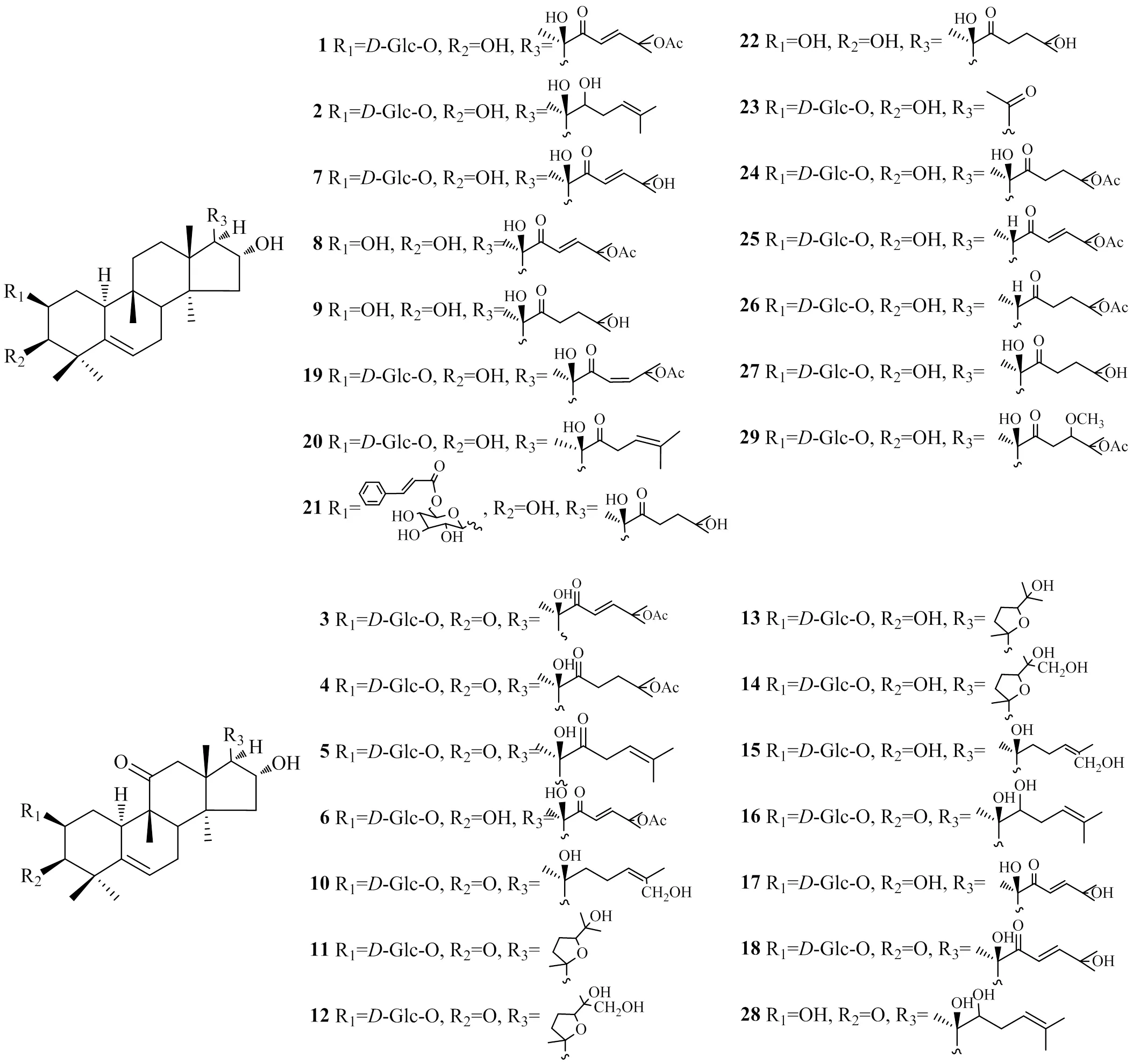
图2 胡黄连中葫芦烷型四环三萜类化合物的化学结构
2 生物活性
研究发现,含有亲电共轭体系的迈克尔反应受体分子能与半胱氨酸残基中的巯基发生迈克尔加成反应,形成共价键进而产生重要的生物学效应[26]。葫芦烷型四环三萜C-17位侧链上多含有α、β-不饱和酮结构,属于天然迈克尔反应受体,具有抗肿瘤、抗炎和保肝等作用[27],其抗肿瘤活性尤为突出[28-29],为胡黄连中葫芦烷型四环三萜类化合物的生物活性研究提供了线索。
2.1 细胞毒性
葫芦素B、D、E、Q和R等具有广谱抗肿瘤作用,可诱导细胞凋亡、自噬、细胞周期阻滞和破坏细胞骨架等[30],其中以葫芦素B抗肿瘤作用研究较多[31]。构型关系研究表明,葫芦素B、二氢葫芦素B、葫芦素D和二氢葫芦素D的细胞毒性作用由强到弱[32-33],提示母核骨架中C22-C24位α、β-不饱和酮结构和C-25位乙酰氧基是细胞毒性的必需基团。Janus激酶(Janus-activated kinase,JAK)/信号传导和转录激活子(signal transducer and activator of transcription,STAT)信号通路与肿瘤发生、侵袭和转移关系密切,其中以JAK2-STAT3信号通路研究最为广泛。体外培养肺癌A549细胞研究表明,葫芦素Q可选择性抑制p-STAT3诱导细胞凋亡,而对p-JAK2水平无影响,葫芦素A则相反;而葫芦素B、E和I对两者均具有抑制作用;初步构效研究表明葫芦素抑制两者的活性与其结构中C-3和C-11位基团相关,C-3位羰基转化为羟基则抑制JAK2活化,而C-11位为羟基则无STAT3抑制活性[34]。
胡黄连含有多种四环三萜类葫芦烷型皂苷,如葫芦素B糖苷(3)、二氢葫芦素B糖苷(4)、葫芦素Q糖苷(6)及葫芦素D糖苷(18)等。研究发现化合物3对多种瘤株杀伤活性均较其苷元葫芦素B显著降低,此现象也存在于化合物18与其苷元葫芦素D[25,33],提示葫芦素C2-OH与葡萄糖形成皂苷后细胞毒减弱。由于人体缺乏将葫芦素糖苷转化为苷元的酶,有研究从土壤和污水样品中分离纯化得到45株霉菌和放线菌株,成功筛选到1种可将葫芦素B糖苷转化为葫芦素B的链霉菌[35]。另外化合物8和9体外60 µmol/L对T细胞未见明显细胞毒作用[14],前者成苷后的化合物1体外100 µmol/L对成纤维细胞也未见明显毒性[36]。
2.2 免疫调节
大量研究已证实胡黄连具有免疫调节和抗炎作用,如印度胡黄连提取物对绵羊红细胞诱导的小鼠迟发型超敏反应具有明显抑制作用[37],西藏胡黄连乙醚提取物可抑制补体系统的经典激活途径、多形核白细胞的呼吸爆发和有丝分裂原诱导的T淋巴细胞增殖,并可抑制角叉菜胶致小鼠足肿胀,而乙醚提取物中所含罗布麻宁、草夹竹桃苷及胡黄连苷Ⅱ均无上述生物活性[38]。体外以植物血凝素诱导的T细胞增殖模型研究西藏胡黄连中化合物8、9的活性,发现二者抑制T细胞增殖的半数抑制浓度(half-maximal inhibitory concentration,IC50)均为1 µmol/L[14]。提示葫芦烷型四环三萜类化合物可能是胡黄连发挥免疫调节作用的活性成分,也为其用于治疗以T细胞介导为主的自身免疫性疾病提供初步依据。
2.3 抗疟疾
疟疾是一种经蚊叮咬或输入带疟原虫的血液而感染疟原虫的虫媒传染病。《本草纲目》记载具有治疗疟疾的中草药多达174种,20世纪70年代屠呦呦科研团队受《肘后备急方》启发,采用低沸点溶剂乙醚成功从青蒿中提取分离到具有抗疟活性的青蒿素,因此获得2015年诺贝尔生理学或医学奖。最近有学者采用恶性疟原虫3D7对有抗疟疾功效的中药进行筛选研究,从胡黄连抗疟疾活性部位分离到的10个化合物中以化合物1活性较好,其抑制疟原虫的IC50为(8.3±0.6)µmol/L,而其他包括化合物25在内的9个化合物的IC50均>25 µmol/L,比较化合物1与25发现C22-C24位α、β-不饱和酮结构为葫芦烷型四环三萜抗疟疾活性的必要基团[36]。尽管青蒿素及其衍生物是抗疟疾的一线药物,但抗疟药的耐药性是一个棘手而普遍存在的科学难题,相关机制的阐明及新型先导化合物的发现对于临床破解耐药及提高抗疟疗效同样重要。胡黄连中葫芦烷型四环三萜抗疟疾活性的发现为抗疟药物设计与研究提供了新的方向。
2.4 促进胶原合成
胡黄连作为“胡药”自中古时期从古印度引入,据考证阿育吠陀医学将胡黄连用于皮肤病的治疗[39],但其物质基础不明确。胶原蛋白是机体结缔组织的重要组成部分,广泛存在于皮肤、骨骼、肌肉、软骨和关节等组织,主要由成纤维细胞合成与分泌,多种酶参与其分解代谢,其中以胶原酶的作用最为突出。近年来有研究采用人成纤维细胞评价印度胡黄连中多种化合物对胶原蛋白合成的影响,发现化合物3、24在10~30 µmol/L可促进胶原蛋白合成,而化合物18、23、29则无明显作用,同时这些合物对胶原酶均无明显抑制作用[25]。该研究为探索胡黄连外用治疗皮肤疾病及美容养颜提供了线索,进一步丰富《唐本草》中胡黄连“益颜色”的中医科学内涵。
3 结语与展望
胡黄连富含环烯醚萜苷类化合物,《中国药典》2020年版规定胡黄连苷I、II总量不得少于9.0%[40],而葫芦烷型四环三萜类化合物含量相对较低,故长期以来人们对胡黄连中该类成分及其生物活性关注较少。现代药理研究表明葫芦烷型四环三萜类化合物具有抗肿瘤、抗炎和保肝等作用,提示此类化合物或为胡黄连功效物质基础之一。目前报道胡黄连含有29种葫芦烷型四环三萜类化合物,且多以葡萄糖苷化合物形式存在,同时印度胡黄连较西藏胡黄连含有较多种类葫芦烷型四环三萜,其中2--glucoside-picracin(1)等7种为两者共有,而对于2种基原中葫芦烷型四环三萜类化合物含量比较有待于进一步研究;另一方面胡黄连中葫芦烷型四环三萜皂苷细胞毒性较相应苷元减弱,同时具有免疫调节、抗疟疾及促进胶原蛋白合成等生物活性。另外有学者在长期的临床实践中发现胡黄连免煎剂具有未被传统本草学著作记载的泻下功效[41],而泻下成分仍不明确。因此,深入研究胡黄连中葫芦烷型四环三萜类化合物的生物活性及作用机制,对于阐明胡黄连传统功效物质基础及探索新的药理作用具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] 国家中医药管理局《中华本草》编委会. 中华本草(第7册) [M]. 上海: 上海科学技术出版社, 1999: 370.
[2] 张惠兰, 夏光成, 楼之岑. 国产胡黄连的植物及生药学研究 [J]. 药学学报, 1965(12): 808-816.
[3] 朱仝飞, 陈日荣, 孙庆文, 等. 西藏胡黄连化学成分研究 [J]. 中草药, 2017, 48(2): 263-265.
[4] 马力峥, 康利平, 南铁贵, 等. 西藏胡黄连与印度胡黄连的化学成分及药理作用研究进展 [J]. 中国中药杂志, 2021, 46(23): 6114-6129.
[5] Guo N, Jin C, Shen L,. Chemical components, pharmacological actions, and clinical applications of[J]., 2020, 34(5): 1071-1082.
[6] Kaushik U, Aeri V, Mir S R. Cucurbitacins - An insight into medicinal leads from nature [J]., 2015, 9(17): 12-18.
[7] 吉宏. 葫芦素及其药理学研究 [J]. 国外医学: 中医中药分册, 1996, 18(6): 13-14.
[8] Shibuya M, Adachi S, Ebizuka Y. Cucurbitadienol synthase, the first committed enzyme for cucurbitacin biosynthesis, is a distinct enzyme from cycloartenol synthase for phytosterol biosynthesis [J]., 2004, 60(33): 6995-7003.
[9] Chen J C, Chiu M H, Nie R L,. Cucurbitacins and cucurbitane glycosides: Structures and biological activities [J]., 2005, 22(3): 386-399.
[10] Laurie W A, McHale D, Sheridan J B. A cucurbitacin glycoside from[J]., 1985, 24(11): 2659-2661.
[11] 贺震旦, 杨崇仁, 王答祺, 等. 西藏胡黄连的化学成分 [J]. 云南植物研究, 1993, 15(1): 83-88.
[12] Stuppner H, Wagner H. New cucurbitacin glycosides from[J]., 1989, 55(6): 559-563.
[13] Wang H, Ye W C, Zhao S X. Cucurbitacin glycosides and the monoterpene jiofuran from[J]., 2004, 32(1): 87-89.
[14] Smit H F, van den Berg A J, Kroes B H,. Inhibition of T-lymphocyte proliferation by cucurbitacins from[J]., 2000, 63(9): 1300-1302.
[15] 林晓琴, 杨培全. 葫芦烷型四环三萜化合物的研究 [J]. 华西药学杂志, 1997, 12(2): 106-109.
[16] Stuppner H, Moller E P. Cucurbitacins with unusual side chains from[J]., 1993, 33(5): 1139-1145.
[17] Sturm S, Stuppner H. Analysis of cucurbitacins in medicinal plants by high-pressure liquid chromatography-mass spectrometry [J]., 2000, 11(2): 121-127.
[18] 李松, 孙利生, 唐锴. 西藏胡黄连与印度胡黄连的对比 [J]. 首都食品与医药, 2015, 22(15): 55.
[19] Mallick M N, Singh M, Parveen R,. HPTLC analysis of bioactivity guided anticancer enriched fraction of hydroalcoholic extract of[J]., 2015, 2015: 513875.
[20] Stuppner H, Kählig H, Seligmann O,. Minor cucurbitacin glycosides from[J]., 1990, 29(5): 1633-1637.
[21] Stuppner H, Müller E P, Wagner H. Cucurbitacins from[J]., 1991, 30(1): 305-310.
[22] Kim I H, Uchiyama N, Kawahara N,. Iridoid glycosides and cucurbitacin glycoside from[J]., 2006, 67(24): 2691-2696.
[23] Li J X, Li P, Tezuka Y,. Three phenylethanoid glycosides and an iridoid glycoside from[J]., 1998, 48(3): 537-542.
[24] Sindhu N, Pratima T, Ashwini W. Isolation of a cucurbitacin fromby column chromatography and its characterization [J]., 2011, 2(3): 149-156.
[25] Morikawa T, Inoue N, Nakanishi Y,. Collagen synthesis-promoting and collagenase inhibitory activities of constituents isolated from the rhizomes ofRoyle ex Benth [J]., 2020, 143: 104584.
[26] 赵勤实, 从玉文. 迈克尔反应受体分子化学生物学研究 [J]. 化学进展, 2007, 19(12): 1972-1976.
[27] 张金芳, 张晓瑞, 郑敏思, 等. 葫芦素类化合物的药理作用研究进展 [J]. 医药导报, 2020, 39(12): 1710-1716.
[28] Hussain H, Green I R, Saleem M,. Cucurbitacins as anticancer agents: A patent review [J]., 2019, 14(2): 133-143.
[29] Lin X K, Farooqi A A. Cucurbitacin mediated regulation of deregulated oncogenic signaling cascades and non-coding RNAs in different cancers: Spotlight on JAK/STAT, Wnt/β-catenin, mTOR, TRAIL-mediated pathways [J]., 2021, 73: 302-309.
[30] Cai Y E, Fang X F, He C W,. Cucurbitacins: A systematic review of the phytochemistry and anticancer activity [J]., 2015, 43(7): 1331-1350.
[31] Garg S, Kaul S C, Wadhwa R. Cucurbitacin B and cancer intervention: Chemistry, biology and mechanisms (Review) [J]., 2018, 52(1): 19-37.
[32] Matsuda H, Nakashima S, Abdel-Halim O B,. Cucurbitane-type triterpenes with anti-proliferative effects on U937 cells from an Egyptian natural medicine,: Structures of new triterpene glycosides, bryoniaosides A and B [J]., 2010, 58(5): 747-751.
[33] Frei B, Heinrich M, Herrmann D,. Phytochemical and biological investigation of[J]., 1998, 64(4): 385-386.
[34] Sun J Z, Blaskovich M A, Jove R,. Cucurbitacin Q: A selective STAT3 activation inhibitor with potent antitumor activity [J]., 2005, 24(20): 3236-3245.
[35] Mei J F, Li S, Jin H,. A biotransformation process for the production of cucurbitacin B from its glycoside using a selectedsp. [J]., 2016, 39(9): 1435-1440.
[36] Wang H M, Zhao W M, Choomuenwai V,. Chemical investigation of an antimalarial Chinese medicinal herb[J]., 2013, 23(21): 5915-5918.
[37] Hussain A, Shadma W, Maksood A,. Protective effects ofon cyclophosphamide-induced immunosuppression in mice [J]., 2013, 5(1): 30-35.
[38] Smit H F, Kroes B H, van den Berg A J,. Immunomodulatory and anti-inflammatory activity of[J]., 2000, 73(1/2): 101-199.
[39] 杨崇仁. 中古时期我国传统植物药与印度的交流 [J]. 亚太传统医药, 2018, 14(1): 1-9.
[40] 中国药典 [S]. 一部. 2020: 254.
[41] 赵怀舟, 王小芸, 冯文海, 等. 胡黄连免煎剂的泻下作用 [J]. 山西中医, 2016, 32(2): 49-51.
Research progress on cucurbitane-type tetracyclic triterpenes inand their bioactivities
JI Hai-jie1, 2, HAO Shu-lan1, LYU Lin3, WANG Shu-min1, WANG Xi-xing1, TANG Xu-dong3, 4
1. Shanxi Province Academy of Traditional Chinese Medicine, Shanxi Traditional Chinese Medical Hospital, Taiyuan 030012, China 2. Postdoctoral Research Station, China Academy of Chinese Medical Sciences, Beijing 100700, China 3. Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China 4. China Academy of Chinese Medical Sciences, Beijing 100700, China
Huhuanglian () is used for clearing asthenic fever in traditional Chinese medicine. It has been believed that these effects are related with iridoids, phenylethanol glycosides and phenolic glycosides in. However, there is little attention on cucurbitane-type tetracyclic triterpenoids and their bioactivities. Studies have shown that cucurbitacins containing α, β-unsaturated ketones belong to Michael reaction receptor molecules, which exert important pharmacological activities such as anti-tumor. Cucurbitane-type tetracyclic triterpenes inare reviewed in this paper. The distinction in cucurbitacins betweenofandand bioactivities of cucurbitacins are systematacially summarized, in order to provide reference for further exploring material basis of efficacy of.
Royle ex Benth;Pennell; cucurbitane-type tetracyclic triterpenoids; 2--glucoside-picracin; cytotoxicity; immunoregulation
R282.710.5
A
0253 - 2670(2022)15 - 4875 - 07
10.7501/j.issn.0253-2670.2022.15.031
2022-02-18
科技部国家重点研发计划项目(2019YFC1709600);国家自然科学基金面上项目(81873297);国家自然科学基金面上项目(81973672)
吉海杰(1982—),男,医学博士,主要从事中药药效物质基础及机制研究。E-mail: jihaijie82@hotmail.com
通信作者:王晞星,国医大师,主任医师,主要从事中医药防治肿瘤病临床与基础研究。E-mail: wangxx315@163.com
唐旭东,国际欧亚科学院院士,主任医师,博士生导师,主要从事中医药防治消化系统疾病临床与基础研究。E-mail: txdly@sina.com
[责任编辑 崔艳丽]
