毛华菊中1个新的愈创木内酯类化合物
2022-08-02张洪权王艳丽董馨语周巧巧朱世明熊校勤
张洪权,王艳丽,董馨语,向 涛,周巧巧, 2,朱世明, 2,熊校勤,张 蕾, 2,郑 平, 2*,刘 杰
毛华菊中1个新的愈创木内酯类化合物
张洪权1, 2, 3,王艳丽1,董馨语1,向 涛1,周巧巧1, 2,朱世明1, 2,熊校勤1, 2, 3,张 蕾1, 2,郑 平1, 2*,刘 杰4
1. 湖北第二师范学院化学与生命科学学院,湖北 武汉 430205 2. 植物抗癌活性物质提纯与应用湖北省重点实验室,湖北 武汉 430205 3. 鄂东药用植物资源开发与利用研究中心,湖北 武汉 430205 4. 武汉恒和达生物医药有限公司,湖北 武汉 430056
研究毛华菊的化学成分及体外肿瘤细胞毒活性。采用溶剂提取法、Diaion HP-20柱色谱、Sephadex LH-20葡聚糖凝胶柱色谱、硅胶柱色谱及制备高效液相色谱等色谱方法,对毛华菊氯仿部位的化学成分进行分离纯化,并利用现代波谱技术对已分离得到的化合物进行结构鉴定。MTT法测定各化合物体外对人肝癌HepG2细胞增殖的抑制活性。从毛华菊的氯仿部位分离得到3个化合物,分别鉴定为(1,5,6,7,8,10)-8-乙酰氧基-愈创木- 3,11(13)-二烯-2-酮-12,6-内酯(1)、(1,5,6,7,8,10,11)-8-乙酰氧基-愈创木-3-烯-2-酮-12,6-内酯(2)和2α-(2′,4′- hexadiynoyl)-1,6-dioxaspiro [4,5]-deca-3-ene(3)。化合物2为1个新的愈创木内酯,命名为毛华菊内酯A,其对HepG2细胞增殖没有明显的抑制作用;化合物1的氢谱全谱、碳谱以及绝对构型为首次报道,它对HepG2细胞具有较强的体外抑制作用,半数抑制浓度(median inhibition concentration,IC50)值为(5.95±0.19)μmol/L;化合物3为首次从毛华菊中分离得到。
毛华菊;愈创木内酯;肿瘤细胞毒活性;(1,5,6,7,8,10)-8-乙酰氧基-愈创木- 3,11(13)-二烯-2-酮-12,6-内酯;毛华菊内酯A
毛华菊(Hemsley) Stapf为菊科(Compositae)菊属(DC.) Des Moul.植物,生长于河南、湖北、安徽等地海拔340~1500 m低山山坡及丘陵地[1],其花入药或代茶饮,具有清热解毒的功效[2]。毛华菊是参与菊花起源的重要近缘种[3],菊花作为我国传统的一味中药材,具有散风清热、平肝明目、清热解毒的作用[4],其主要的药效成分为黄酮、挥发油和苯丙素类化合物等,现代药理研究表明,菊花具有抗氧化、抗炎、抗病毒、抗肿瘤和保护肝脏等功效[5],但是关于菊花起源的重要近缘种毛华菊的化学成分及药理活性特别是抗肿瘤活性鲜有文献报道。毛华菊甲醇提取物具有抑菌活性[6],水提物具有抗氧化活性[7]。本课题组已经从毛华菊中分离得到了6个倍半萜内酯类化合物,其中4个为新的愈创木内酯衍生物[8];另外还分离得到了包括2个聚炔类化合物、3个黄酮类化合物在内的6个已知化合物[9]。为了进一步阐明毛华菊的化学成分,寻找结构新颖的具有抗肿瘤活性的天然产物,本课题组继续对采自湖北省大别山的毛华菊化学成分进行研究,从其氯仿部位分离得到3个倍半萜内酯类化合物:(1,5,6,7, 8,10)-8-乙酰氧基-愈创木-3,11(13)-二烯-2-酮- 12,6-内酯[(1,5,6,7,8,10)-2--8-acetoxy- guaia-3,11(13)-dien-12,6-olide,1]、(1,5,6,7,8, 10,11)-8-乙酰氧基-愈创木-3-烯-2-酮-12,6-内酯[(1,5,6,7,8,10,11)-2--8-acetoxy-guaia-3-en- 12,6-olide,2]、2α-(2′,4′-hexadiynoyl)-1,6-dioxaspiro [4,5]-deca-3-ene(3)。其中化合物2为1个新的愈创木内酯,命名为毛华菊内酯A;结构见图1。活性筛选显示,化合物1对人肝癌HepG2细胞增殖具有显著的抑制作用,半数抑制浓度(median inhibition concentration,IC50)值为(5.95±0.19)μmol/L。
1 仪器与材料
AV-400 MHz、AV-600 MHz型超导核磁共振仪(德国Bruker公司);SolariX 7.0T型高分辨傅里叶变换质谱仪(德国Bruker公司);Nicolet iS50R型傅里叶变换红外光谱仪(美国Thermo Scientific公司);Autopol Ⅳ旋光仪(美国Rudolph公司);UV-5200PC型紫外可见分光光度计(上海元析仪器有限公司);X-6精密显微熔点测定仪(北京亚力恩机电技术研究所);2535型制备型高效液相色谱仪(美国Waters公司);制备高效液相色谱柱XBridgeTMPrep C18柱(250 mm×19 mm,5 μm,美国Waters公司);Milli-Q Integral 5型纯水仪(德国Merck Millipore公司);R-210型旋转蒸发仪(瑞士Büchi公司);miVac Quattro真空离心浓缩仪(英国GeneVac公司)。氘代试剂:CDCl3(美国CIL公司);色谱纯甲醇(美国Thermo Fisher Scientific公司);色谱纯四氢呋喃(上海星可高纯溶剂有限公司);Sephadex LH-20葡聚糖凝胶(瑞典GE公司);Diaion HP-20型大孔吸附树脂(日本三菱公司);200~300目硅胶(青岛海洋化工厂);氯仿和甲醇等均为国产分析纯试剂(湖北欣申试化工科技有限公司)。

图1 化合物1和2的化学结构
毛华菊于2017年7月采自于湖北省英山县李家寨(N 31°1'5.29″;E 116°2'1.67″),由湖北第二师范学院化学与生命科学学院戴月副教授鉴定为菊科菊属植物毛华菊(Hemsley) Stapf,原植物标本(20170725)现存于湖北第二师范学院化学与生命科学学院植物标本室。
2 提取与分离
毛华菊干燥全草4.0 kg,粉碎,95%乙醇(20 L)室温下渗漉提取,合并提取液,减压浓缩得总浸膏约1000 g,加水混悬,依次用石油醚、氯仿、醋酸乙酯、正丁醇萃取,得石油醚部位85 g、氯仿部位134 g、醋酸乙酯部位82 g,正丁醇部位158 g。氯仿部位上Diaion HP-20大孔树脂柱,依次用水及20%、40%、60%、80%、90%、100%甲醇-水体系洗脱,将以上各洗脱液浓缩。Diaion HP-20 80%甲醇洗脱部分(25.33 g)进行正相硅胶柱色谱,用石油醚-醋酸乙酯(体积比100∶0、10∶1、5∶1、3∶1、2∶1、1∶1、1∶3、0∶1)梯度洗脱,薄层色谱(TLC)检测合并,得到21个组分(记作Fr. 1~21)。将Fr. 10(1.004 g)经葡聚糖凝胶LH-20柱,用石油醚-二氯甲烷-甲醇(4∶5∶1)洗脱,得到2个组分,Fr. a-1和Fr. a-2。Fr. a-1 (314.1 mg)经制备高效液相(甲醇-四氢呋喃-水5∶5∶90,体积流量17.0 mL/min)得到化合物1(3.2 mg,R=76.0 min)、2(9.8 mg,R=60.0 min)。Diaion HP-20 100%甲醇洗脱部分经MCI树脂柱色谱,以水-乙醇体系梯度洗脱,其中80%乙醇洗脱流份经反复硅胶柱色谱和制备型高效液相(prep HPLC)等色谱技术分离纯化,得到化合物3(2.8 mg)。
3 结构鉴定
化合物1:白色针状晶体(正己烷-二氯甲烷),易溶于氯仿,mp 170~172 ℃。[α]20 D+446.33 (0.10, CHCl3);(nm): 242 (2.37), 308 (2.10)。(cm−1): 2922, 1764, 1748, 1693, 1616, 1228, 1153, 1031, 959;HR-ESI-MS显示分子式为C17H20O5(计算值C17H20NaO5[M+Na]+327.120 29,测量值为327.120 17),不饱和度为8。13C-NMR和DEPT谱显示,该化合物结构中含有17个碳信号,包括3个CH3、2个CH2、7个CH和5个C(表1)。IR光谱中显示出-内酯(1764 cm−1)、α, β-不饱和羰基(1693 cm−1)和双键(1616 cm−1)的特征信号[10]。1H-NMR谱中显示的2个二重峰信号[H6.35 (1H, d,= 3.4 Hz)] 和[H5.84 (1H, d,= 3.4 Hz)] 是α-亚甲基--倍半萜内酯环外亚甲基氢的特征吸收峰[11]。1H-NMR谱还显示有1个二重峰甲基氢[H0.95 (3H, d,= 7.6 Hz)]、1个乙烯基甲基氢[H2.32 (3H, brs)] 和1个烯氢[H6.08 (1H, brs)] 信号。1H-1H COSY谱中相关信号显示[H2.77 (1H, dd,= 7.2, 4.0 Hz, H-1),H3.16~3.20 (1H, m, H-5),H4.37 (1H, dd,= 10.8, 9.2 Hz, H-6),H3.08~3.14 (1H, m, H-7),H5.14 (1H, td,= 10.0, 4.4 Hz, H-8),H1.72 (1H, ddd,= 14.0, 9.6, 2.4 Hz, H-9α),H2.57~2.65 (1H, m, H-10),H0.95 (3H, d,= 7.6 Hz, H-14)] 偶合体系(图2)。HMBC图谱中显示下列远程相关信号:H6.35 (H-13) 和C135.4 (C-11), 49.0 (C-7), 169.0 (C-12);H1.72 (H-9α) 和C16.7 (C-14), 71.7 (C-8);H2.27 (H-9β) 和C49.0 (C-7), 71.7 (C-8), 53.3 (C-1), 30.7 (C-10);H3.16~3.20 (H-5) 和C78.3 (C-6), 178.3 (C-4)。这些相关信号表明化合物1为愈创木烷型的倍半萜骨架。H6.08 (H-3) 和C52.4 (C-5), 207.9 (C-2) 之间的远程相关信号表明该化合物为具有3-烯-2-酮结构的愈创木内酯[12]。化合物1的结构中有1个乙酰基片段[H2.14 (s, 3H);C21.2, 169.6],在HMBC谱中,H5.14 (H-8) 与乙酰基羰基碳C169.6 (C-16) 有相关信号,且C-8出现在低场区(C71.7),推测C-8与乙酰基通过氧原子相连成酯。这样,化合物1的平面结构确定为8-乙酰氧基-愈创木-3,11(13)-二烯-2-酮-12,6-内酯。

表1 化合物1和2的1H-NMR 和13C-NMR数据(400/100 MHz, CDCl3)
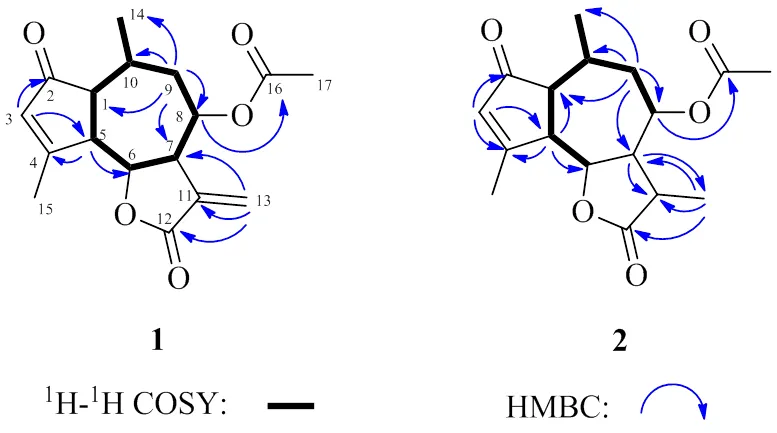
图2 化合物1和2的关键1H-1H COSY和HMBC相关
化合物1的相对构型可以通过NOESY谱(图3)进行确认。在化合物1的NOESY谱中,H3-14与H-6和H-8有相关信号,H-7与H-5、H-5和H-1、H-1和H-10有相关信号,因此H3-14和H-6、H-8在同一侧,H-7、H-1、H-5和H-10在另一侧。由于在天然愈创木内酯类化合物中,H-7为α构型[10,13-14],因此H-1、H-5和H-10为α构型,H-6和H-8为β构型。因此,确认化合物1为8α-乙酰氧基-愈创木- 3,11(13)-二烯-1α,5α,6β,7α,10α氢-2-酮-12,6α-内酯,化合物1的绝对构型是通过X-ray单晶衍射(图4)来确定的,最终,化合物1鉴定为(1,5,6, 7,8,10)-8-乙酰氧基-愈创木-3,11(13)-二烯-2-酮- 12,6-内酯。经Scifinder检索,化合物1的结构有文献报道[15-17],但是查阅原始文献后发现:文献报道的物质montanone结构为11,15-dihydroxy- iphionan-4-one[15-16],与本实验的化合物1的结构完全不一样;另外,文献报道[17]的化合物montanone其平面结构与本实验的化合物1的平面结构相同,但是文献只报道了部分手性碳原子的相对构型[17],化合物1的氢谱全谱、碳谱以及绝对构型为本研究首次报道。
化合物1的X-射线单晶衍射数据:在正己烷-二氯甲烷(10∶1)中获得晶体,从中选取一外形大小为0.4 mm×0.14 mm×0.1 mm的单晶用于X-射线衍射实验,在XtaLAB AFC12 (RINC): Kappa single衍射仪上采用Cu Kα射线(=0.154 184 nm) 在3.709°≤≤73.510°进行扫描,在100.00 (10) K下共收集到15 615个反射点,其中3006个为独立可观察反射[I≥2(I)],(int)=0.024 1,(sigma)=0.014 7。化合物1属正交晶系,空间群为P212121,晶胞参数:=0.651 852 (4) nm,=0.971 526 (5) nm,=2.384 303 (13) nm, α=90°, β=90°, γ=90°,=1.509 957 (14) nm3;=4,calcd=1.339 g/cm3,(Cu K)=0.811 mm−1,(000)=648.0。晶体结构采用Olex2[18]软件,SHELXT程序包[19-20]解析,用最小二乘法对结构参数进行校正,最终的偏离因子为f=0.026 3,=0.068 2,其最大与最小的电子密度峰的高度分别为190、−150 e nm−3,flack参数为0.02 (4),Hooft参数为0.03 (3) 。

图3 化合物1和2的关键NOESY相关
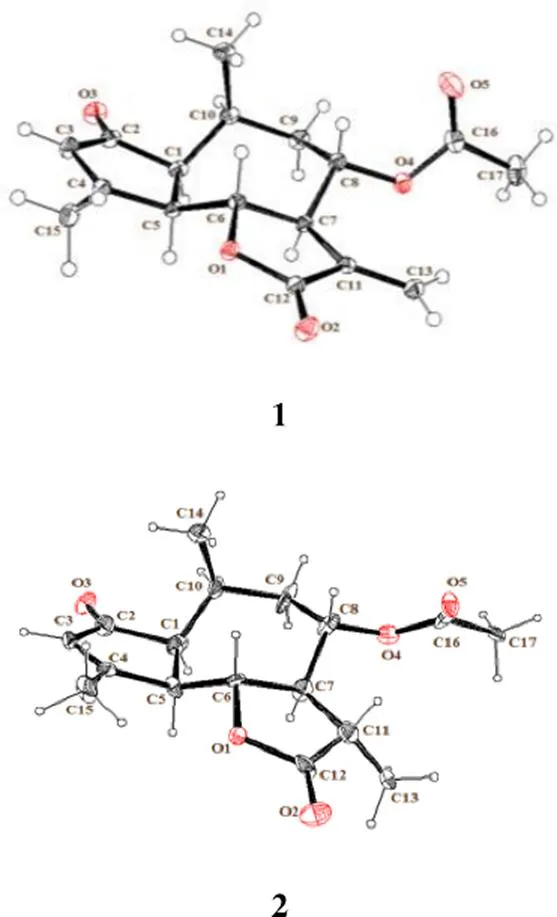
图4 化合物1和2的晶体结构
化合物2:白色针状晶体(正己烷-二氯甲烷),易溶于氯仿,mp 217~219 ℃。[α]20 D+320.67 (0.10, CHCl3);(nm): 239 (2.72), 301 (1.97)。(cm−1): 2937, 1775, 1736, 1699, 1618, 1245, 1028, 1006, 962;HR-ESI-MS显示分子式为C17H22O5(计算值C17H22NaO5[M+Na]+329.135 94,测量值为329.135 77),不饱和度为7。通过对比发现,化合物2和1结构类似,后者仅比前者少了2个氢原子,不饱和度减少了1;化合物2比1多了1个甲基氢[H1.35 (d,= 7.2 Hz, 3H)] 和1个次甲基氢[H2.13~2.18 (1H, m)] 信号,少了2个烯氢信号[H6.35 (d,= 3.4 Hz, 1H), 5.84 (d,= 3.4 Hz, 1H)],这2个烯氢二重峰信号是α-亚甲基--倍半萜内酯环外亚甲基氢的特征吸收峰[11];另外,化合物2比化合物1多了1个甲基碳(C16.0) 和1个次甲基碳(C54.7) 信号,少了2个烯碳(C124.9, 135.4) 信号,其中1个烯碳(C135.4) 为季碳信号。通过以上分析,推断化合物2为化合物1的11、13位碳氢化的代谢产物,HMBC谱中(图2)显示H3-13同C-7/C-11/C-12相关可以进一步证实这个推断。这样,化合物2的平面结构确定为8-乙酰氧基-愈创木-3-烯-2-酮-12,6-内酯。化合物2的相对构型可以通过NOESY谱(图3)进行确认。天然愈创木内酯类化合物中,H-7为α构型[10,13-14],在NOESY谱中,H-7和H3-13有相关信号,H-11和H-8,H-8和H-6、H3-14有相关信号,因此H-11、H-8、H-6和H3-14在同一侧,均为β构型;H-10和H-1,H-1和H-5有相关信号,因此H-10、H-1和H-5在同一侧,均为α-构型。因此,化合物2确认为8α-乙酰氧基-愈创木-3-烯-1α,5α,6β,7α,8β,10α,11β氢-2-酮- 12,6α-内酯。化合物2的绝对构型是通过X-ray单晶衍射(图4)来确定的,最终,化合物2鉴定为(1,5,6,7,8,10,11)-8-乙酰氧基-愈创木-3-烯- 2-酮-12,6-内酯,经Scifinder检索,为1个新的愈创木型倍半萜内酯类化合物,命名为毛华菊内酯A。NMR数据见表1。
化合物2的X射线单晶衍射数据:在正己烷-二氯甲烷(10∶1)中获得晶体,从中选取一外形大小为0.4 mm×0.18 mm×0.14 mm的单晶用于X-射线衍射实验,在XtaLAB AFC12 (RINC): Kappa single衍射仪上采用Cu K射线(=0.154 184 nm) 在6.51°≤2≤147.98°进行扫描,在100.00 (10) K下共收集到57 937个反射点,其中9411个为独立可观察反射[I≥2(I)],(int)=0.045 3,(sigma)=0.020 8。化合物1属单斜晶系,空间群为P21,晶胞参数:=1.364 468 (7) nm,=0.711 407 (4) nm,=2.471 512 (13) nm, α=90°, β=95.708 4 (5)°, γ=90°,=2.387 18 (2) nm3;=2,calcd=1.279 g/cm3,(Cu K)=0.770 mm−1,(000)=984.0。晶体结构采用Olex2[18]软件,SHELXT程序包[19-20]解析,用最小二乘法对结构参数进行校正,最终的偏离因子为f=0.034 4,=0.079 8,其最大与最小的电子密度峰的高度分别为200,−150 e nm−3,flack参数为−0.01 (6),Hooft参数为0.03 (3)。
化合物3:白色粉末,1H-NMR (600 MHz, CDCl3): 6.20 (2H, dd,= 19.2, 5.4 Hz, H-6, 7), 4.61 (1H, brs, H-8), 4.12 (1H, ddd,= 11.9, 11.9, 2.9 Hz, H-1a), 3.84 (1H, dd,= 11.4, 4.2 Hz, H-1b), 2.01 (3H, s, H-14), 1.79~1.82 (2H, m, H-4), 1.65~1.73 (4H, m, H-2, 3);13C-NMR (150 MHz, CDCl3): 64.3 (C-1), 24.4 (C-2), 19.1 (C-3), 32.5 (C-4), 112.9 (C-5), 137.9 (C-6), 126.7 (C-7), 78.6 (C-8), 168.0 (C-9), 80.5 (C-10), 65.1 (C-11), 78.7 (C-12), 70.8 (C-13), 4.8 (C-14)。以上数据与文献报道一致[21],故鉴定化合物3为2α-(2′,4′-hexadiynoyl)-1,6-dioxaspiro [4,5]- deca-3-ene。
4 生物活性测试
采用MTT法[22-23]测试化合物1和2对HepG2细胞增殖的影响,并以顺铂作为阳性对照。结果显示,化合物1对HepG2细胞增殖具有显著的抑制作用,IC50值为(5.95±0.19)μmol/L,阳性对照顺铂IC50值为(6.31±0.33)μmol/L;化合物2对抑制HepG2细胞的增殖没有明显作用。
5 讨论
本研究采用多种色谱分离技术及天然产物结构鉴定方法,从毛华菊中分离得到3个愈创木烷型倍半萜内酯,化合物2为新化合物,命名为毛华菊内酯A;化合物1对于HepG2细胞株具有较强的体外抑制作用。关于12,6-愈创木内酯衍生物对于肝癌细胞株的细胞毒活性鲜有文献报道[24],本实验结果丰富了12,6-愈创木内酯衍生物的活性研究,并且为进一步开发利用毛华菊提供了基础理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志 (第五十二卷第二分册) [M]. 北京: 科学出版社, 1983: 30.
[2] 訾兴中, 张定成. 大别山植物志 [M]. 北京: 中国林业出版社, 2006: 1110.
[3] 戴思兰, 王文奎, 黄家平. 菊属系统学及菊花起源的研究进展 [J]. 北京林业大学学报, 2002, 24(S1): 234-238.
[4] 中国药典 [S]. 一部. 2020: 323.
[5] 周衡朴, 任敏霞, 管家齐, 等. 菊花化学成分、药理作用的研究进展及质量标志物预测分析 [J]. 中草药, 2019, 50(19): 4785-4795.
[6] 黄桂荣, 杜晓英, 徐大高, 等. 三峡地区20种植物甲醇提取物的抗真菌活性 [J]. 华南农业大学学报, 2007, 28(3): 37-41.
[7] Liu Q J, Liu H F, Yuan Z L,. Evaluation of antioxidant activity of chrysanthemum extracts and tea beverages by gold nanoparticles-based assay [J]., 2012, 92: 348-352.
[8] 刘文琪, 佘嘉祎, 杨英, 等. 毛华菊中倍半萜内酯类化学成分研究 [J]. 有机化学, 2021, 41(7): 2898-2904.
[9] 刘文琪, 刘雨琪, 江婉秋, 等. 毛华菊氯仿部位的化学成分及抗肿瘤活性研究 [J]. 化学研究与应用, 2021, 33(10): 2003-2007.
[10] Hou C C, Lin S J, Cheng J T,. Antidiabetic dimeric guianolides and a lignan glycoside from[J]., 2003, 66(5): 625-629.
[11] Adegawa S, Miyase T, Ueno A,. Sesquiterpene glycosides fromNakai [J]., 1985, 33(11): 4906-4911.
[12] Tan R X, Jakupovic J, Bohlmann F,. Sesquiterpene lactones and other constituents from[J]., 1991, 30(2): 583-587.
[13] Hao X C, Zhang J W, Zhan G Q,. Chemical constituents from[J]., 2013, 51: 78-82.
[14] Nishimura K, Miyase T, Ueno A,. Sesquiterpene lactones from[J]., 1986, 25(10): 2375-2379.
[15] El-Bassuony A A, Kabbash A M. Montanone, a new sesquiterpene from[J]., 2006, 14(2): 126-128.
[16] El-Bassuony A A. Montanone, a new sesquiterpene from[J]., 2005, 33(3): 109-114.
[17] El-Seedi H R. Sesquiterpenes and triterpenes from(Asteraceae) [J], 2003, 16: 14-18.
[18] Dolomanov O V, Bourhis L J, Gildea R J,. OLEX2: a complete structure solution, refinement and analysis program [J]., 2009, 42(2): 339-341.
[19] Sheldrick G M. SHELXT - integrated space-group and crystal-structure determination [J]., 2015, 71(Pt 1): 3-8.
[20] Sheldrick G M. Crystal structure refinement with shelxl [J]., 2015, 71(Pt 1): 3-8.
[21] 夏少立, 曹悦, 李庆林, 等. 新疆一枝蒿的化学成分研究 [J]. 中草药, 2020, 51(13): 3393-3398.
[22] 梁旭, 杨新洲, 吴超群, 等. 紫茎泽兰中一个新的杜松烷型倍半萜 [J]. 药学学报, 2020, 55(12): 2955-2959.
[23] 张洪权, 杨英, 佘嘉祎, 等. 两种香青属植物挥发油的化学成分及抗肿瘤活性 [J]. 天然产物研究与开发, 2019, 31(12): 2087-2092.
[24] Ma G H, Chen K X, Zhang L Q,. Advance in biological activities of natural guaiane-type sesquiterpenes [J], 2019, 28(9): 1339-1358.
One new guaianolide from
ZHANG Hong-quan1, 2, 3, WANG Yan-li1, DONG Xin-yu1, XIANG Tao1, ZHOU Qiao-qiao1, 2, ZHU Shi-ming1, 2, XIONG Xiao-qin1, 2, 3, ZHANG Lei1, 2, ZHENG Ping1, 2,LIU Jie4
1. Department of Chemistry and Life Science, Hubei University of Education, Wuhan 430205, China 2. Hubei Key Laboratory of Purification and Application of Plant Anti-cancer Active Ingredients, Wuhan 430205, China 3. Research Center for Development and Utilization of Medicinal Plants in Eastern Hubei Province, Wuhan 430205, China 4. Wuhan HengHeDa Bio-Pharmaceutical Co., Led., Wuhan 430056, China
To investigate the chemical constituents fromand their anti-tumor activities.The chemical constituents fromwere isolated and purified by solvent extraction, Diaion HP-20, Sephadex LH-20, Silica gel and preparative high performance liquid chromatography. Their structures were elucidated based on their spectroscopic data. The antitumor activities of the isolated compounds were evaluated by using MTT assay.Three compounds were isolated from chloroform extract ofand identified as (1,5,6,7,8,10)-2--8- acetoxy-guaia-3,11(13)-dien-12,6-olide (1), (1,5,6,7,8,10,11)-2--8-acetoxy-guaia-3-en-12,6-olide (2) and 2α-(2′,4′- hexadiynoyl)-1,6-dioxaspiro [4,5]-deca-3-ene (3).Compound 2 is a new guaianolide named as vestitlactone A which had no significant inhibitory effect on the HepG2 cell proliferation; compound 1 exhibited inhibitory activity against HepG2 cell line with IC50value of (5.95 ± 0.19) μmol/Land compound 3 was isolated from this plant for the first time.
(Hemsley)Stapf; guaianolide; cytotoxic activity; (1,5,6,7,8,10)-2--8-acetoxy-guaia- 3,11(13)-dien-12,6-olide;vestitlactone A
R284.1
A
0253 - 2670(2022)15 - 4611 - 06
10.7501/j.issn.0253-2670.2022.15.003
2021-12-17
国家自然科学基金项目(81903115);湖北省教育厅科学技术研究项目(B2017202,B2019183);湖北省大学生创新创业训练计划项目(S202114099008);湖北第二师范学院横向科研项目(ESHX20210195);湖北第二师范学院教学研究项目(X2021003)
张洪权,男,硕士,副教授,从事中药活性成分研究。E-mail: orgzhq@163.com
通信作者:郑 平,男,教授,从事中药活性成分研究。E-mail: 727710500@qq.com
[责任编辑 王文倩]
