壳聚糖微花对原花青素的负载表征及缓释性能
2022-08-02焦思宇姚先超史永桂林春燕唐潘露林日辉
焦思宇,姚先超,史永桂,林春燕,唐潘露,林日辉*
(广西民族大学化学化工学院,广西多糖材料与改性重点实验室,林产化学与工程国家民委重点实验室,广西林产化学与工程重点实验室,广西 南宁 530006)
原花青素(procyanidins,PC)又称为缩合单宁,是一类由不同数量的儿茶素或表儿茶素通过CüC键缩合而形成的聚合物,广泛存在于自然界许多植物当中。具有较强的抗氧化活性、抗癌性、抗菌或病毒,以及心脏保护作用。因此被广泛应用在药品、食品、化妆品等领域。PC最早由Joslyn等在1967年发现,他们从葡萄皮和葡萄籽提取物中分离出4 种多酚类化合物,它们在酸性加热条件下可产生红色的花青素,这类多酚类化合物统称为前花青素或原花青素。迄今为止对PC的研究已有50多年的历史,近几年PC已成为癌症和炎症管理的治疗剂。据报道,PC还可以保护细胞免受氧化损伤。方健等研究秀丽莓PC对糖尿病小鼠胰腺组织的保护作用,研究结果表明秀丽莓PC通过激活PI3K/AKT/Nrf2信号通路,减轻糖尿病小鼠的胰岛细胞氧化应激损伤,从而使糖尿病小鼠损伤的胰腺组织得到改善。Zhang Zhifeng等向经过HO处理的成骨细胞MC3T3-E1中加入原花青素,并以不加原花青素作为对照组,探讨PC是否通过其抗氧化活性在成骨细胞MC3T3-E1中发挥抗凋亡作用,其结果表明PC通过改善线粒体功能和抑制p53信号的激活,保护MC3T3-E1成骨细胞免受HO诱导的线粒体功能障碍和凋亡。然而PC极易被氧化、生物利用率低、半衰期短,此外,PC在碱性和中性条件下不稳定,而在人类胃转运过程中稳定,这些限制了其在给药领域的应用。Jiang Suwei等通过制备壳聚糖改性多孔淀粉负载PC,其负载量为53 mg/g左右,并证明了壳聚糖改性多孔淀粉对PC的吸附是化学吸附或者强表面络合作用而不是传质,但没有考虑负载后PC的抗氧化性。Chen Rencai等通过离子交联法以海藻酸钠、氯化钙和壳聚糖为原料制备了包油漂珠,并成功对PC进行包埋,包封率为88.84%,且包埋后的PC在模拟胃液缓释时间超过12 h,从而延长原花青素的胃滞留给药时间。因此开发新的材料负载PC,在提高其负载量的同时又能提高其稳定性成为了研究的热点。
壳聚糖(chitosan,CS)具有良好的可降解性、抗菌性、生物相容性等特性故被广泛研究与应用在医药、食品、抗菌剂等方面。基于其优良的性能、来源广泛和成本低廉等特点,已成为一种优良的药物载体。将CS进行微米化、纳米化改性,从而提高其负载各种药物的能力。Luo Chao等采用离子交联法制备出壳聚糖/磷酸钙花状微粒,以槲皮素为模型药物进行包埋,包封率为80%,并在pH 5.8和pH 7.4条件下进行体外缓释实验,其结果表明这种壳聚糖负载基材不仅具有缓释作用,还具有pH值敏感释药特性,其累计释药时间可达24 h以上,并证明药物释放机制均符合Korsmeyer-Peppas模型。此外刘向阳等采用离子交联法制备了多肽壳聚糖川芎嗪纳米粒,通过纳米多肽对壳聚糖进行修饰,从而实现对肿瘤细胞的靶向治疗,为CS供药载体的靶向治疗提供依据。因此,CS作为药物载体方面被广泛研究。
为了提高PC的稳定性,并基于CS的良好生物特性以及来源广泛等特点,本研究采用离子交联法制备具有较大比表面积的壳聚糖微花(chitosan microflowers,CSMF),以PC作为模型药物,从而对其进行高效负载。研究原花青素壳聚糖微花(procyanidins chitosan microflowers,PC-CSMF)的负载效果、缓释性能和药物保护作用,为CS用于负载多酚类药物提供了理论依据。
1 材料与方法
1.1 材料与试剂
CS(脱乙酰度≥95%)、三聚磷酸钠(sodium tripolyphosphate,TPP,分析纯) 上海麦克林生化有限公司;PC(生物试剂)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH,生物试剂)上海源叶生物科技有限公司;冰醋酸(分析纯) 上海阿拉丁生化技术有限公司;过氧化氢(分析纯) 天津致远化学试剂有限公司;无水乙醇(分析纯) 成都市科隆化学品有限公司;胰蛋白酶(生物试剂) 北京索莱宝科技有限公司。
1.2 仪器与设备
JY92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;FD-A10N-50冷冻干燥机 上海皓庄仪器有限公司;TG1650-WS型台式高速离心机 上海卢湘仪离心机仪器有限公司;MQL-61R立式振荡培养箱 上海旻泉仪器有限公司;SUPRA 55 Sapphire型场发射扫描电子显微镜 德国卡尔蔡司公司;MiniFlex600 X射线衍射仪日本理学公司;K-Alpha X射线光电子能谱 赛默飞世尔科技公司;TGA55热重分析仪 美国TA仪器。
1.3 方法
1.3.1 CSMF的制备
采用改进离子交联法制备CSMF。用HO和超声对CS冰醋酸溶液进行预处理。并在超声条件下加入TPP溶液,从而得到CSMF悬浊液,将悬浊液离心冻干后得到样品。
1.3.2 PC标准曲线的绘制
参考李书艺等的方法,将PC溶于水中,并稀释为不同的质量浓度梯度PC溶液,用紫外分光光度计测量波长280 nm处吸光度。以PC质量浓度为横坐标(mg/mL),吸光度为纵坐标。得到PC的标准曲线为=11.94+0.003 67,=0.999 8。
1.3.3 PC-CSMF的制备及负载量的测定
参照史永桂等的负载方法,取0.05 g CSMF为吸附剂放入10 mL的离心管中,并向管中加入5 mL的PC溶液,将离心管用锡纸包裹放在血液混匀器进行吸附,并以不加CSMF的同质量浓度PC溶液作为对照。
将负载后的PC-CSMF于6 500 r/min离心5 min,并取50 μL上清液于10 mL的棕色比色管中,并用去离子水将其稀释200 倍。摇匀后在紫外分光光度计下测量吸光度,PC吸附量按式(1)计算:

式中:为吸附载药量/(mg/g);为PC溶液质量浓度/(mg/mL);为吸附后的PC溶液质量浓度/(mg/mL);为PC溶液体积/mL;为CSMF吸附剂用量/g。
1.3.4 样品表征
场发射扫描电子显微镜表征:取一定量干燥的CSMF和PC-CSMF通过导电胶均匀地分散到样品台上,轻轻吹去多余的浮样,置于真空镀膜仪下喷镀钯金,制成电镜观察样品,在扫描电镜下拍摄具有代表性的不同放大倍数下的淀粉颗粒性形貌,加速电压为10 kV。
傅里叶变换红外光谱仪分析:采用KBr压片法,取1~2 mg样品与干燥的KBr粉末混合并压制成薄膜层,然后通过傅里叶变换红外光谱仪进行测量。样本扫描波长范围为4 000~400 cm,平均32 次扫描,分辨率为4 cm。
X射线衍射仪分析:使用日本理学公司MiniFlex600型X射线衍射仪对样品进行X射线衍射仪分析,Cu(Kα)射线,Ni片滤波,电压40 kV,电流15 mA,扫描范围2为4 °~60 °,扫描速率为2 °/min,扫描步长为0.02 °。
热重分析仪分析:使用热分析仪通过热重分析研究了粉末样品的热稳定性,即在氮气气氛下,将大约10 mg样品以20 ℃/min的升温速率从35 ℃加热到800 ℃。
X射线光电子能谱分析:X射线光电子能谱数据是使用工作在6 mA和12 kV的消色差Al Kα X射线源获得的。使用平均10 次扫描收集全元素光谱,通过能量为100 eV,扫描范围为1 400~0 eV。使用平均5 次扫描收集单元素光谱,通过能量50 eV,步长为0.05 eV。
1.3.5 吸附条件对CSMF吸附剂吸附性能的影响
取0.5 g的CSMF作为吸附剂加入到5 mL一定质量浓度PC溶液中,在立式振荡培养箱以150 r/min进行振荡吸附,吸附完成后离心取上清液,测定上清液中PC的质量浓度,并以负载量作为评价指标,分别改变吸附溶液体系PC的初始质量浓度(吸附剂用量0.5 g,吸附温度27 ℃,吸附时间5 min)、吸附温度(吸附剂用量0.5 g,PC初始质量浓度分别为2、4、6、8 mg/mL,吸附时间5 min),考察各因素对CSMF吸附性能的影响。
1.3.6 体外模拟缓释
参考杨慧等体外模拟缓释实验方法,取0.1 g的PC-CSMF(载药量为343.83 mg/g)溶于50 mL pH 7.4的磷酸盐缓冲溶液(phosphate buffer saline,PBS)中(含有胰蛋白酶),于转速100 r/min、温度37 ℃悬浮释放。并分别在1、2、3、4、6、8、10、12 h和24 h取1 mL的缓释溶液(同时补充同温等量缓释溶液)。根据式(2)计算累计释药百分率():

式中:C为第次置换时释放液中的PC的质量浓度/(mg/mL);为PC-CSMF的载药量/(mg/g);为PC-CSMF的质量/g;为置换介质的次数;为释放介质置换体积/mL;为起始释放液体积/mL。
1.3.7 抗氧化性能分析
参考韦献雅等的DPPH自由基清除率测定方法。配制质量浓度为50 μg/mL的DPPH溶液,避光贮藏。称取10 mg的PC-CSMF(载药量为254.96 mg/g)加入到10 mL的DPPH溶液中,在血液混匀器上避光混合,并分别在10、20、40、60 min和120 min离心取上清液于紫外分光光的度计波长515 nm处测得吸光度。根据式(3)计算DPPH自由基清除率:

式中:为未加载药颗粒DPPH自由基吸光度;为加入载药颗粒反应后DPPH自由基吸光度;为载药颗粒加无水乙醇在波长515 nm处的吸光度。
1.4 数据处理
所有实验均进行3 次重复,采用Excel 2010进行实验数据统计,采用Origin Pro 9.0软件对实验参数和结果进行拟合分析及作图。
2 结果与分析
2.1 样品表征
2.1.1 扫描电镜分析
由图1a可知,经过离子交联法制得CSMF形貌为三维的微花结构,花状微粒直径为1~1.5 μm,由厚度约为30 nm的片状花瓣组成的。微粒表面的片层结构极大增加了微粒的比表面积,比表面积测试结果为48.9 m/g,极大提高了微粒的吸附性能,且层与层之间有一定的间隙,使更多的结合位点裸露出来,进而使吸附质更加容易结合在微粒表面,提高了微粒的吸附量。由图1b可知,CSMF经过吸附负载PC后,其大致形貌基本不变,但是负载后CSMF的粒径比负载前的略微增大,其原因可能为CSMF在水中吸附亲水性物质PC时,导致更多水分子进入CSMF中,进而使其产生溶胀,造成其粒径增大。其次,吸附PC后的CSMF形貌由之前的扁平状变为椭圆形或球形,且层与层之间的间距变小,这是PC被吸附CSMF瓣层之间所导致的结果。

图1 CSMF(a)和PC-CSMF(b)电镜图Fig.1 SEM images of CSMF (a) and PC-CSMF (b)
2.1.2 傅里叶变换红外光谱分析
为验证PC是否被负载成功,对CSMF、PC和PCCSMF进行傅里叶变换红外光谱表征,结果如图2所示:CSMF在1 639、1 541 cm和1 382 cm有明显的吸收峰,分别归因于为酰胺I的伸缩振动(C=O),酰胺II的弯曲振动(NüH)和酰胺Ⅲ的伸缩振动(CüN),1 077 cm和893 cm处的吸收峰归因于CüOüC的伸缩振动峰和-1,4-糖苷键(OüCüO)的振动峰。PC在1 612、1 522 cm和1 444 cm处有明显吸收峰,这些都归因于芳香环的振动峰,表示有苯环结构。在CSMF对PC进行吸附后,PC-CSMF在1 620、1 526 cm和1 393 cm处还存在酰胺的振动峰,而1 448 cm处的峰是苯环振动峰,表明PC成功被负载到CSMF上。

图2 CSMF、PC和PC-CSMF傅里叶变换红外光谱Fig.2 FTIR spectra of CSMF, PC and PC-CSMF
由图2可知,吸附后多一个1 448 cm峰,其为苯环振动峰,表示PC被成功负载。而吸附后酰胺峰的强度和位置都发生了改变,其原因可能为PC的芳香环振动峰和酰胺的振动峰相互协同作用下导致其强度和位置发生了改变。进而推测PC的负载并不会改变CSMF的结构,可以认为CSMF对PC的吸附为物理吸附。
2.1.3 X射线衍射分析
由图3可知,CSMF在11.9 °和18.6 °附近有明显的衍射峰,其原因为CS和TPP之间发生了电荷作用,证明CSMF的生成,这些结晶峰体现了CSMF的多结晶结构,也可以称之为“肌键”水合多晶体,其形成的原因为CSMF强分子间氢键导致其CS链紧密排列所致;由图3可知,两者没有显著差异,PC-CSMF衍射峰的位置也都在11.9 °和18.6 °附近,推测出现这种现象原因是PC均匀分布在CSMF层与层之间,未和CSMF形成化学键,通过分子之间作用力附着在CSMF表面,从而不会影响CSMF分子中糖链的排列,进而不会对的结果产生影响。
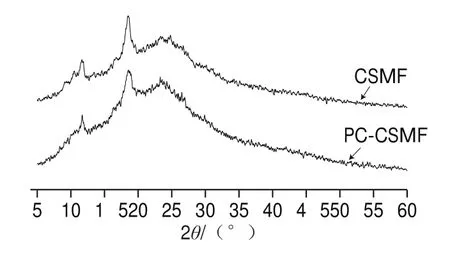
图3 CSMF和PC-CSMF X射线衍射分析Fig.3 XRD patterns of CSMF and PC-CSMF
2.1.4 热重分析
由图4a、b可知,CSMF有2 个质量损失阶段,第1阶段为温度低于155 ℃时,此阶段质量损失约12%,其原因是CSMF表面的自由水和结合水的溢出,这一阶段的最大失重速率在97 ℃附近;第2阶段发生在175~320 ℃,此阶段质量损失约30%,其原因为CS糖苷键的断裂。对比分析图4c、d,PC-CSMF的质量损失也分为2 个阶段,第1阶段也发生在温度低于158 ℃时,此阶段质量损失大约10%,最大质量损失速率在99 ℃附近,第2阶段发生在175~350 ℃,此阶段质量损失约27%,最大质量损失速率在251 ℃附近,这2 阶段的质量损失原因和CSMF相同,造成其最大质量损失速率有细微差别的原因可能为CSMF在吸附PC的时候,两者发生了分子间作用力,所以导致PCCSMF的最大质量损失速率的温度略大于CSMF。

图4 热重分析图Fig.4 TG curves of CSMF and PC-CSMF
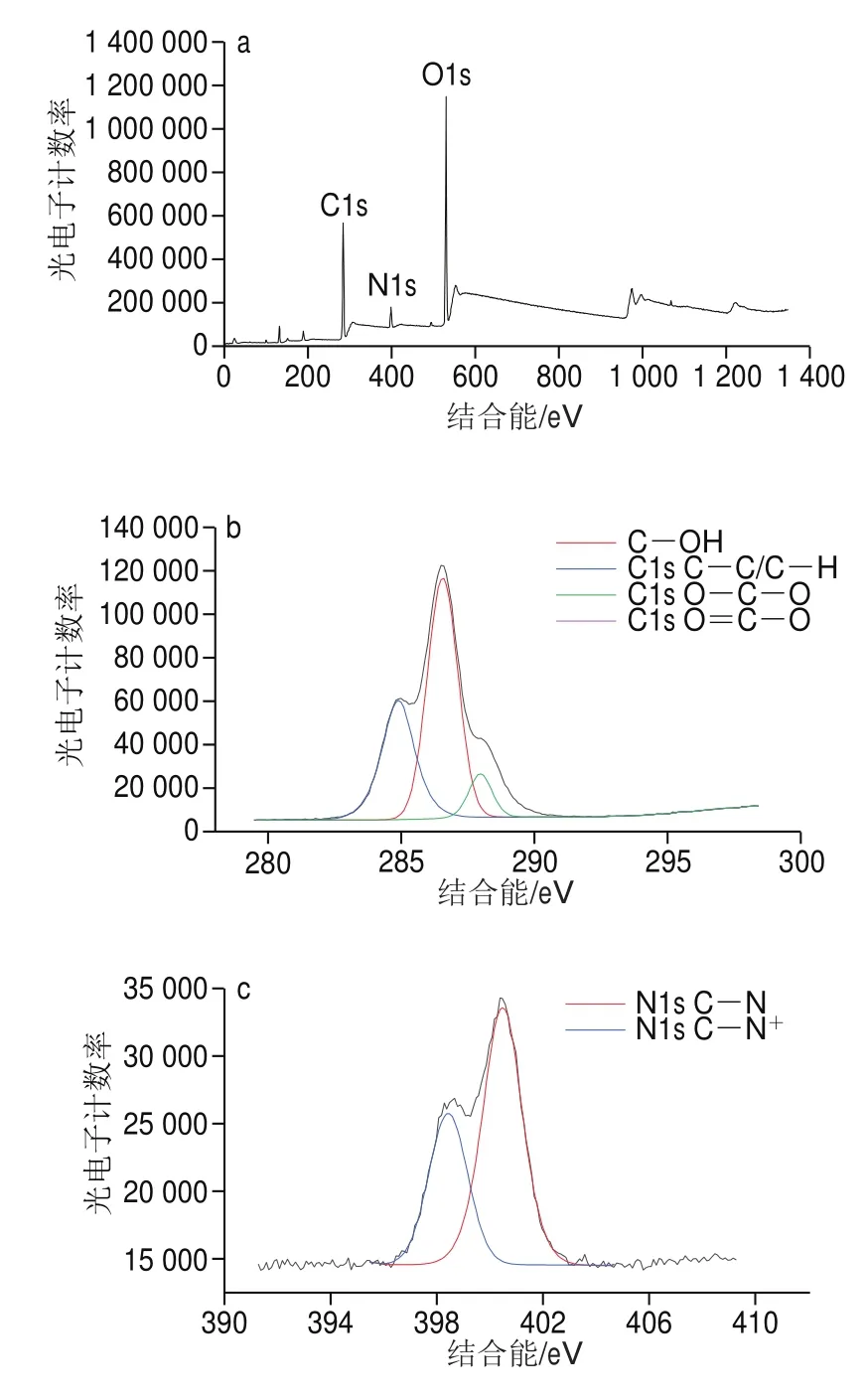
2.1.5 X射线光电子能谱分析
为考察CSMF对PC的吸附是否有为物理吸附,以及吸附前后的C、N和O元素的分布情况,对CSMF和PC-CSMF进行X射线光电子光谱分析,其结果如图5所示。对比图5a、e可知,吸附后的CSMF表面C原子含量从吸附前的53.2%提升到了67.66%;而N原子和O原子含量分别从吸附前的6.46%和40.34%下降到了2.52%和29.32%,并且PC-CSMF表面碳氧比例为67.6∶29.8,较CSMF的表面碳氧比例53.2∶40.3有所提高。这是因为PC含有大量的C原子和O原子,其C∶O=30∶13,当PC被负载到CSMF上时,会大量提升CSMF表面的C原子含量,从而使N原子和O原子含量有所降低。对比图5b、f,吸附前CSMF的C1s光谱在结合能为284.88、286.54、287.97 eV和288.41 eV处分为4 个峰,每个峰分别归因于CüC/CüH、CüOH、OüCüO和O=CüO键;吸附后C1s光谱在结合能为284.81、286.52 eV和288.49 eV处分为3 个峰,每个峰分别归因于CüC/CüH、CüOH和O=CüO键,对比发现吸附后的OüCüO键信号消失,而在傅里叶红外光谱中却有糖苷键(OüCüO)的峰,其原因可能为被吸附后的CüOH键信号所屏蔽,而吸附前后的O=CüO键可能是因为在制备CSMF是CS与HAc发生反应导致的。由图5c、g可知,吸附前CSMF的N1s光谱在398.43 eV处为CüN键峰,在400.47 eV处为CüN键峰,吸附后PC-CSMF的N1s光谱在398.37 eV处为CüN键峰,在400.40 eV处为CüN键峰;由图5d、h可知,吸附前CSMF的O1s光谱在531.86 eV处为OüH键峰,在533.56 eV处为O=CüO键峰,吸附后PC-CSMF的O1s光谱在532.17 eV处为OüH键峰,在533.48 eV处为O=CüO键的峰。
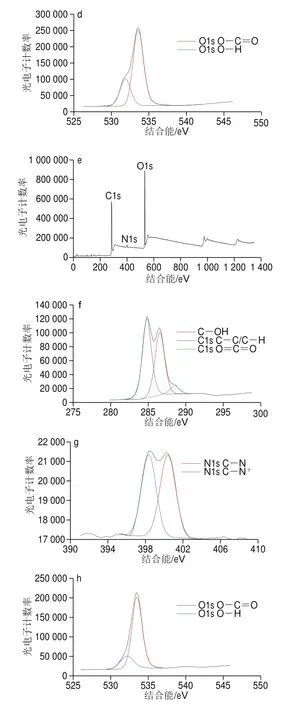
图5 CSMF和PC-CSMF的X射线光电子能谱光谱对比Fig.5 Comparison of XPS spectra of CSMF and PC-CSMF
通过上述对比可知,吸附前后只改变了CSMF的表面元素分布和各种化学键的强度及结合能,并没有新化学键的生成。因此可推测为CSMF是通过分子间作用力对PC进行吸附,即CSMF对PC的吸附过程为物理吸附。
2.2 吸附条件对CSMF吸附剂吸附性能的影响
由表1可知,当增大PC质量浓度,CSMF的载药量也随之增大,这是因为当PC质量浓度增大时,增大了PC与CSMF的有效分子碰撞次数,且更多PC进入CSMF瓣层之间,导致PC和CSMF更容易发生吸附作用,从而造成CSMF吸附载药量的增大,其最大负载量为352.88 mg/g,比Jiang Suwei等的负载量提高了5 倍,较Ji Ying等的负载量提高了4 倍,充分显示了CSMF的优良负载性能。

表1 吸附质量浓度对吸附载药量的影响Table 1 Effect of different PC concentrations on its loading onto CSMF
由图6可知,当PC质量浓度较低时,随着温度的升高,CSMF对PC的吸附载药量也随之增大。其原因为温度的升高有利于分子运动,导致PC与CSMF更容易发生有效碰撞,从而导致载药量的增大,而此时PC质量浓度偏小,CSMF不足以达到吸附饱和,所以升高温度还是有利于吸附反应的进行。当PC质量浓度偏大时,升高温度,载药量也随之增大,然而温度过高,此时温度有利于解吸反应的进行,从而导致了载药量的降低。由此可知温度变化对载药量的影响程度比较小。
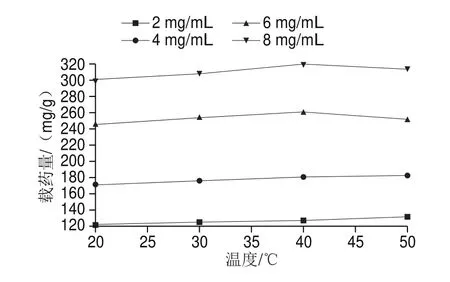
图6 温度对吸附载药量的影响Fig.6 Effect of different temperatures on PC loading onto CSMF
2.3 体外模拟缓释
缓释性能是评价载药颗粒性能指标的一个重要的参数,其保持药物原有活性在缓冲体系中缓慢的释放,从而达到长期有效的功效。
由图7可知,纯PC原药在释放过程中存在突释情况,在1 h内释放了50%,在4 h就达到了最大释放量87.30%。因此纯PC原药不具备缓释效果。而4 h后由于纯PC在pH 7.4条件不稳定容易被降解,所以导致其累计释放率有所下降;而PC-CSMF就具备了缓释效果,在6 h达到50%的释放量比原药延长了5 h左右,此外也提高了PC在PBS中的稳定性,24 h后的累计释放率为90.61%,比原药的最大释放率(87.30%)大,此外PC-CSMF在释放的过程中比较稳定不存在突释的情况,因此,更利于人体的吸收。参考陈文彬等的药物释放机理,PC-CSMF在碱性条件下,CS上的—NH易发生去质子化形成—NH,从而导致CS与TPP之间的交联作用变弱,进而使负载在CSMF上的PC源源不断从载药颗粒中释放出来,从而使溶液中的PC含量增大,但整个过程需要一定的时间,因此使PC-CSMF具有缓释效果。

图7 PC累计释放率曲线Fig.7 Cumulated release curves of PC-loaded CSMF
2.4 抗氧化性能分析
DPPH的乙醇溶液呈紫色,当其遇到供氢体时,DPPH自由基被还原为DPPH-H,紫色会褪去,该测定方法被广泛用于评价各类植物化学物质的自由基清除能力。
由图8可知,PC-CSMF的自由基清除率比未负载的PC低,这是因为PC-CSMF中的PC从CSMF上释放需要一定的时间,这也印证了其有缓释功能。在20 min后纯PC的自由基清除率基本保持不变,因为PC是一类与自由基能够快速发生反应的多酚类自由基消除剂,此时证明PC和DPPH已发生了充分的反应,导致PC已被完全反应完毕,失去了继续抗氧化的作用。而PC-CSMF在120 min内具有持续的抗氧化性,且自由基清除率在不断地上升。因此,PC-CSMF不仅延长了抗氧化作用的时间,还保护了抗氧化剂的活性,从而实现PC的长期抗氧化作用。

图8 PC-CSMF对DPPH自由基清除率的影响Fig.8 DPPH radical scavenging effect of PC and PC-CSMF
3 结 论
以CS为原料,通过离子交联法制备CSMF,并以PC为模型药物对其进行负载,采用扫描电子显微镜、傅里叶变换红外光谱、X射线衍射仪等对其进行了表征,研究不同吸附条件对CSMF吸附性能的影响,通过体外缓释和清除自由基实验探究其缓释作用和抗氧化性。实验结果表明CSMF为三维的微花结构,比表面积为48.9 m/g;PC-CSMF的傅里叶变换红外光谱在1 448 cm出现了芳香环的峰,X射线光电子能谱显示PC-CSMF表面碳氧比例为67.6∶29.8,较CSMF的表面碳氧比例53.2∶40.3有所提高,两者协同证明了PC被成功负载;X射线衍射仪分析和热重分析发现PC-CSMF的结晶性和热稳定性没有显著改变;在27 ℃和PC质量浓度为10 mg/mL时CSMF对PC的最大负载量为352.88 mg/g,较Jiang Suwei和Ji Ying等的负载量提高了4~5 倍;最后,体外缓释和抗氧化性实验证明了PC-CSMF在不仅具有良好的缓释作用,还提高了PC在肠道中的生物利用率,为CSMF负载多酚类药物提供了依据。
