药企质量控制实验室用冷藏设备验证方法研究
2022-08-01穆琰
穆琰
河北省药品职业化检查员总队(河北省疫苗检查中心) 河北石家庄 050090
验证是用于通过定义的测试建立文件化证据的总术语,证明系统或设备符合设计标准,并且已经建立了足够的规定以保持对其进行控制。在器具、仪器和设备的三种类型的设备中,冰箱、冰柜属于设备的定义,在制药企业质量控制实验室中常用于存放标准样品、实验试剂等对温度有特殊要求的材料。按照GMP的原则[1],无论是简单的设备还是组件的集合,设备都需经过验证。冷藏箱的使用必须对其进行验证,确保设备使用、选型、安装以及改造维护等方面符合企业自身需求,满足药品生产质量规范(GMP)要求,最大限度地避免对存放材料的污染等。
本文以质量控制实验室常用冷藏箱为例,介绍了如何验证用于存储制品样品的冷藏冷冻柜[2]。材料在冷藏箱中环境控制在2℃~8℃。以药品生产质量管理规范(GMP)以及药品GMP指南等规定为依据,对质量控制室用冷藏箱进行了验证方案的设计,方案内容主要包括设计确认(Design Qualification,DQ)、安装确认(Installation Qualification,IQ)、运行确认(Operation Qualification,OQ)和性能确认(Performance Qualification,PQ)等方面,方案制订完毕后严格执行方案内容对设备进行了验证。
一、验证方案
(一)仪器与设备
无线温度探头17个已经过校准且在校准有效期内,并有经计量机构颁发的校准证书。
笔记本电脑1台,已安装无线温度探头相关软件,具有审计追踪功能。
(二)拟验证设备
博科BIOBASE立式冷藏箱,型号:BYC-160,储存温度:2℃~8℃。
(三)验证方案
验证方案是设备验证重要文件之一,应根据公司情况不同进行差别化定制,在设备测试开始之前制订的方案应该由质量管理部门批准,应当包括验证目的、范围、参加人员、风险评估、制定依据、时间进度、具体方法与程序等内容。验证方案中,同时应该明确对所使用的验证仪器仪表进行确认,以确认这些设备能够正常使用,且在有效期内。
1.设计确认(DQ)
评估小组人员对拟采购的冷藏箱进行设计审查,以评估设备工艺要求、设备设计参数、选型等符合企业URS(用户需求),能够防止或减少出现污染、交叉污染及差错的可能,且同时易于清洁、维护和保养。
2.安装确认(IQ)
评估确认对冷藏箱进行了正确安装,安装应符合制造商指定的原则与基本要求。此外,配套的电力设施符合电气规范和设备安装要求以及设备正常运行需求。IQ评估需要有关设备标识、所需文件、设备实用程序要求、主要部件规格、结构材料、制冷剂和设备安全特性的信息。
3.运行确认(OQ)
评估确定设备可以在指定的容差和限制内运行。冷藏箱的验证侧重于基本功能情况,包括屏幕显示是否正常、按键灵敏度等。运行确认可评估冷藏箱制冷温度准确性以及获得设备控制功能(按钮、开关和指示器)和一般操作(温度分布)等的信息。
此次验证对冷藏箱空载温度进行了分布测试,冷藏箱设定温度为5℃。具体操作如下:
1.2.3 随访 在患者手术后第1次月经来潮且干净后1~2 d,医师对其采取治疗性通液术处理,在手术后需要避孕至少3个月,3个月后需要前往门诊进行指导受孕,采取电话随访的方式进行随访。
(1)准备工作,确认笔记本计算机上安装了经校验合格的温度记录仪使用程序,且具有审计追踪功能。
(2)程序设置,将温度记录仪与计算机通过无线连接,设定好程序,连续监测24小时,温度记录时间间隔5分钟。
(3)温度探头位置确定,取经过校验合格的温度记录仪17个,其中15个分别放置于冷藏箱3个不同层(上、中、下层),上层与冷藏箱顶面的距离是冷藏箱内部空间高度的1/10,中层即为冷藏箱内部空间的中心,下层在最底层样品架上方10mm处。空载温度监测点见图1。

图1 空载温度监测点
其中1、2、3、4、5号温度记录仪放置在上层位置;6、7、8、9、10号温度记录仪放置在中层位置;11、12、13、14、15号温度记录仪放置在下层位置;16、17号温度记录仪分别放置于冷藏箱自带探头处(位于冷藏箱内壁右下与左上侧)。
记录温度记录仪所监测的数据。可接受标准:所有温度监测点温度均分布在2℃~8℃之间。
4.性能确认(PQ)
性能确认(PQ)包括但不限于满载温度确认、满载开门温度测试、满载断电后温度情况等。温度记录仪与OQ操作时位置相同。
满载温度确认:连续监测24小时,记录冷藏箱温度变化。
满载断电温度测试:模拟断电在不打开冷藏箱门的情况下,1分钟记录一次温度,记录时长1小时。去除温度记录仪连接电脑记录数据。
二、验证结果
(一)设计确认(DQ)
设计确认结果符合规定(表1)。

表1 设计确认结果
(二)安装确认(IQ)
安装确认符合要求,详见表2和表3:
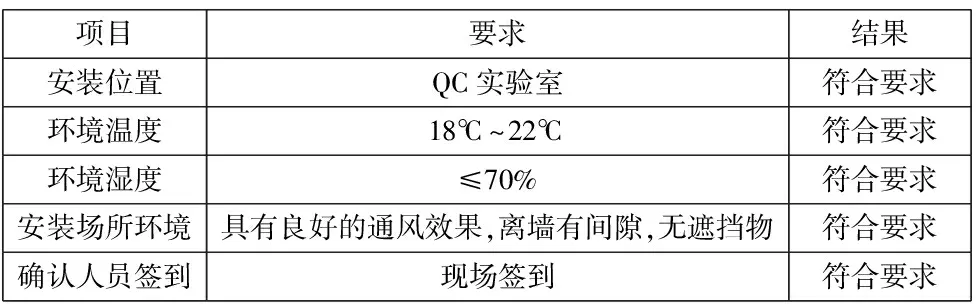
表2 安装环境确认

表3 产品资料确认
(三)运行确认(OQ)
空载测试结果见表4,结果符合要求。
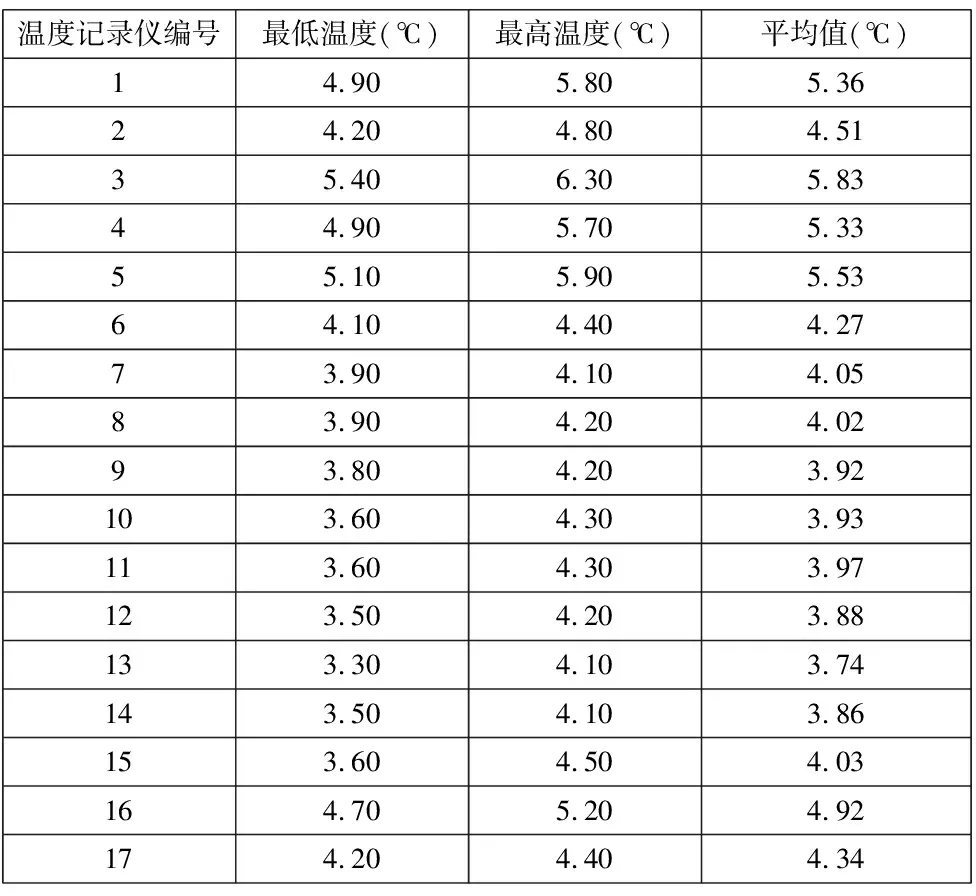
表4 空载测试结果
空载温度分布确认结果显示温度分布均匀,各监测点均在接受范围内,温度波动较小。冷点位于分布点13号点位,热点位于布点图3号点位。
(四)性能确认(PQ)
满载测试结果见表5:

表5 满载温度分布确认
满载温度分布确认结果显示温度分布均匀,各监测点均在接受范围内,温度波动较小。冷点位于分布点13号点位,热点位于布点图3号点位,与空载测试基本保持一致。
开门测试温度记录见表6:

表6 开门测试温度记录表
验证结果显示,在将冰箱门打开后,17个监测点的温度开始升高,在开门3分钟时,监测点1、2、3、5、16温度到达8℃,验证结论为单次开门时间不超过3分钟。
满载断电温度测试结果见表7:
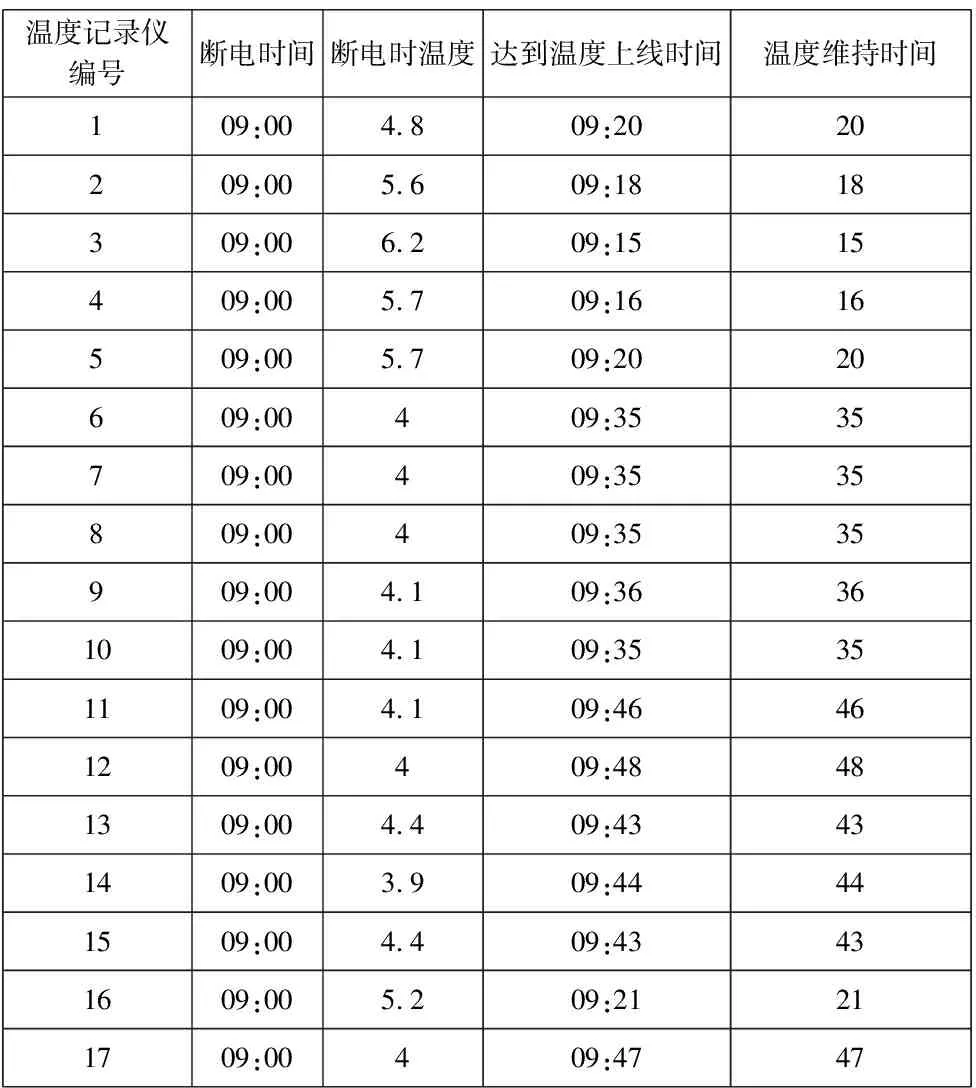
表7 满载断电温度确认
结果显示,所有分布点位,在断电保温时间15分钟以内,可满足冷藏温度要求。
三、结果与讨论
(1)此次验证对冷藏箱进行了设计、安装、运行、性能确认。设计、安装、运行确认均能满足用户使用需求,符合预期。性能确认对满载状态下进行了温度分布、开门时间以及断电保温时间进行了确认,结果显示满载状态下温度分布均匀,各监测点均在可接受范围内,温度波动较小。开门时间确定为不超过3分钟,断电保温时间控制在15分钟。
(2)验证过程可根据企业自身需求或冷藏箱特点,增加或减少温度传感器配置,同时,也可根据企业情况合理确定验证的项目与指标。
(3)确认与验证是制药企业所用设备必须具有的基本要求,也是GMP符合性检查中重点关注的内容,企业应当根据自身实际情况,确定不同设备的验证周期,定期对设备进行确认或再验证,保证始终处于合格状态。
