金属与盐溶液反应后成分判断类题目解法分析
2022-08-01王瑞
王 瑞
(江苏省连云港市灌云县云湖初级中学 222200)
1 例题解析
例1将一定量的铁粉投入到硫酸铜溶液中,经过充分反应后过滤,滤液为蓝色.则分析所得滤渣和滤液的情况.
解析依据“三步法”:
步骤1审题,根据题目已知条件,此为“一金斗一盐”的情况:“一金”是指铁粉;“一盐”是指硫酸铜.故可能会发生以下1种反应:

(1)
此时只发生一种反应,故不需要判断谁先发生的情况.
步骤2分析,依据“一金”铁粉量的多少来判断反应后的情况,如图1所示,具体分为以下几种情况:
情况1:Fe极少,(1)式发生,全部Fe参与(1)式反应,剩余部分CuSO4;此时反应后的滤渣中一定有Cu,滤液中一定有FeSO4(反应生成物)、CuSO4(反应后剩余的量).
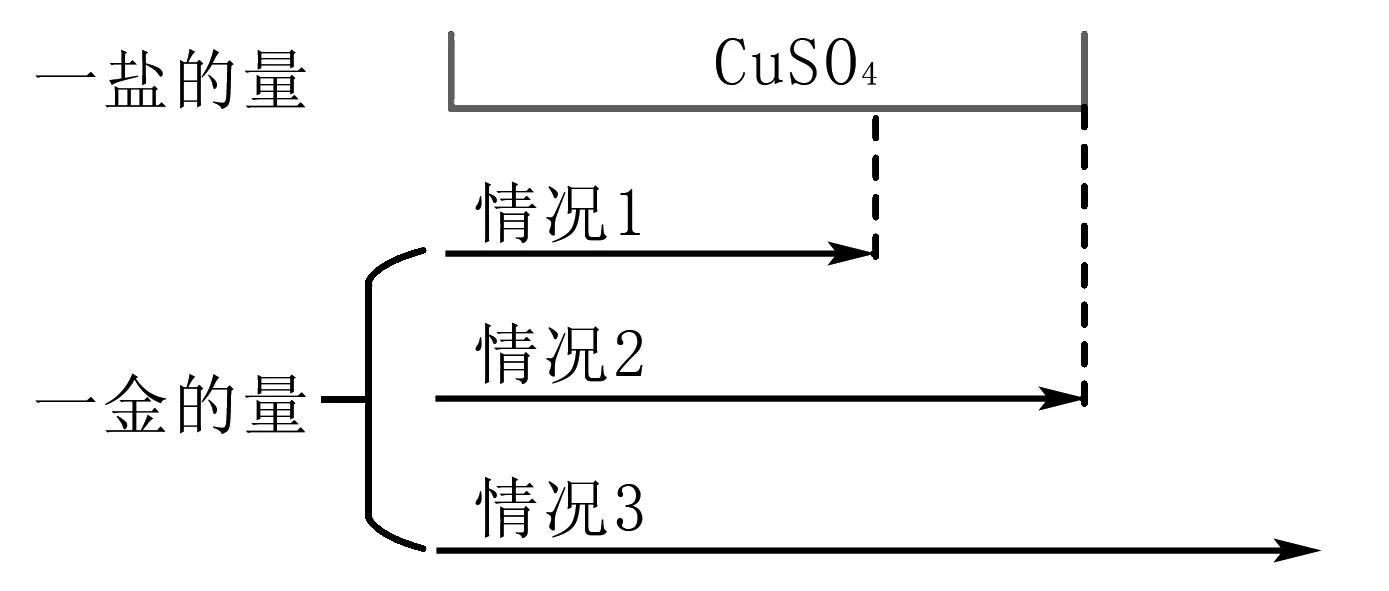
图1
情况2:Fe适量,(1)式发生, Fe与CuSO4恰好反应完,都无剩余;此时反应后的滤渣中一定有Cu,滤液中一定有FeSO4(反应生成物).
情况3:Fe过量,(1)式发生, Fe与CuSO4反应完,Fe剩余;此时反应后的滤渣中一定有Fe、Cu,滤液中一定有FeSO4(反应生成物).
步骤3判断,根据本题目中后半段已知条件“充分反应后过滤,滤液为蓝色”,通常溶液为蓝色,则含有铜离子,故对步骤2分析的3种情况进行筛选对照,可知情况1反应的结果中有CuSO4,溶液能够呈现蓝色.故滤渣中一定有Cu,滤液中一定有FeSO4和CuSO4.
例2将一定量的锌粉加入到硫酸亚铁、硫酸铜的混合溶液中,过一段时间后过滤,向滤渣中加入稀盐酸有气泡产生,则滤渣中一定有____,可能有____;滤液中一定有____,可能有____,一定没有____.
解析依据“三步法”:
步骤1审题,根据题目已知条件,此为“一金斗两盐”的情况:“一金”是指锌粉;“两盐”是指硫酸亚铁、硫酸铜.故可能会发生以下2种反应:

(1)

(2)
那如何快速判断哪个反应先发生呢?依据金属活动顺序:Zn→Fe→Cu,相距远的2种金属间先发生反应,故上述(1)式先发生反应,(2)式后发生反应.
步骤2分析,依据“一金”锌粉量的多少来判断反应后的具体情况.锌粉量少,则只发生(1)式的反应;锌粉量多,(2)式才有可能发生.故依据锌粉量反应的情况,如图2所示,具体为以下几种情况:
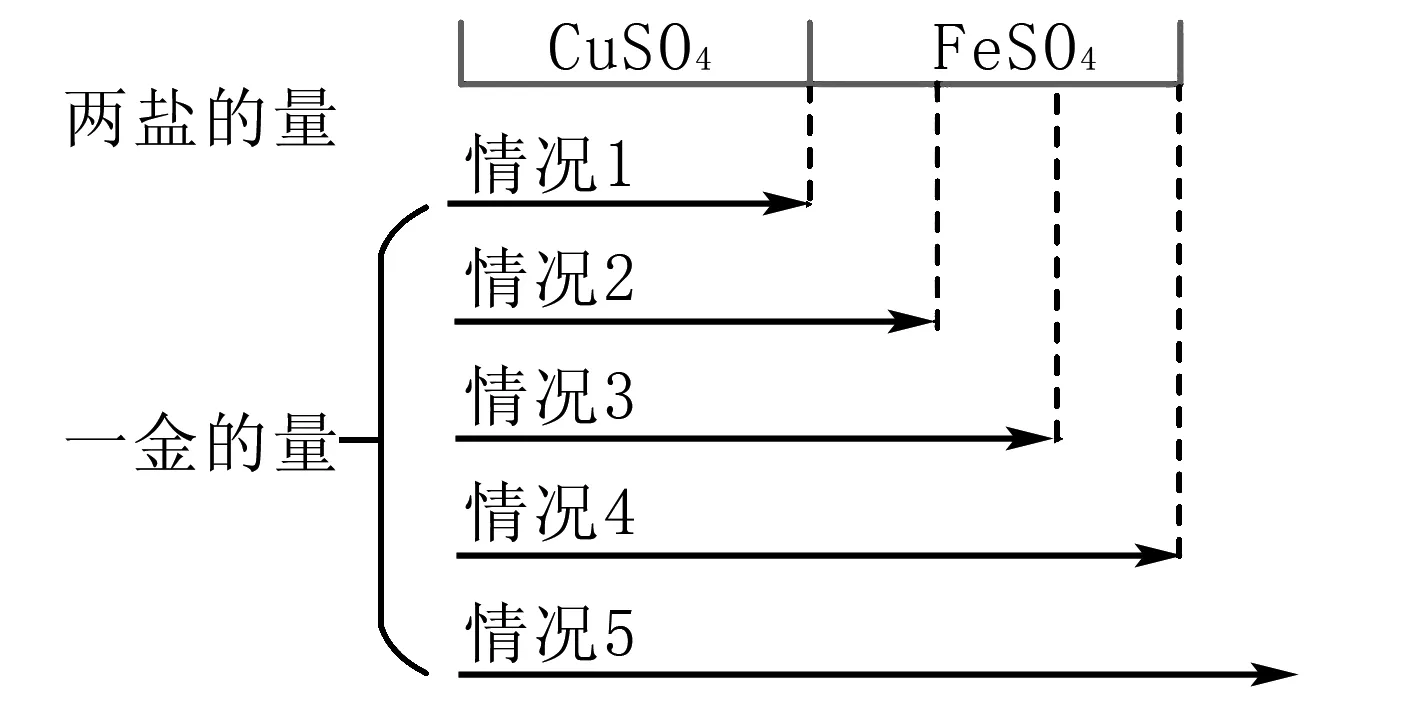
图2
情况1:Zn极少,(1)式发生,全部Zn参与(1)式反应,剩余部分CuSO4,(2)式不发生,此时反应后的滤渣中一定有Cu,滤液中一定有ZnSO4、CuSO4(反应后剩余的量)、FeSO4(没有参与任何反应,故剩余全部).
情况2:Zn较少,(1)式发生,Zn与CuSO4恰好反应完,Zn与CuSO4都无剩余,(2)式不发生,此时反应后的滤渣中一定有Cu,滤液中一定有ZnSO4、FeSO4(没有参与任何反应,故剩余全部).
情况3:Zn较多,(1)式发生,Zn与全部CuSO4反应完后,Zn有剩余,此时(2)式发生,剩余的Zn与部分FeSO4反应,Zn无剩余,FeSO4有剩余,故反应后的滤渣中一定有Cu、Fe,滤液中一定有ZnSO4、FeSO4(剩余的部分量).
情况4:Zn非常多,(1)式发生,Zn与全部CuSO4反应完后,Zn有剩余,此时(2)式发生,剩余的Zn恰好与全部FeSO4反应,Zn与FeSO4都无剩余,故反应后的滤渣中一定有Cu、Fe,滤液中一定有ZnSO4.
情况5:Zn过量,(1)式发生,Zn与全部CuSO4反应完后,Zn有剩余,此时(2)式发生,剩余的Zn与全部FeSO4反应后,Zn依然有剩余,FeSO4无剩余,故反应后的滤渣中一定有Cu、Fe、Zn,滤液中一定有ZnSO4.
步骤3判断,根据本题目中后半段已知条件“过一段时间后过滤,向滤渣中加入稀盐酸有气泡产生”,也就是说,在第一次反应发生后,后面又有反应发生,故对步骤2的分析的5种情况进行筛选对照,可知情况3、情况4、情况5中都先后有2次化学反应,满足本题目条件.故综合情况3、情况4、情况5的结果发现,滤渣中都有Cu和Fe,可能有Zn;滤液中一定有ZnSO4,可能有FeSO4,一定没有CuSO4.
例3将一定量的铝、铜粉末混合物加入硝酸银溶液中,充分反应过滤后,滤液为蓝色.则下列说法正确的是( ).
A.反应后所得滤渣中一定有Ag,滤液中一定有Al(NO3)3、Cu(NO3)2,可能有AgNO3
B.反应后所得滤渣中一定有Ag、Cu,滤液中一定有Al(NO3)3、Cu(NO3)2
C.反应后所得滤渣中一定有Ag、Cu,滤液中可能有Al(NO3)3、Cu(NO3)2、AgNO3
D.反应后所得滤渣中一定有Ag、Al、Cu,滤液中一定有Cu(NO3)2
解析依据“三步法”:
步骤1审题,根据题目已知条件,此为“一盐破两金”的情况:“一盐”是指硝酸银;“两金”是指铝、铜粉末.故可能会发生以下2种反应:

(1)

(2)
那如何快速判断哪个反应先发生呢?依据金属活动顺序:Al→Cu→Ag,相距远的2种金属间先发生反应,故上述(1)式先发生反应,(2)式后发生反应.
步骤2分析,依据“一盐”硝酸银的多少来判断反应后的具体情况.AgNO3量少,则只发生(1)式的反应;AgNO3量多,(2)式才有可能发生.故依据AgNO3的量反应的情况,如图3所示,具体为以下几种情况:
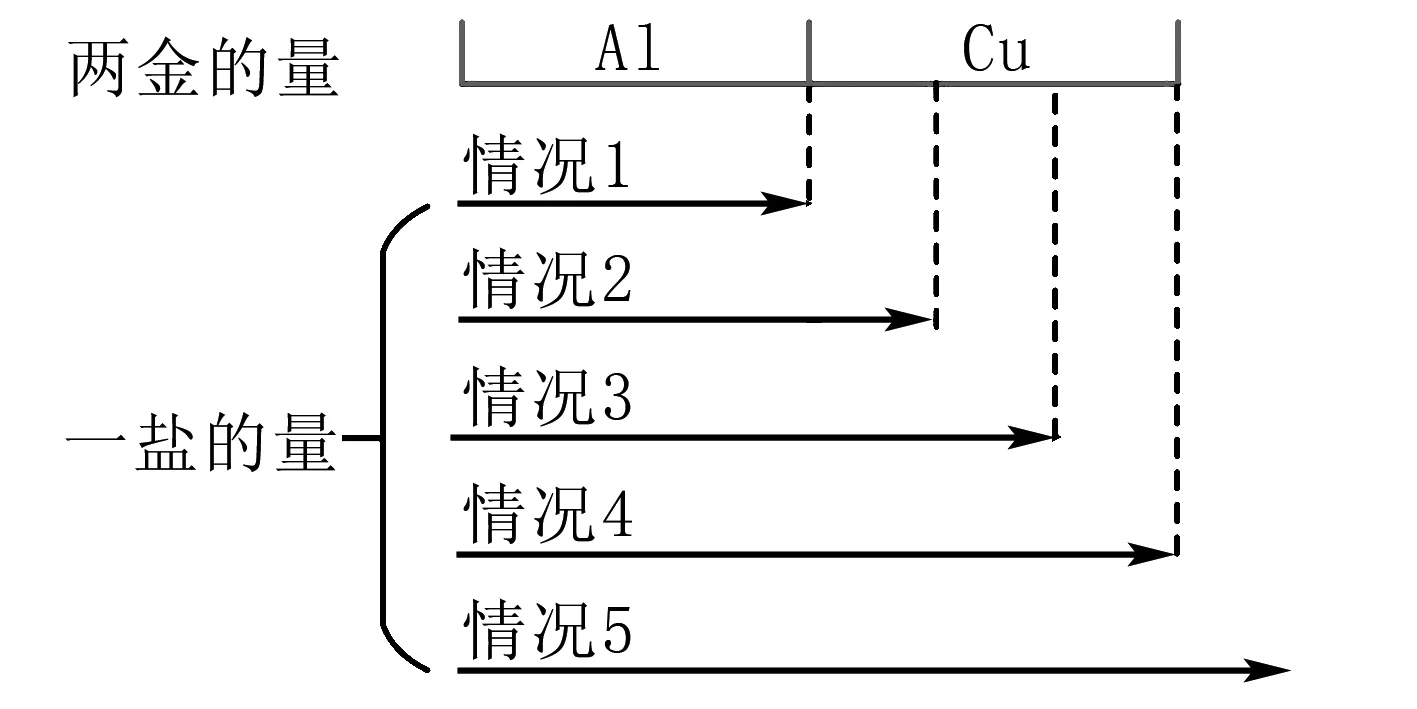
图3
情况1:AgNO3极少,(1)式发生,全部AgNO3参与(1)式反应,剩余部分Al,(2)式不发生,此时反应后的滤渣中一定有Ag、Al(反应后剩余的量)、Cu(没有参与任何反应,故剩余全部),滤液中一定有Al(NO3)3.
情况2:AgNO3较少,(1)式发生,AgNO3与Al恰好反应完,AgNO3与Al都无剩余,(2)式不发生,此时反应后的滤渣中一定有Ag、Cu(没有参与任何反应,故剩余全部),滤液中一定有Al(NO3)3.
情况3:AgNO3较多,(1)式发生,AgNO3与全部Al反应完后,AgNO3有剩余,此时(2)式发生,剩余的AgNO3与部分Cu反应,AgNO3无剩余,Cu有剩余,故反应后的滤渣中一定有Ag、Cu(剩余的部分量),滤液中一定有Al(NO3)3、Cu(NO3)2.
情况4:AgNO3非常多,(1)式发生,AgNO3与全部Al反应完后,AgNO3有剩余,此时(2)式发生,剩余的AgNO3恰好与全部Cu反应,AgNO3与Cu都无剩余,故反应后的滤渣中一定有Ag,滤液中一定有Al(NO3)3、Cu(NO3)2.
情况5:AgNO3过量,(1)式发生,AgNO3与全部Al反应完后,AgNO3有剩余,此时(2)式发生,剩余的AgNO3与全部Cu反应后,AgNO3依然有剩余,Cu无剩余,故反应后的滤渣中一定有Ag,滤液中一定有Al(NO3)3、Cu(NO3)2、AgNO3.
步骤3判断,根据本题目中后半段已知条件“充分反应后过滤,滤液为蓝色”,通常溶液为蓝色,则含有铜离子,故对步骤2的分析的5种情况进行筛选对照,可知情况3、情况4、情况5反应的结果中都有Cu(NO3)2,溶液能够呈现蓝色.故综合情况3、情况4、情况5的结果发现,三种情况的滤渣中都有Ag;滤液中一定有Al(NO3)3、Cu(NO3)2,可能有AgNO3,选择A.
值得注意的是,以上是金属与盐溶液反应所得滤液和滤渣成分的分析,平时除了“三步法”的分析,在题目中还要注意题干后部分的要求,例如,若所得滤液为蓝色,则滤液中一定有铜离子(Cu2+);若所得滤液为浅绿色,则滤液中一定有亚铁离子(Fe2+);若向所得滤渣中加入稀盐酸有无气泡,也可剔除部分可能情况.
2 总结分析
通常,金属与盐溶液反应的这类题型大多数分为3种情况:“一金一盐”、“一金多盐”和“一盐多金”.“一金一盐” 是指一种金属与一种盐溶液反应,“一金多盐”是指一种金属与多种盐溶液反应,“一盐多金”是指一种盐溶液与多种金属反应.这三种情况的解答都围绕金属活动顺序进行,抓住距离远的两类金属先反应为重点,然后按照“一金”或者“一盐”量的多少来逐步分析,最后结合题目问题得出结果.
