HDAC6基因敲除的人肝癌细胞系的构建及其生物学功能鉴定
2022-08-01张亚楠叶棋浓丁丽华阎新龙
张 婷,张亚楠,刘 婕,叶棋浓,丁丽华,阎新龙
1 北京工业大学 环境与生命学部,北京 100124;2 军事科学院 军事医学研究院 生物工程研究所,北京100850
肝癌是消化系统最常见且恶性程度较高的肿瘤,是癌症引起死亡的第三大主要原因[1]。肝癌早期诊断困难,侵袭性和转移性强,发现时通常已是晚期[2]。临床上肝癌总体疗效欠佳,仅一小部分患者符合手术条件,复发率高且预后极差[3-4]。组蛋白去乙酰化是重要的表观遗传学机制之一,而组蛋白去乙酰化酶(histone deacetylases,HDACs)是组蛋白去乙酰化的主要介导因子。HDAC6通过去乙酰化α-tubulin调节微管稳定性,是一种微管蛋白去乙酰化酶,有研究证实其在调控基因表达、细胞增殖、凋亡、迁移、免疫反应、蛋白降解等方面发挥着重要作用[5-8]。本研究采用CRISPR/Cas9基因组编辑技术,构建了在人肝癌细胞HepG2中将HDAC6基因敲除(knockout,KO)的稳定表达细胞系,并通过实验检测了HDAC6基因敲除对HepG2细胞增殖和迁移能力、α-tubulin乙酰化程度、耐药性、细胞周期和凋亡的影响,为在肝癌细胞中进一步研究HDAC6蛋白的功能机制提供基因敲除的细胞模型。
材料与方法
1 材料 人胚肾细胞293T、人肝癌细胞HepG2、大肠埃希菌DH5α、CRISPR/Cas9载体(本实验室保存);DMEM高糖培养基(Gibco公司);胎牛血清(杭州四季青公司);BsmBI限制性内切酶、T4 DNA连接酶、T4多聚核苷酸激酶(NEB公司);质粒提取试剂盒(Promega公司);胶回收试剂盒、细胞基因组提取试剂盒(康为世纪公司);细胞周期与细胞凋亡试剂盒(金普来公司);Transwell小室(Corning公司);抗HDAC6兔多克隆抗体、抗AC-α-tubulin兔多克隆抗体、抗α-tubulin兔多克隆抗体(Proteintech公司);辣根过氧化物酶偶联的羊抗兔IgG、辣根过氧化物酶偶联的羊抗鼠IgG、鼠抗人β-actin抗体(Santa Cruz公司);sgRNA序列合成、鉴定引物合成、质粒测序均由北京博迈德基因技术有限公司完成。
2 设计特异性sgRNA 以CRISPR/Cas9的靶点设计原则为依据,选取HDAC6基因的第三外显子序列设计特异性靶向HDAC6基因的sgRNA。sgRNA对应的靶序列的3’端紧跟NGG序列,长度为20 bp。为了使序列能与BsmBI酶切后形成的黏性末端互补,在sgRNA正义链模板的5’端添加了CACC,反义链模板的5’端添加了AAAC,另外根据靶点的位置相应设计了HDAC6敲除效果的鉴定引物。引物序列见表1。
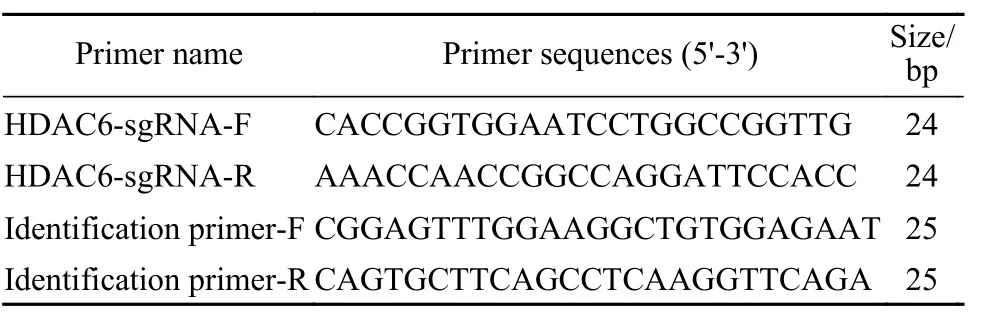
表1 合成寡核苷酸序列Tab. 1 Synthesis of oligonucleotide sequences
3 LentiCRISPR-HDAC6-sgRNA重组质粒慢病毒的包装与感染 LentiCRISPR-HDAC6-sgRNA重组质粒构建成功(结果未显示)后,将293T细胞提前接种在6孔板内,培养约24 h,密度为50% ~ 70%时进行转染。重组质粒(或LentiCRISPR质粒)、PAX2质粒和VSVG质粒按照4:3:2的比例使用,6孔板的用量为2 µg重组质粒(或LentiCRISPR质粒)、1.5 µg PAX2质粒和1 µg VSVG质粒,将三种质粒混合于200 µL无血清无双抗的DMEM中,加入13.5 µL Megatran转染试剂,均匀滴加到6孔板中,放回37℃孵箱继续进行培养,转染4 ~ 6 h后换液,48 h后收取病毒液上清,4℃下3 000 r/min离心5 min。取300 µL包装好的病毒上清均匀滴加到密度约60%的HepG2细胞的培养基中,24 h后换液,取300 µL病毒上清滴加到细胞培养基中进行二次感染,培养24 h后每孔换成带有嘌呤霉素(2 µg/mL)的DMEM培养基进行筛选。1周后,将不再死亡的细胞集落吹散于24孔板中,长满后传至6 cm皿培养得到稳定的单克隆细胞。
4 单克隆细胞基因组DNA的提取和鉴定 收取部分单克隆细胞提取基因组DNA作为模板,使用鉴定引物按照PCR反应体系进行PCR反应,反应产物利用琼脂糖凝胶电泳检测,将检测后的反应产物连接到pBM23-T载体进行转化涂板,挑取不同的单克隆菌落提取质粒后送公司进行测序鉴定。
5 Western blot检测相关蛋白表达 收取部分野生型(wild type,WT)细胞和HDAC6 KO的HepG2稳定表达细胞,使用PBS清洗细胞1遍,在细胞沉淀中加入RIPA裂解液裂解细胞,裂解液体积为细胞体积的3倍,置于冰上30 min使细胞充分裂解,4℃下12 000 r/min离心15 min,收取含蛋白的上清液测定浓度,加入等体积的2 × SDS上样缓冲液,将样品煮沸15 min使蛋白变性后进行SDSPAGE使蛋白被分开。电泳结束后利用湿电转膜仪将蛋白转至硝酸纤维素膜上,膜于室温下使用5%脱脂牛奶孵育1 h以封闭非特异性位点,HDAC6抗体(1∶500稀释)和β-actin抗体(1∶5 000稀释)在冰箱4℃孵育过夜;1 × TBST洗膜5 min,重复3次,HDAC6用辣根过氧化物酶偶联的羊抗兔IgG(1∶5 000稀释)在室温条件下孵育1 h,β-actin用辣根过氧化物酶偶联的羊抗鼠IgG (1∶5 000稀释)在室温条件下孵育1 h。1 × TBST洗膜5 min,重复3次,利用化学发光法进行显影。
6 CCK-8检测细胞增殖能力 WT细胞和HDAC6 KO的HepG2细胞消化和计数后以4 × 103/孔的细胞密度分别接种至96孔板中,每组设3个复孔;分别在0 h、24 h、48 h、72 h、96 h时每孔加入100 µL CCK-8试剂,37℃孵育1 h后,取出,利用酶标仪测定样品的D450nm值并记录。
7 划痕实验和Transwell迁移实验检测细胞迁移能力 将WT和HDAC6 KO的HepG2细胞消化分别接种至6孔板中,在细胞几乎长满后,用无菌移液器枪头在孔中划出3条直线,PBS清洗去除残留细胞,然后加入含0.5%胎牛血清的DMEM培养基进行培养,在划痕处分别选上、中、下3点在显微镜下拍下0 h图片。24 h后,在初始位置再次拍照;用图像软件测量细胞的迁移距离。
在24孔板中加入500 µL含有20%胎牛血清的DMEM作为下液,将小室放入24孔板中,将WT和HDAC6 KO的HepG2细胞消化后收集至1.5 mL EP管中,用不含有血清和双抗的DMEM清洗3次后使用细胞计数仪对细胞进行计数,按5 ×104/室的细胞密度分别接种至Transwell上室,放回37℃孵箱继续进行培养,24 h后吸弃培养基,PBS清洗小室后使用4%多聚甲醛固定30 min下室层面的细胞,再用1%结晶紫染色30 min,再次使用PBS清洗后,用棉签轻轻擦去上室中的细胞,显微镜下观察下室层面的细胞,拍照,计数。
8 Western blot鉴定α-tubulin乙酰化程度 收取WT和HDAC6 KO的HepG2细胞冰浴充分裂解,蛋白定量后加入上样缓冲液,煮沸使蛋白变性后进行SDS-PAGE使蛋白分开。电泳结束后利用湿电转膜仪将蛋白转至硝酸纤维素膜,使用5%脱脂牛奶封闭非特异性位点,HDAC6抗体(1∶500稀释)、AC-α-tubulin抗体(1∶1 000稀释)、α-tubulin抗体(1∶1 000稀释)以及β-actin抗体(1∶5 000稀释),在冰箱4℃孵育过夜。1 × TBST洗膜5 min,重复3次,HDAC6、AC-α-tubulin、α-tubulin用辣根过氧化物酶偶联的羊抗兔IgG(1∶5 000稀释)在室温条件下孵育1 h,β-actin用辣根过氧化物酶偶联的羊抗鼠IgG(1∶5 000稀释)在室温条件下孵育1 h。1 × TBST洗膜5 min,重复3次,使用化学发光法显影。
9 细胞存活实验检测细胞对ACY-1 215的敏感度
将WT和HDAC6 KO的HepG2细胞消化计数后以3 000个/孔的细胞密度接种到96孔板中,每组设置3个复孔,分别在每孔进行ACY-1215处理。处理48 h后每孔加入100 µL CCK-8试剂,37℃孵育1 h后,取出利用酶标仪测定样品的D450nm值并记录数值。
10 流式细胞术检测细胞周期 将WT和HDAC6 KO的HepG2细胞分别接种至6孔板中,放回37℃孵箱继续培养24 h后使用胰酶消化收集细胞,使用PBS清洗细胞1次,使用1 mL含70%乙醇的固定液将细胞重悬,置于冰箱4℃固定过夜。染色前PBS洗去固定液,在细胞沉淀中加入500 µL碘化丙啶(propidium iodide,PI)染色液重悬细胞,加入RNaseA(终浓度为0.25 mg/mL),在37℃孵箱避光孵育30 min后进行流式细胞仪分析。
11 流式细胞术检测细胞凋亡 将WT和HDAC6 KO的HepG2细胞消化分别接种至6孔板中,培养24 h后,加入胰酶消化收集细胞,使用在冰箱4℃预冷后的PBS清洗细胞,重复清洗2次后,加入250 µL结合缓冲液,调节细胞悬液的浓度为1×106/mL,取100 µL细胞悬液置于流式管中,加入5 µL Annexin V-FITC和10 µL PI溶液充分混匀,在室温下避光孵育15 min后,在流式管中加入400 µL PBS,于1 h内进行流式细胞仪分析。
结 果
1 HDAC6基因敲除细胞系内HDAC6蛋白表达
为了检测HDAC6 sgRNA的剪切效率,将重组质粒转染至293T细胞中,48 h后收取细胞,提取细胞基因组进行PCR扩增,连接pBM23-T载体后转化涂板,挑取30个单克隆进行测序,结果显示有23个单克隆都发生了不同程度的剪切,其余7个单克隆未发生剪切为野生型,剪切效率约为76.7%,可以进行下一步实验。进一步将重组质粒慢病毒包装感染HepG2细胞,嘌呤霉素筛选后有限稀释,将单克隆细胞接种至6 cm皿后,挑取5个细胞克隆,Western blot检测HDAC6的蛋白表达水平(图1)。结果:第3个单克隆细胞中HDAC6蛋白完全没有表达;分别提取WT细胞和第3个单克隆细胞的基因组DNA当作模板,用设计的鉴定引物进行PCR扩增,琼脂糖凝胶电泳后测序。结果:HDAC6 sgRNA于第三外显子正义链产生了2 bp缺失突变、反义链产生了5 bp缺失突变,改变了HDAC6基因的开放阅读框,终止了HDAC6蛋白的翻译(图2)。结果:成功构建HepG2 HDAC6基因敲除的稳定细胞系。
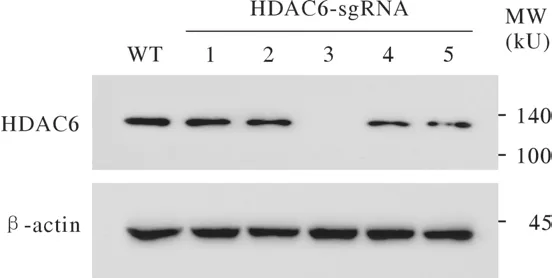
图1 HepG2单克隆细胞中HDAC6的敲除鉴定Fig.1 Identification of HDAC6 KO HepG2 monoclonal cells
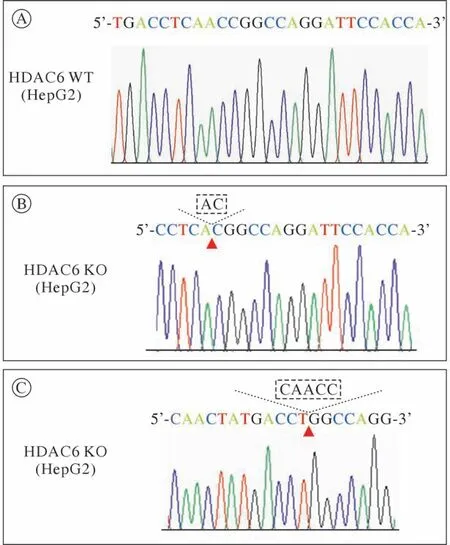
图2 基因组DNA测序结果 A:HepG2 WT细胞序列;B:HDAC6 KO细胞的正义链序列;C:HDAC6 KO细胞的反义链序列。“▲”表示碱基缺失的位置Fig.2 Identification of HDAC6 KO HepG2 cell lines by DNA sequencing. A: Sequence of WT HepG2 cells; B: One allele sequence of HDAC6 KO cells; C: The other allele sequence of HDAC6 KO cells. “▲” indicates the location of the base missing
2 HDAC6敲除后细胞增殖速度的变化 HDAC6 KO细胞和WT细胞接种于96孔板,用CCK-8试剂盒检测敲除HDAC6对HepG2细胞增殖的影响。结果:敲除HDAC6可以显著抑制HepG2细胞的增殖(图3),48 h、72 h和96 h时HDAC6 KO组与WT组细胞的增殖差异均有统计学意义。
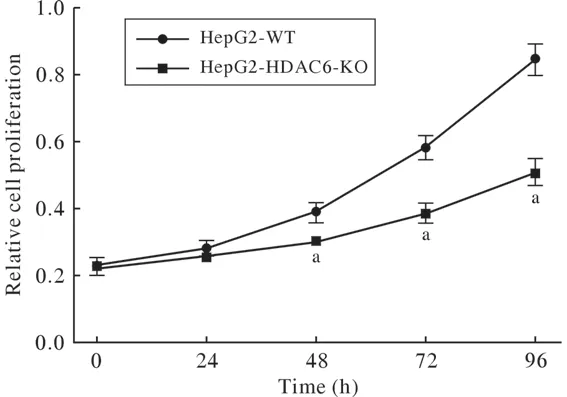
图3 HepG2 WT细胞和HDAC6 KO细胞的增殖曲线(aP<0.01,vs WT)Fig.3 Proliferation curves of HepG2 WT and HDAC6 KO cells(aP<0.01, vs WT)
3 HDAC6敲除后细胞迁移能力的变化 实验设置了WT组、HDAC6 KO组。划痕实验:在划痕24 h后,计算测量迁移距离,Transwell迁移实验:细胞接种于不铺基质胶的Transwell小室,培养细胞24 h固定、染色后拍照,计数。结果:在划痕实验中,WT组细胞迁移距离约为HDAC6 KO组细胞迁移距离的2.5倍(图4),在Transwell迁移实验中,WT组平均迁移细胞数目为HDAC6 KO组迁移细胞数目的2.3倍(图5)。以上结果为3次独立实验结果的平均值。实验结果表明:敲除HDAC6可以明显抑制HepG2细胞的迁移,WT组与HDAC6 KO组细胞的迁移速度差异有统计学意义。
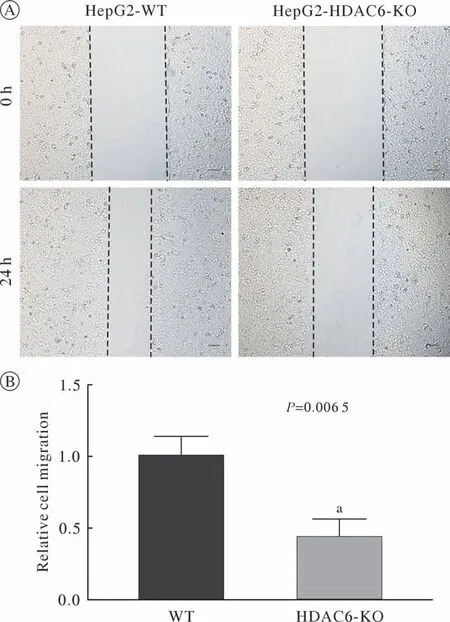
图4 HDAC6对HepG2细胞迁移速度的影响A:HepG2 WT细胞和HDAC6 KO细胞迁移速度的变化,标尺:50 µm;B:划痕实验统计分析结果(aP <0.01,vs WT)Fig.4 Effect of HDAC6 on migration of HepG2 cellsA: Wound scratch healing assay of HepG2 WT or HDAC6-KO cells. Scale bar: 50 µm; B: Statistical analysis of wound scratch healing assay (aP <0.01, vs WT)
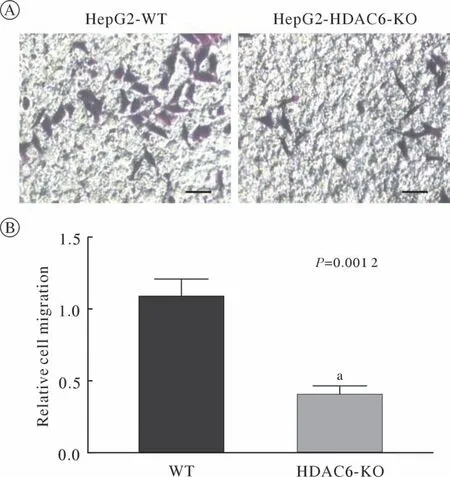
图5 HDAC6对HepG2细胞迁移数量的影响A:HepG2 WT细胞和HDAC6 KO细胞迁移数量的变化,标尺:50 µm;B:迁移实验统计分析结果(aP<0.01,vs WT)Fig.5 Effect of HDAC6 on migration of HepG2 cellsA: Transwell migration assay of HepG2 WT or HDAC6-KO cells. Scale bar: 50 µm;B: Statistical analysis of Transwell migration assay (aP<0.01, vs WT)
4 HDAC6敲除后α-tubulin乙酰化程度的变化实验设置WT组和HDAC6 KO组,Western blot检测HDAC6、α-tubulin、AC-α-tubulin的蛋白表达水平(图6)。结果:HDAC6在空细胞组表达正常,HDAC6 KO组完全没有表达,α-tubulin在空细胞组与HDAC6 KO组表达相同、AC-α-tubulin在HDAC6 KO组表达明显增强。结果:HepG2细胞中HDAC6被敲除后使α-tubulin乙酰化程度增强。
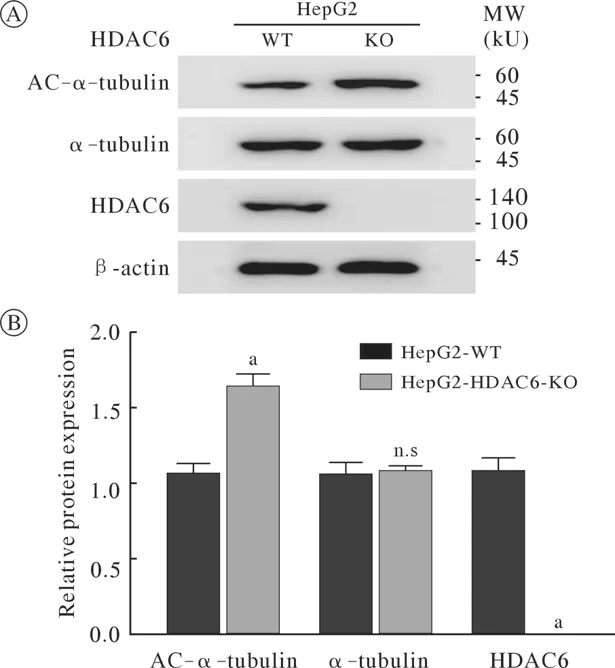
图6 HDAC6敲除后α-tubulin乙酰化程度的变化A:HDAC6敲除后AC-α-tubulin、α-tubulin的蛋白表达;B:蛋白表达统计分析结果(aP<0.01,n.s:no significance,vs WT)Fig.6 Effect of HDAC6 knockout on the acetylation of α-tubulinA: Protein expression of AC-α-tubulin, α-tubulin and HDAC6; B: Statistical analysis of protein expression(aP<0.01, n.s: no significance, vs WT)
5 HDAC6敲除后细胞对ACY-1 215敏感度的改变 实验设置WT组和HDAC6 KO组,用CCK-8试剂盒检测HepG2细胞敲除HDAC6对ACY-1215敏感度的影响(图7)。结果:HDAC6 KO组细胞活力明显高于WT组细胞。结果表明:敲除HDAC6降低了HepG2细胞对ACY-1215的敏感度。
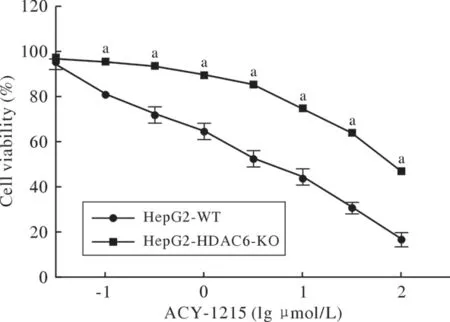
图7 HDAC6敲除后细胞对ACY-1215敏感度的改变(aP<0.01,vs WT)Fig.7 Effect of HDAC6 knockout on the cell viability exposed to ACY-1215 (aP<0.01, vs WT)
6 HDAC6敲除对细胞周期的影响 实验设置WT组和HDAC6 KO组,与WT组比较,HDAC6 KO组G1期细胞比例显著升高,而S期细胞比例显著下降(图8)。结果表明,敲除HDAC6能够使HepG2细胞发生G1期阻滞,降低细胞增殖能力。
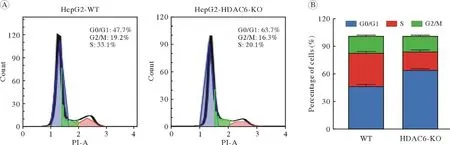
图8 HepG2 WT和HDAC6 KO细胞周期的变化A:流式细胞术检测HepG2 WT和HDAC6 KO细胞的细胞周期;B:柱状图显示HepG2细胞的细胞周期分布Fig.8 Effect of HDAC6 knockout on cell cycle of HepG2 cellsA: The cell cycle was evaluated by flow cytometry; B: Histogram showed the cell cycle distributions of HepG2 cells
7 HDAC6敲除对细胞凋亡的影响 实验设置WT组和HDAC6 KO组,实验结果显示HDAC6 KO组较WT组细胞的凋亡率显著升高(图9)。这表明敲除HDAC6可以促进HepG2细胞的凋亡,WT组与HDAC6 KO组细胞的凋亡比例差异有统计学意义。
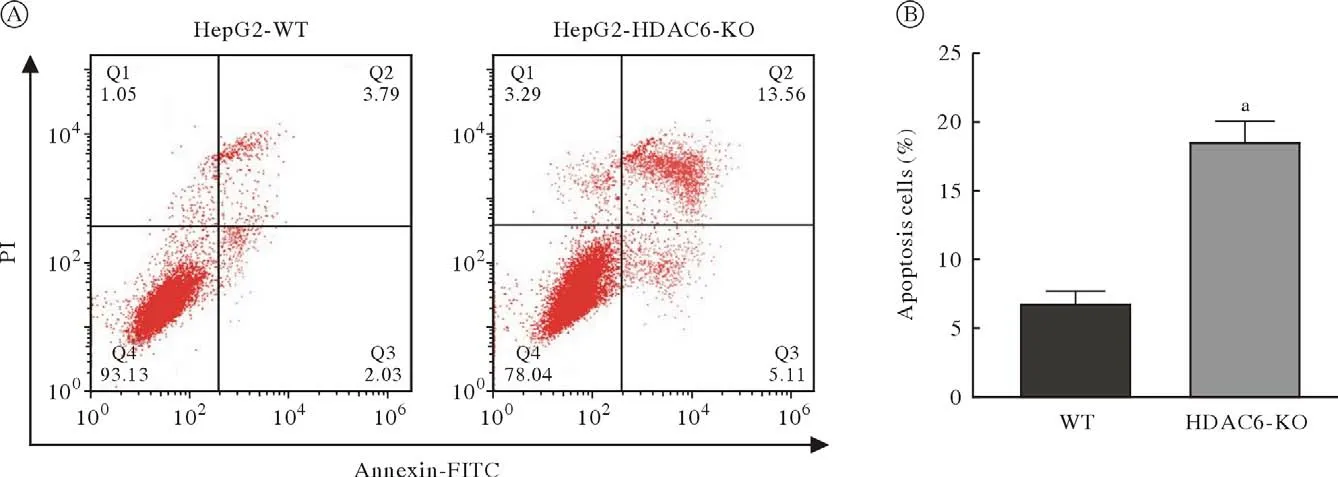
图9 HepG2 WT和HDAC6 KO细胞凋亡的变化A:流式细胞术检测HepG2 WT和HDAC6 KO细胞的凋亡;B:细胞凋亡率的统计分析结果(aP <0.01,vs WT)Fig.9 Effect of HDAC6 knockout on apoptosis of HepG2 cellsA: Apoptosis was tested by flow cytometry; B: Statistical analysis of apoptosis rates (aP <0.01, vs WT)
讨 论
肝癌是全球四大癌症相关死亡原因之一,其发生发展是一个多因素、多阶段、多通道调控的复杂过程。在诱发肝癌的原因中乙型肝炎病毒和丙型肝炎病毒感染是主要的危险因素[9]。肝癌通常诊断较晚,死亡人数在全球癌症死亡人数中排第二[2]。因此针对其发生发展机制的研究变得尤为重要。成簇的规律间隔的短回文重复序列/CRISPR相关蛋白9(clustered regularly interspaced short palindromic repeat,CRISPR/CRISPR-associated protein 9,Cas9)存在于细菌免疫系统,经过人为改造后成为了一种简单快速的基因编辑工具,是除了锌指核酸酶和转录激活因子样效应因子核酸酶这两种技术以外的第三代基因编辑技术,Cas9蛋白含有两个核酸酶结构域,可以分别切割DNA的两条链[10]。CRISPR/Cas9技术能够有效地修饰各种物种和细胞类型的内源性基因,通过设计特异性sgRNA与靶序列进行碱基配对,引导Cas9蛋白结合到靶序列,利用细胞的非同源性末端链接或同源重组修复机制对断裂的DNA进行插入、缺失、修复或替换,从而发挥其DNA切割的功能。CRISPR/Cas9简单易操作、成本低、效率高且突变位点选择性强,该技术被成功用于编辑许多领域生物体的基因组[11-12]。CRISPR/Cas9技术简单易操作且应用广泛,是目前效率最高的基因编辑技术,也是近年来分子生物学领域研究的热点技术之一[13]。
肿瘤的侵袭性是一种细胞运动,细胞骨架作为细胞的关键结构,在细胞运动过程中不断被重塑。在此背景下,一些与肿瘤细胞的微管和肌动蛋白依赖动力学相关的分子已被认为可能是肝内肝癌转移的预测因子或预防治疗靶点[14]。HDAC6是组蛋白去乙酰化酶家族成员之一,最初被称为微管相关脱乙酰酶,其通过去乙酰化组蛋白从而抑制基因的转录,进而影响癌细胞的生长状态,调节多种重要的生物学进程[15-17]。有研究证明HDAC6基因的下调显著降低了肝癌细胞系的迁移和侵袭活性,HDAC6蛋白的过表达参与了肝癌细胞的迁移和侵袭活性[14,18]。
α-tubulin是细胞骨架的重要组成部分,在细胞结构维持和细胞转运过程中发挥作用。研究证明抑制HDAC6能够使α-tubulin乙酰化升高,进而诱导细胞凋亡[19]。本研究结果显示,HDAC6基因敲除后α-tubulin乙酰化程度明显增强且对HDAC6抑制剂ACY-1215的敏感度显著降低。
细胞凋亡受抑制在肿瘤发生、发展过程中有相当重要的作用。本研究结果显示HDAC6基因敲除能够使HepG2细胞发生G1期阻滞,促进HepG2细胞的凋亡,降低细胞的增殖能力。细胞周期和凋亡的改变受许多相关蛋白的调控,如Cyclin-CDK复合物、Caspase家族蛋白等[16,20-21]。本研究结果尚未显示HDAC6基因敲除后细胞周期和凋亡相关蛋白的变化,因此HDAC6调控HepG2细胞周期和凋亡的具体机制还有待进一步研究。
综上,本研究结果提示HDAC6是肝癌发生过程中的重要蛋白,可能成为肝癌的潜在治疗靶点。HepG2细胞HDAC6基因敲除稳定细胞系模型的建立,为进一步体内外研究HDAC6在肝癌进展中的调控作用机制奠定了基础。
