71例Gitelman综合征患者的临床和遗传学分析
2022-08-01巴建明窦京涛吕朝晖母义明谷伟军
吴 婷,臧 丽,陈 康,裴 育,巴建明,窦京涛,吕朝晖,母义明,谷伟军
1 解放军医学院,北京 100853;2 解放军总医院第一医学中心 内分泌科,北京 100853
Gitelman综合征(Gitelman syndrome,GS)又名家族性低钾低镁血症,是最常见的遗传性肾小管病变,呈常染色体隐性遗传[1]。GS的主要致病机制为位于染色体16q13上的SLC12A3基因发生突变,导致噻嗪类敏感的Na-Cl协同转运蛋白(sodium chloridel co-transporter,NCCT)失活,表现为低钾代谢性碱中毒、低镁血症和低尿钙[2]。有研究表明,该病的患病率为(1 ~ 10)/40 000,在亚洲人群中患病率更高,在日本的患病率达10.3/10 000[3]。大多数GS患者起病隐匿,病情轻微,表现为由慢性低钾、低镁所导致的乏力、搐搦、夜尿增多等症状,但也有合并室性心律失常、横纹肌溶解、痛风、胰岛素抵抗等病例的报道[4-7]。由于该病的临床表现多样,临床上存在着漏诊、误诊的风险。本研究以国内最大样本的GS患者和家系为研究对象,对GS患者基因型与表型的关系进行分析,以期指导诊治,改善患者的远期预后。
资料与方法
1 资料来源 纳入2007年7月- 2020年9月于解放军总医院第一医学中心内分泌科就诊的71例临床诊断为GS的患者,包含其中7例患者的家系。纳入标准:1)符合2017年Gitelman综合征诊治专家共识(中)的诊断要点[8];2)留有DNA样本且临床资料完整。排除标准:1)无利尿剂、甘草制剂或棉籽油服用史,无腹泻和呕吐史;2)排除原发性或继发性肾小球肾炎、肾病综合征、慢性肾衰竭、慢性肾盂肾炎等。遵循的程序符合《赫尔辛基宣言》原则。所有纳入本研究的患者及其家系均签署知情同意书。
2 表型分析 收集GS患者及其家系的临床资料,包括年龄、性别、就诊时间等基本资料,一般症状、神经肌肉、泌尿、消化、心血管等系统症状、内分泌及生长发育异常等临床症状,血脂、血糖、尿酸、动脉血气、血尿电解质水平等实验室检查、腹部超声、CT等影像学检查结果。
3 基因型分析 提取外周血白细胞基因组DNA,测序由上海韦韩斯生物医药科技有限公司完成,首先通过标准的二代测序(next-generation sequencing,NGS)数据分析流程与生物信息学工具,鉴定相应基因上的变异,然后在一代测序仪上进行验证,以确认该患者在已知GS致病基因上的变异情况。将检测到的突变与人类基因突变数据库(HGMD)和PubMed搜索结果进行比对,进而过滤、去除与GS无关的常见变异,最终获得可能与疾病表型相关的新发变异,并用在线软件SIFT、Polyphen 2和VarSite预测突变位点的致病性。
4 统计学方法 采用SPSS21.0统计学软件对数据进行统计分析,Shapiro-Wilk检验检测数据是否符合正态分布。正态分布计量资料以±s表示,组间比较采用独立样本t检验或方差分析;非正态分布计量资料以Md(IQR)表示,采用Mann-WhitneyU检验或Kruskal-WallisH检验。计数资料以例数(百分比)表示,其组间比较采用χ2检验或 Fisher精确检验。P<0.05为差异有统计学意义。
结 果
1 患者一般资料和临床症状 71例GS患者中,男性44例(62.0%),女性27例(38.0%),平均发病年龄为(26.83±13.80)岁,平均确诊年龄为(33.01±13.95)岁。本研究患者生长发育未见明显异常,平均体质量指数为(22.72±3.31) kg/m2,血压正常或偏低,平均血压(116.07±13.13) mmHg/(72.73±8.92) mmHg (收缩压/舒张压,1 mmHg=0.133 kPa)。GS患者的临床表现多样,最常累及神经肌肉系统,肢体乏力为最常见的临床症状(52.1%),其次为肌无力(40.8%)、多尿(35.2%)、肌肉痉挛或抽搐(26.8%)、肢体麻木(23.9%)、蛋白尿(23.9%)、肌肉疼痛(19.7%)和手抖(19.7%)等,女性相比男性更易出现肌肉痉挛或抽搐(40.7%vs18.2%,P=0.037)和肢体麻木(37.0%vs15.9%,P=0.043),其余各症状不存在性别差异。见表1。
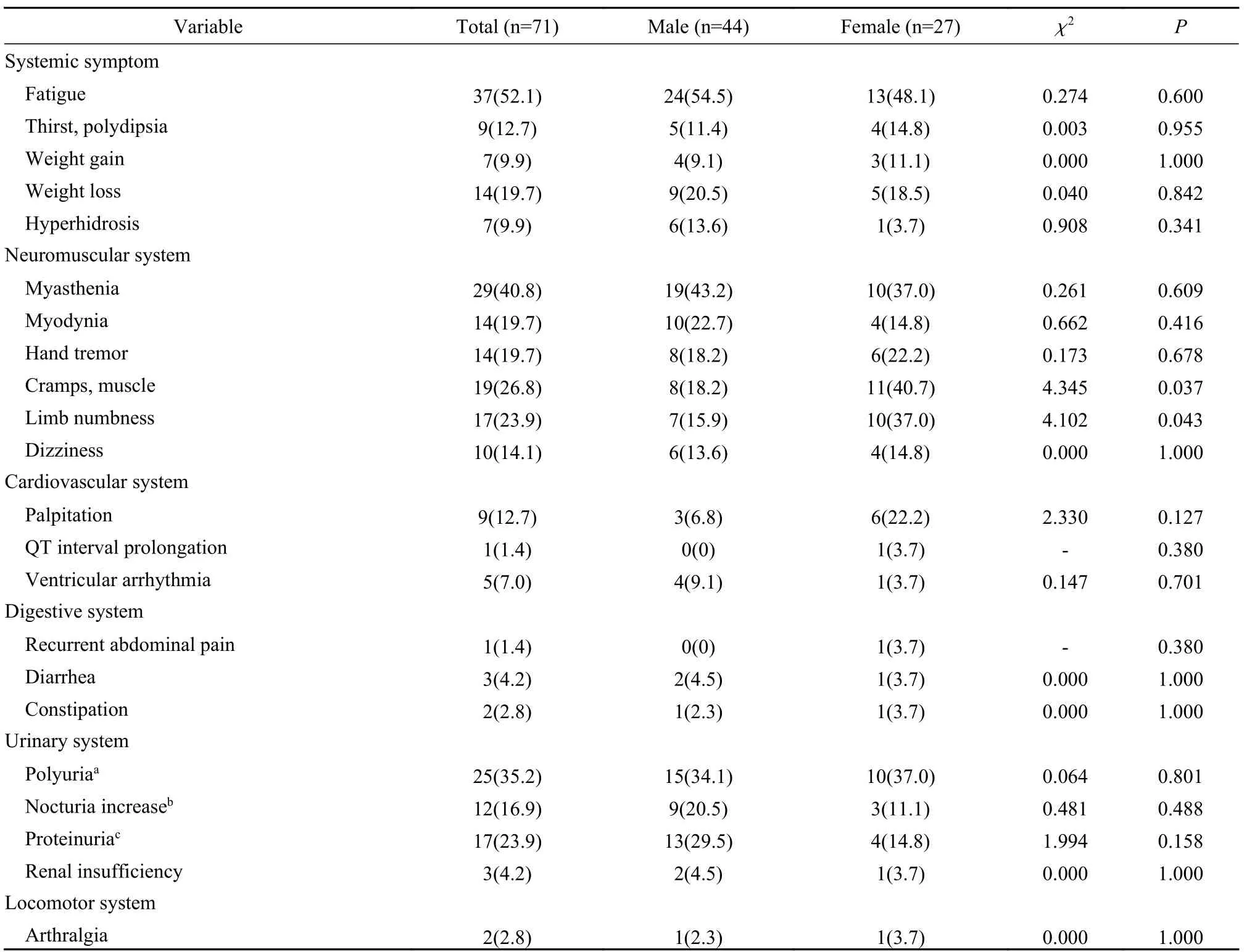
表1 不同性别的Gitelman综合征患者临床症状差异(n, %)Tab. 1 Differences in clinical symptoms of Gitelman syndrome patients by different genders (n, %)
2 实验室检查结果 71例GS患者入院时均合并低钾血症,血钾最低水平为(2.29±0.40) mmol/L,钾离子排泄分数为18.66%(11.13%,26.35%)。63例表现为代谢性碱中毒,平均动脉血pH为(7.44±0.27),平均HCO3-为(29.04±2.72) mmol/L,平均剩余碱为(4.23±2.44) mmol/L。患者入院后血镁最低水平为(0.51±0.12) mmol/L,镁离子排泄分数4.15%(3.30%,6.46%),16例(22.5%)无低镁血症。患者的尿钙水平为0.63(0.40,1.13) mmol/24 h,尿钙/肌酐为0.06(0.03,0.14) mmol/mmol,6例(8.4%)无典型低尿钙。62例入院后行卧立位试验,多数表现为肾素-血管紧张素-醛固酮(renin-angiotensin-aldosterone system,RAAS)系统激活。患者卧位血浆肾素活性(8.28±3.59) µg/(L·h)[正常范围<0.79 µg/(L·h)],立位血浆肾素活性(9.49±4.16) µg/(L·h)[正常范围0.93 ~ 8.58 µg/(L·h)],卧位醛固酮水平为(556.46±427.17) pmol/L[正常范围163.4 ~ 481.9 pmol/L],立位醛固酮水平为(692.02±307.12) pmol/L[正常范围180.1 ~ 810.9 pmol/L]。20例患者入院后行OGTT试验,结合患者既往史,10例(14%)有2型糖尿病,3例(4%)有糖耐量减低异常。此外,25例(35%)有脂肪肝,13例(18%)有高尿酸血症,27例(38%)有血脂紊乱。男性患者较女性患者更易出现血脂紊乱和尿酸升高(P<0.05)。见表2。
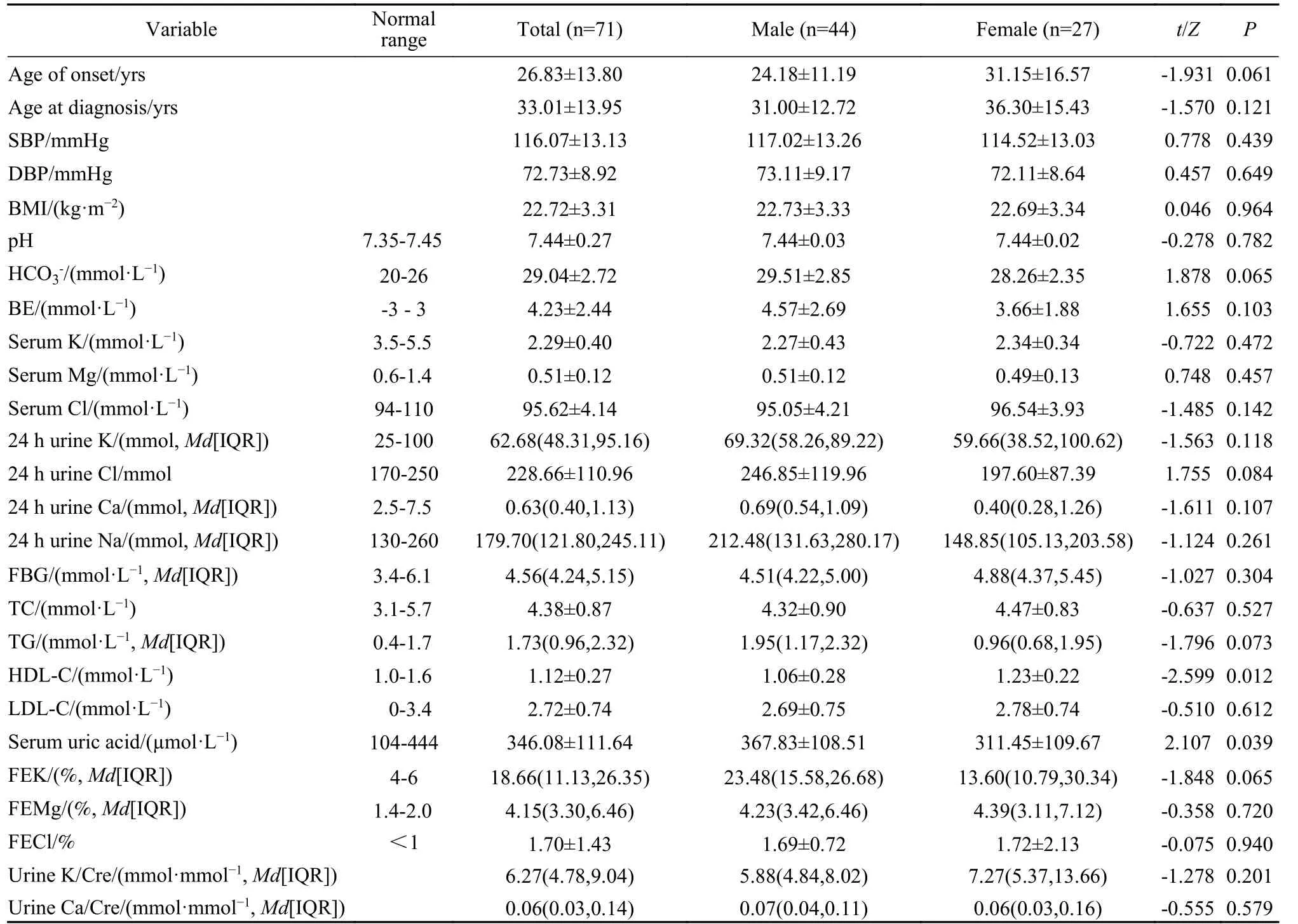
表2 不同性别的Gitelman综合征患者一般情况和化验结果差异Tab. 2 Differences in general conditions and laboratory results of Gitelman syndrome patients by different genders
3 基因型特征 71例中3例未检测到SLC12A3基因突变,1例疑似多个基因缺失,其余67例的基因突变散在分布于SLC12A3基因中。其中56例为复合杂合突变,3例为单杂合突变,8例为纯合突变。所有患者中共检测出70种不同突变类型(图1),错义突变46种,内含子突变7种,缺失插入突变6种,缺失突变5种,同义突变4种,插入突变2种,重复突变1种。11例有1种突变,48例有2种突变,5例有3种突变,3例有4种突变。p.D486N和p.T60M为本研究中最常见的突变位点,分别见于28%(20/71)和11%(8/71)的患者。本研究中共发现25种新发突变,其中错义突变9种,缺失插入突变4种,同义突变4种,内含子突变4种,缺失突变3种,插入突变1种。见表3。
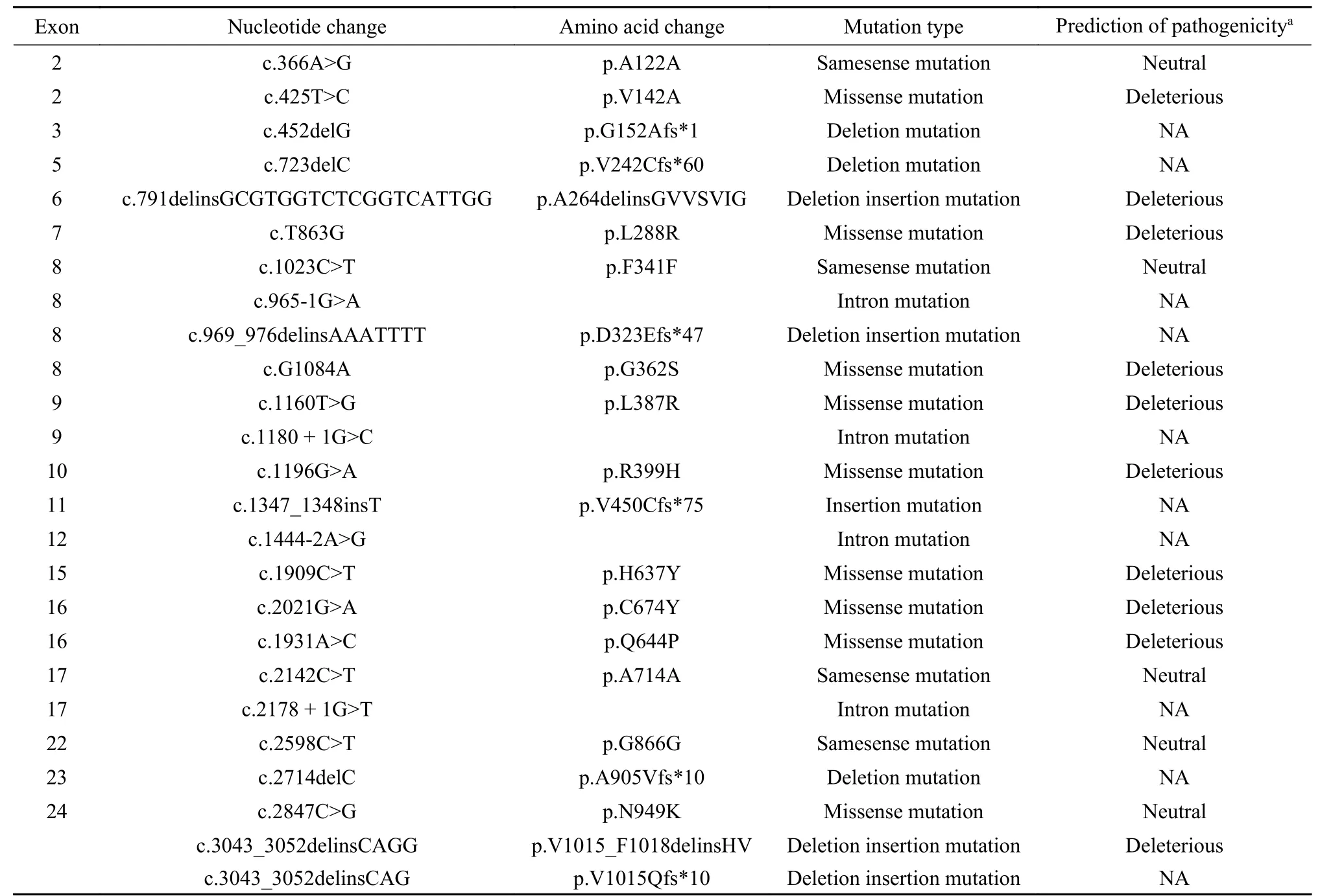
表3 SLC12A3基因新发突变位点Tab. 3 New mutation sites of SLC12A3 gene
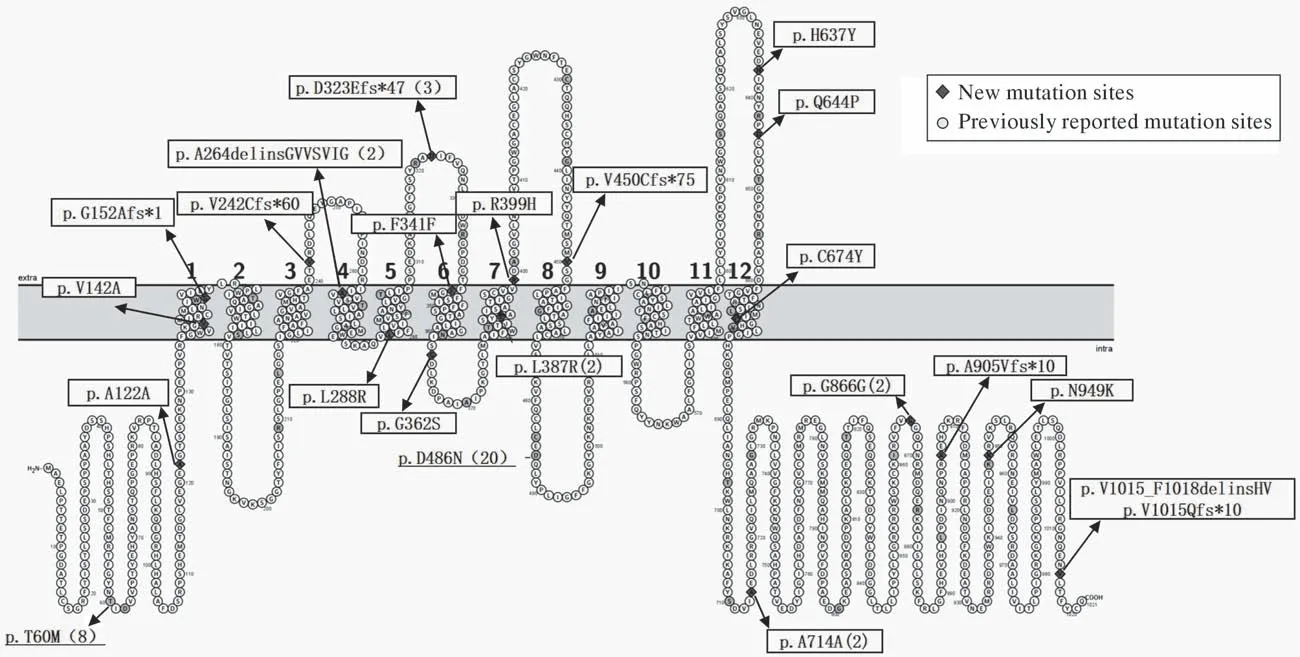
图1 本研究中SLC12A3基因突变位点分布图。本研究中共检测出70种不同突变类型,其中25种为新发突变,用方框表示,超过1人拥有该突变用括号内数字表示(不包含4个内含子突变:c.965-1G>A、c.1180 + 1G>C、c.1444-2A>G和c.2178 + 1G>T)。p.D486N、p.T60M为本研究中最常见的突变位点Fig.1 Distribution of SLC12A3 gene mutation sites in this study. A total of 70 different mutation types were detected in this study, of which 25 were new mutations, represented by boxes, with more than one person having the mutation represented by a number in parentheses(excluding 4 intron mutations: c.965-1G>A, c.1180 + 1G>C, c.1444-2A>G and c.2178 + 1G>T). p.D486N and p.T60M were the most common mutation sites in this study
4 基因型与表型的关系 将GS患者按照复合杂合突变、单杂合突变和纯合突变进行分组,三组血钾水平差异有统计学意义(P=0.049),两两比较发现纯合突变患者的血钾水平显著低于复合杂合突变患者[(1.96±0.38) mmol/Lvs(2.33±0.38) mmol/L,P=0.015],而确诊年龄、血镁、尿钙等的差异无统计学意义(表4)。将GS患者按照不同突变数目进行分组,各组年龄、pH、HCO3-、血尿电解质水平、排泄分数的差异无统计学意义。见表5。
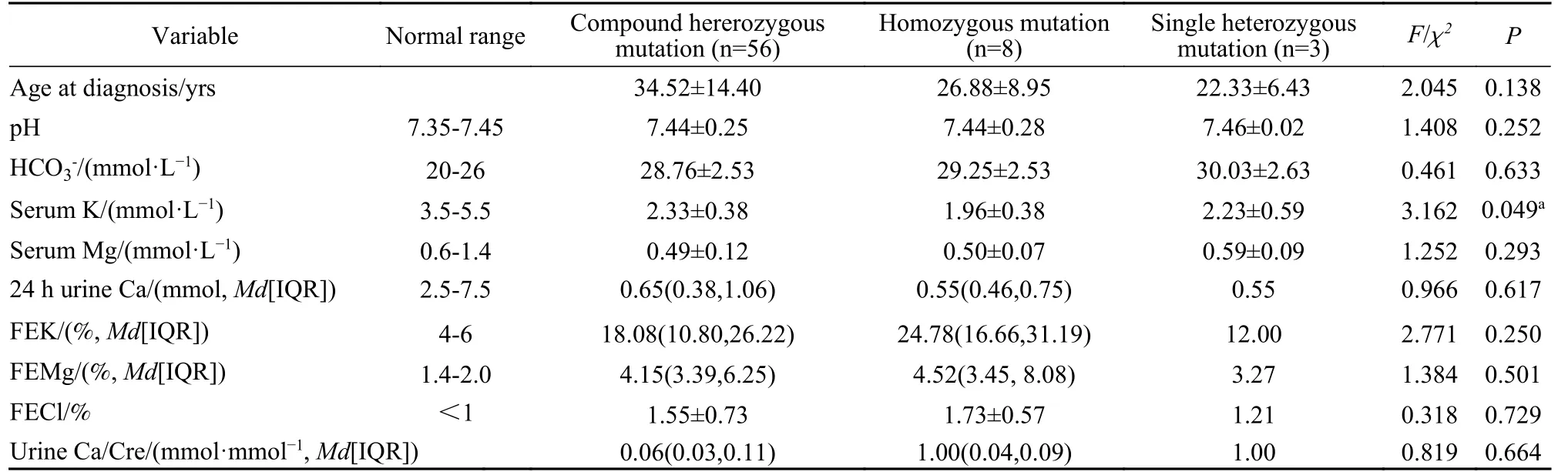
表4 不同突变类型Gitelman综合征患者临床数据差异Tab. 4 Differences in clinical data of Gitelman syndrome patients with different mutation types
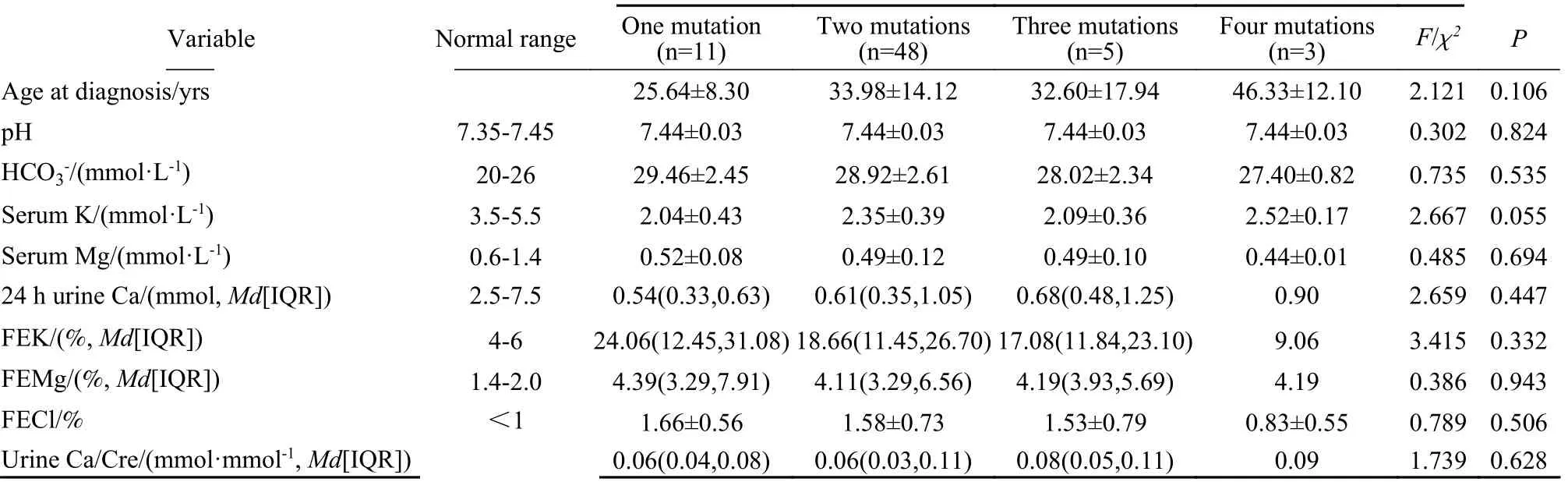
表5 不同突变数目Gitelman综合征患者临床数据差异Tab. 5 Differences in clinical data of Gitelman syndrome patients with different numbers of mutations
讨 论
GS为最常见的遗传性肾小管疾病,主要发生于青春期和成年早期,GS患者的生活质量远低于健康人群,因此对于该病的早期诊断和治疗对于GS患者预后具有非常重要的意义。本研究对71例入院患者的临床症状进行分析,其临床表现可累及多个系统,与王芬等[9]的研究相似,肢体乏力为最常见的临床症状。GS最常累及系统为神经肌肉系统,表现为肌无力、肢体麻木、肌肉抽搐等,主要与低钾血症和低镁血症相关。此外,GS还可累及心血管、消化、泌尿、骨关节系统等,出现横纹肌溶解、肾功能不全或致命的心律失常等严重症状。因此对于初次就诊的GS患者应进行系统评估并及早干预,减少不良预后事件。有研究表明,男女患者的临床表型存在异质性,男性较女性有更严重的临床表型,因为女性性激素可减轻NCCT的功能缺失[10]。但本研究中,不同性别的GS患者在血尿电解质方面的差异无统计学意义,但女性患者出现肌肉痉挛抽搐和肢体麻木症状的风险高于男性,未来需要更大样本量的研究来明确性别对于临床表型的影响。
典型的GS表现为低钾代谢性碱中毒伴低镁血症和低尿钙,主要致病机制为NCCT功能缺陷导致肾单位远曲小管重吸收NaCl障碍,并可能激活RAAS系统,从而促进了钾离子和氢离子的分泌。低镁血症的发病机制尚未完全明确,可能与肾远曲小管的主要结构重塑及远曲小管顶端膜表达的瞬时受体电位M6通道(TRPM6)下调相关[11]。在GS患者中,正常血镁患者的比例为8% ~ 22%,可以认为是GS的一种亚型[12]。本研究中16例(22.5%)患者无明显低镁血症。Jiang等[13]将7例正常血镁患者与25例低镁血症患者进行比较,正常血镁患者的TRPM6表达接近正常,其临床表现、电解质异常、代偿性碱中毒程度较轻。低尿钙可能与远曲小管中瞬时受体电位V5通道介导的钙重吸收增加有关,也可能与NCCT功能缺陷导致的成骨细胞分化和骨钙储存有关[14-15]。GS患者糖代谢异常的风险增加,主要与慢性低钾、低镁抑制胰岛素分泌并降低胰岛素敏感度以及高醛固酮导致的胰岛素抵抗相关[7]。本研究中GS患者2型糖尿病、高尿酸血症和血脂紊乱的患病率高于普通人群,纠正患者电解质紊乱是否可改善患者代谢水平仍需进一步前瞻性研究。
Simon等[16]首次证明了SLC12A3基因为GS的致病基因。但近年来研究表明,CLCNKB基因和HNF1B基因等其他致病基因突变也可能导致GS的发病[17-18]。本研究中共67例患者检测到SLC12A3基因突变,以复合杂合突变居多,其次为纯合突变,少数为单杂合突变,且纯合突变患者的血钾水平显著低于复合杂合突变患者。p.D486N和p.T60M为我国人群最常见的突变位点,与既往研究结果一致[9,19]。此外,3例患者未检测到SLC12A3基因突变,1例患者疑似多个基因缺失,表明还有其他遗传因素在GS病理过程中发挥作用。未来可进一步行全基因组测序探测SLC12A3以外致病基因的核苷酸序列变化。
综上所述,GS患者临床表现多不典型,最常累及神经肌肉系统,以低血钾、低血镁、低尿钙和RAAS系统激活为特征,部分患者血镁和尿钙水平正常。GS患者更易出现2型糖尿病、高尿酸血症、血脂异常等代谢紊乱。本研究中共检测出70种不同SLC12A3基因突变类型,其中25种为新发突变,p.D486N和p.T60M为最常见的突变类型,尚有其他遗传因素在GS病理过程中发挥作用,有待于进一步研究。
