少突胶质细胞瘤与星形胶质细胞瘤的临床特征及预后比较
2022-08-01孙彩红孔东生刘若愚赵珺燕
孙彩红,孔东生,刘若愚,刘 方,赵 恺,赵珺燕
解放军总医院第一医学中心 神经外科医学部,北京 100853
成人弥漫性胶质瘤包括星形胶质细胞瘤、少突胶质细胞瘤和胶质母细胞瘤[1]。根据2021年WHO更新的第5版中枢神经系统肿瘤分类指南,成人弥漫性胶质瘤的诊断在基于细胞形态学的传统病理基础上,加入包含基因和蛋白信息的分子病理,形成了更具临床应用价值的综合诊断[2]。WHOⅡ级的脑胶质瘤被认为预后相对较好,好发于20 ~ 60岁青中年,生存期最长可超过15年[3]。目前,少突胶质细胞瘤与星形胶质细胞瘤的分子病理、生物学特性及预后是否有差异还有待进一步研究。自2006年起,低级别胶质瘤的术后治疗一直使用Stupp方案,即放疗后接受替莫唑胺(temozolomide,TMZ)周期性化疗,可有效延长患者生存期[4-6]。然而替莫唑胺具有一些不良反应,包括骨髓抑制、呕吐反应、肝肾功能损害等。本文通过对解放军总医院第一医学中心神经外科2016年1月- 2021年6月收治的少突胶质瘤和星形细胞瘤患者进行回顾性病例对照研究,分析少突胶质瘤和星形细胞瘤的侵袭部位、分子病理结果、替莫唑胺治疗后不良反应和预后,同时比较两组患者替莫唑胺化疗不良反应发生率。
资料与方法
1 资料搜集 2016年1月- 2021年6月在解放军总医院第一医学中心治疗的WHOⅡ级胶质瘤的病例资料。纳入标准:肿瘤部位累及1个及以上脑叶,且进行了肿瘤的全切除;肿瘤病理结果为WHOⅡ级,进行了分子病理检测;术后行单纯放疗+替莫唑胺化疗方案至少3个月。排除标准:术后综合病理诊断证实为其他级别胶质瘤;术后未进行放疗或替莫唑胺化疗;术后参加临床试验,应用替莫唑胺以外的其他化疗药物或靶向药物。
2 研究方法 回顾性分析60例患者的临床资料,并进行随访,随访时间截至2021年6月30日。资料的收集主要通过门诊复查和电话随访,肿瘤的复发进展以复查患者的头颅磁共振结果为准。按照综合病理诊断结果分为星形胶质细胞瘤组和少突胶质细胞瘤组。1)比较两组患者肿瘤的发生部位和累及脑叶数量(累及1个脑叶或侵袭2个以上脑叶);2)比较两组替莫唑胺不良反应发生率的差异;3)比较两组无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。
3 统计学方法 采用SPSS20.0软件对数据进行统计分析,计量资料以±s表示,计数资料以例数和率表示。率的比较采用两独立样本χ2检验或连续校正的χ2检验。生存分析采用Kaplan-Meier生存曲线,生存期的比较采用log-rank法检验,P<0.05为差异有统计学意义。
结 果
1 两组临床资料比较 本研究共纳入WHOⅡ级胶质瘤病例60例,其中包括男性35例,女性25例;少突胶质细胞瘤37例,平均年龄(42.08±11.27)岁,星形细胞瘤23例,平均年龄(42.13±12.90)岁。两组的性别及年龄构成比差异无统计学意义。有29例少突胶质细胞瘤仅侵袭1个脑叶,有8例侵袭2个以上脑叶;同时星形细胞瘤侵袭1个脑叶的仅有10例,侵袭2个以上脑叶多达13例(表1)。从分布上来看,星形细胞瘤更易侵袭多个脑叶。
2 两组肿瘤分子病理比较 甲基鸟嘌呤甲基转移酶(MGMT)启动子甲基化导致胶质瘤细胞中MGMT基因表达降低,这被视为患者对TMZ治疗敏感的标志。MGMT启动子甲基化与接受TMZ治疗的胶质瘤患者更好的预后、更长的PFS和OS相关。本研究中有43例患者存在MGMT启动子甲基化,37例少突胶质细胞瘤患者中有多达30例(81.08%)存在MGMT启动子甲基化;同时20例星形细胞瘤患者中仅有13例(56.52%)存在MGMT启动子甲基化,两组患者MGMT启动子甲基化发生率差异有统计学意义(P=0.04)(表1)。少突胶质细胞瘤更易出现MGMT启动子甲基化,这也与其在综合治疗后表现出更好的预后相符。
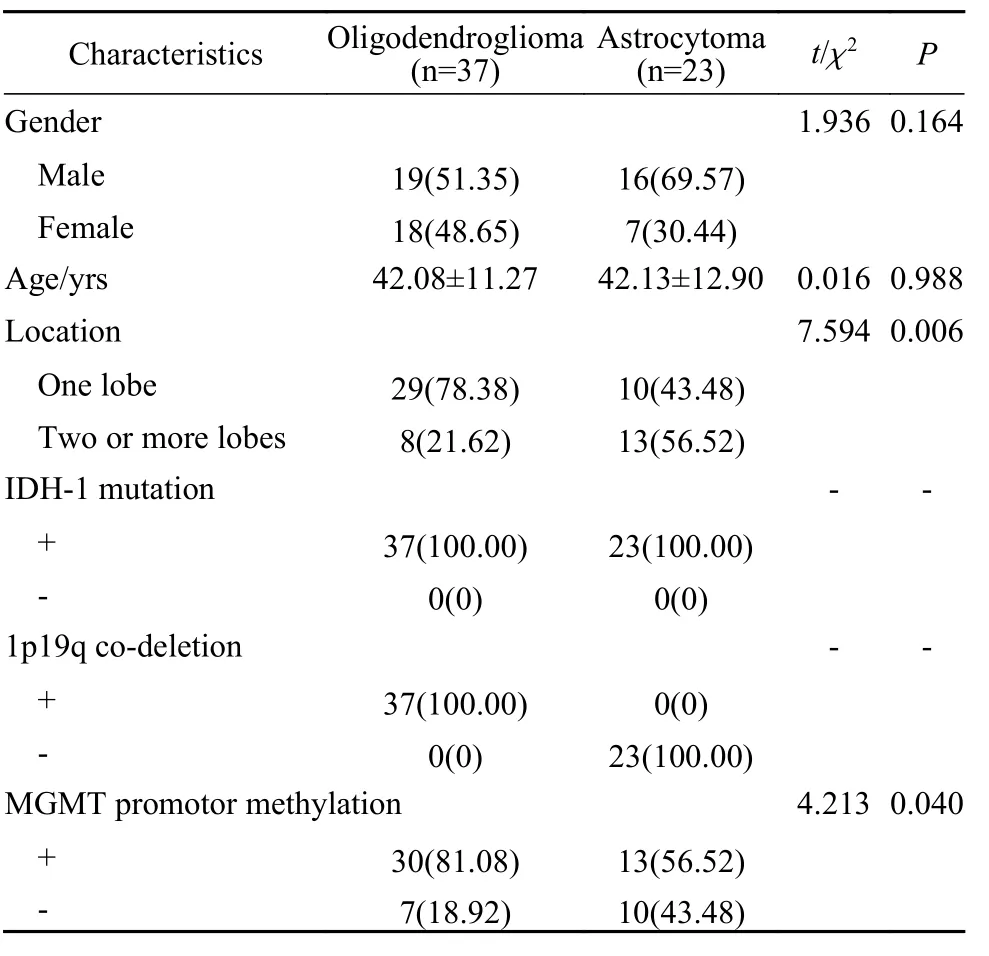
表1 两组胶质瘤患者临床特征(n, %)Tab. 1 Clinical characteristics of patients with glioma in the two groups (n, %)
3 两组TMZ治疗不良反应比较 在接受TMZ化疗后,共有41例患者表现出了不同程度的不良反应,其中以恶心呕吐表现最为明显,共18例(43.90%);性质最严重的骨髓抑制仅有7例(17.07%)。虽然少突胶质细胞瘤和星形细胞瘤具有不同的生物学特性和不同的放化疗敏感度,但本研究中未在两组患者间发现TMZ化疗后不良反应发生率的差异。少突胶质细胞瘤出现恶心呕吐12例,骨髓抑制4例,乏力6例,其他4例;星形细胞瘤出现恶心呕吐6例,骨髓抑制3例,乏力4例,其他2例。两组患者各类型不良反应比较,差异无统计学意义(表2)。少突胶质细胞瘤和星形细胞瘤患者对TMZ都有较好的耐受度,TMZ是两种胶质瘤患者安全、有效的化疗药物。
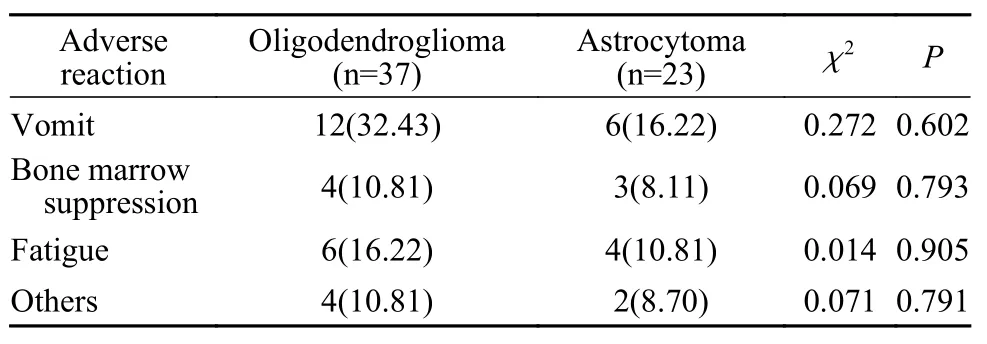
表2 两组患者替莫唑胺不良反应(n, %)Tab. 2 Adverse reactions to temozolomide in the two groups (n, %)
4 两组生存分析比较 胶质瘤作为最常见的颅内原发恶性肿瘤,PFS和OS是评价预后及治疗效果的核心指标。本研究中截至随访结束,共42例患者未到达终点。应用Cox回归模型比较两组患者生存曲线,考察不同性质肿瘤患者预后差异,我们发现少突胶质细胞瘤组相比星形细胞瘤组具有更长的PFS和OS(P=0.034、0.028)(图1),提示少突胶质细胞瘤整体预后更好。
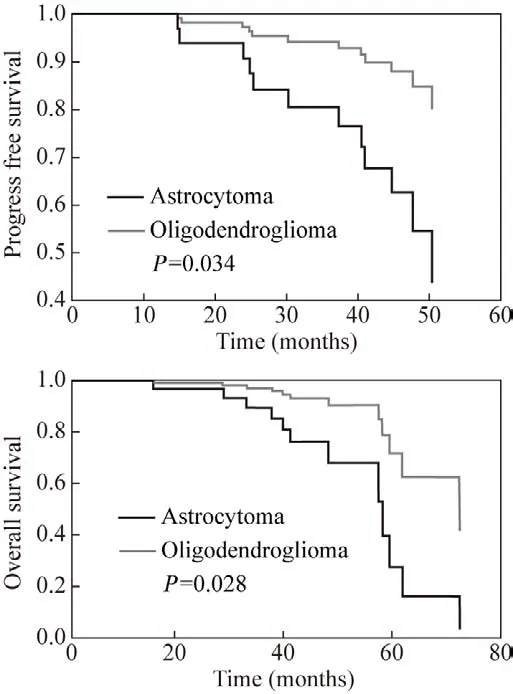
图1 两组患者PFS和OS的生存曲线比较Fig.1 Comparison of survival curves between PFS and OS in the two groups
讨 论
本研究回顾性分析比较了少突胶质细胞瘤与星形胶质细胞瘤的临床特征及预后。二者同属于低级别胶质瘤,治疗策略相似,筛选的病例都为手术全切除+术后规律放化疗的患者。有研究表明,术后的放疗和化疗会使低级别胶质瘤患者获益,延长生存期[7-9]。2016年起的WHO中枢神经系统肿瘤分型中强调了分子病理对胶质瘤诊治的意义[10-11]。2021年最新版WHO中枢神经系统肿瘤分型中更进一步明确了分子病理不可或缺的地位。本研究回顾分析少突胶质细胞瘤和星形胶质细胞瘤患者的分子病理结果,并进行统计对比找出规律。
在侵袭性方面,两组侵犯脑叶的差异无统计学意义,低级别胶质瘤多发生于额颞叶,肿瘤侵袭单一脑叶占多数,分别为78.38%和43.48%,且两组总数据中肿瘤侵犯单一脑叶占65.00%,侵犯2个以上脑叶占35.00%,说明了低级别胶质瘤好发于额叶,可能起源于额叶[12],临床预后更好。
IDH-1突变与较长的PFS有关,1p/19q的联合缺失预示着良好的生物学特性和放化疗敏感度,具有IDH-1突变及1p/19q联合缺失的胶质瘤患者具有更好的临床预后。MGMT可以有效修复DNA损伤,MGMT基因启动子甲基化可以导致基因沉默,抑制MGMT蛋白合成,阻碍DNA的修复。因此TMZ化疗导致肿瘤细胞DNA损伤,具有MGMT启动子甲基化的肿瘤修复能力更差,对化疗更为敏感[13-14]。本研究中,两组患者均有较高的MGMT启动子甲基化发生率(少突胶质细胞瘤为81.08%,星形胶质细胞瘤为56.52%),说明两组患者均对TMZ化疗较敏感,且少突胶质细胞瘤患者敏感度更高,术后化疗使患者受益更多。
在生存分析方面,少突胶质细胞瘤的PFS和OS较星形胶质细胞瘤更长(P=0.034、0.028)。结合少突胶质细胞瘤存在1p/19q联合缺失的特性,考虑1p/19q联合缺失与生存期获益相关。同时经过早期手术全切除和术后积极的放化疗,可以使少突胶质细胞瘤患者获得更大的收益和更长的生存时间,这也是目前已达成共识的低级别胶质瘤的治疗方法[15-16]。另外少突和星形胶质瘤患者术后可获得超过10年的生存期[17],论文中回顾性研究随访时间为4年6个月,相对较短,若延长随访时间,两组生存期比较将更有价值。
替莫唑胺治疗低级别胶质瘤需要长周期服用,不良反应是患者停药的重要因素,其中恶心呕吐、乏力影响最大。两组恶心呕吐、骨髓抑制、乏力以及其他不良反应发生率均较低,差异无统计学意义。说明少突胶质细胞瘤与星形胶质细胞瘤患者对TMZ的耐受程度相似。患者术后可依靠替莫唑胺进行长期化疗,改善预后。
综上所述,虽然同属于低级别胶质瘤,少突胶质细胞瘤较星形胶质细胞瘤具有更好的生物学特性和临床预后。少突胶质细胞瘤具有更高的MGMT启动子甲基化发生率,结合其1p/19q联合缺失的特性,可能是其具有更长PFS和OS的原因。少突胶质细胞瘤和星形胶质细胞瘤的MGMT启动子甲基化发生率均在50%以上,说明二者都对TMZ有较高的敏感度,且少突胶质细胞瘤敏感度更高,这也是术后TMZ化疗必要性的佐证。两组患者治疗策略目前仍以手术早期切除和术后放化疗为标准治疗方案。少突胶质细胞瘤与星形胶质细胞瘤患者TMZ不良反应总发生率差异无无统计学意义,支持替莫唑胺作为低级别胶质瘤患者的长期化疗方案。
