术中放疗和全乳照射在早期乳腺癌中肿瘤疗效的比较:一项meta分析
2022-08-01姚红军于得全邵秋菊
姚红军,何 林,于得全,胡 静,邵秋菊
(空军军医大学唐都医院放射治疗科,陕西 西安 710038)
女性乳腺癌在2020年已超过肺癌成为当年最常见的诊断癌症。在全球范围的女性中,乳腺癌在新诊断癌症发生率和癌症相关死亡率均排第一位,新增病例约225.4万例(占新增病例总体的24.5%),新增死亡约68.2万例(占癌症相关死亡总体的15.5%)[1]。不同时期乳腺癌应选择不同的治疗策略。近10年来,许多随机对照试验比较了接受术中放疗(intraoperative radiotherapy,IORT)(定义为IORT组)和接受全乳照射(whole-breast irradiation,WBI)(定义为WBI组)的早期乳腺癌患者的局部区域控制、远处转移和比值比(odds ratio,OR)的情况[2-4]。例如,一项中位随访时间为12.4年的随机对照试验(randomized controlled trial,RCT)的结果表明,IORT组的同侧乳腺肿瘤复发率比WBI组高出9%(风险比=4.62;95%CI,2.68~7.95;P< 0.000 1)[2]。然而,由于不同临床研究中人口学、组织病理学和系统性治疗模式的多样性,目前报道的组间肿瘤疗效的比较并不一致。在此背景下,本研究的目的是通过meta分析的方法为组间肿瘤疗效的比较提供循证医学的证据。
1 材料与方法
1.1 材料
2021年8月1日,我们对收录在PubMed、Web of Science、万方、知网和维普五个数据库中的引文进行了计算机化的检索,不限定发表语言和发表日期。英文数据库的检索式如下:((early OR (early-stage)) AND breast AND (cancer OR tumor OR tumour OR carcinoma)) AND ((intraoperative OR intra-operative) AND (radiotherapy OR irradiation)) AND ((whole-breast) AND (radiotherapy OR irradiation OR (radiation therapy))) AND ((breast conserving surgery) OR (breast conservation surgery) OR (breast preserving surgery) OR (breast preservation surgery)) AND ((local recurrence) OR (local relapse) OR (distant metastasis) OR (overall survival));中文数据库的检索式为:IORT AND (全乳放疗 OR WBI)AND 早期乳腺癌 AND 保乳手术。
本篇meta分析严格遵照“系统综述和荟萃分析的首选报告项目”(the Preferred Reporting Items for Systematic Reviews and Meta-Analyses,PRISMA)指南[5-6]。研究设计不需要伦理或机构审查委员会的批准。
1.2 方法
1.2.1 纳入和排除标准 比较了符合我们纳入标准的IORT组和WBI组的肿瘤疗效的临床文章。这些研究需要满足以下条件:①人群——早期乳腺癌患者;②治疗策略——保乳手术联合IORT或WBI;③研究终点——局部无复发生存期(local relapse-free survival,LRFS)、无远处转移生存期(distant metastasis-free survival,DMFS)和/或总生存期(overall survival,OS)。而出现以下任一条件的引文则须被剔除:①文章类型——综述、个案报道、涉及少于10名患者的病例系列报道、社论、信件、评论和会议性论文;②人群——男性患者和在保乳手术之前接受新辅助治疗的女性患者;③重叠的研究群体。
1.2.2 数据提取和质量评估 我们使用标准化表格从纳入的研究中提取了以下数据:①研究的特征——第一作者的姓氏、发表年份、患者招募时间、来源国家、研究类型、患者数量和中位随访时间;②人口学特征——平均年龄、分子亚型、肿瘤大小、淋巴结状态和肿瘤分级;③结果的特征——IORT组和WBI组总样本量以及LRFS、DMFS和OS的事件数。LRFS的定义是从诊断开始到肿瘤在手术切除部位再次出现的时间;DMFS的定义是从诊断开始到远处器官和/或组织出现肿瘤复发的时间;OS的定义是从诊断开始到末次随访时间或死亡时间。纳入研究的质量评估通过Review Manager 5.4(https://training.cochrane.org/online-learning/core-software-cochrane- reviews/revman.)绘制偏倚风险总结图和偏倚风险图来判断。文献检索、研究筛查和数据提取由两位审查员单独进行,如果有任何不一致之处,两人将通过讨论加以解决。
1.2.3 数据整合和统计学分析 组间肿瘤疗效的比较通过OR及其95%CI来表示。如果研究中没有提供具体的事件数,则根据终点百分比或其他相关信息来计算。纳入研究结果可变性程度的异质性通过Cochran’sQ检验和HigginsI2统计检验来评价[7];P< 0.10表明存在显著的异质性,I2值在0~25%、26%~50%、51%~75%和76%~100%的不同截断区间分别对应于无显著、中等、显著和非常强的异质性。当异质性检验无统计学意义(P≥0.10)时,使用二分类固定效应模型的Mantel-Haenszel法合并结果;若具有统计学意义,则用二分类随机效应模型Dersimonian-Laird法[8]。发表偏倚通过Egger’s检验和绘制漏斗图来评价,显著性水平为P<0.05。所有统计学运算均使用软件Open Meta-Analyst(http://www.cebm.brown.edu/openmeta/download.html.)来分析。
2 结果
2.1 文献检索
文献筛选的PRISMA流程见图1。具体而言,我们一共从5个数据库中检索到了616篇引文,其中因引文重复、综述、题目不符和摘要不符共删除了582篇。我们对剩余的34篇引文进行了全文精读,其中12篇因将IORT仅作为术中瘤床加量、8篇未报道预后以及1篇为综述而被剔除,最终剩余13篇研究(共计13 380个患者)[2-4, 9-18]纳入了本项meta分析。

IORT:术中放疗;PRISMA:系统综述和荟萃分析的 首选报告项目。图1 PRISMA流程图
2.2 纳入meta分析的研究特征
表1和表2分别显示了“文献水平”和“患者水平”纳入研究的基本特征。具体而言,7篇为回顾性研究,6篇为RCT;出版年份从2010年至2021年(中位数:2019年);根据研究中提供的可用源数据,患者的平均年龄为58.8(46.0~63.0)岁,研究中位随访的中位数为5.2(2.7~12.4)年。中国居于所有研究来源国家的第一位(n=4)。9篇研究同时评估了乳腺癌的分子分型和肿瘤大小,其中Luminal乳腺癌百分比的中位数为90.8%(46.9%~98.1%),T1肿瘤百分比的中位数为85.5%(67.5%~94.7%);8篇研究评估了淋巴结状态,N0肿瘤百分比的中位数为81.8%(73.5%~96.5%);10篇研究评估了肿瘤分级,G1期肿瘤百分比的中位数为25.1%(10.2%~34.5%)。另外,表1还提供了所有研究的两组患者的总样本量、局部复发、远处转移和死亡的具体事件数。

表1 “文献水平”纳入研究的基本特征

表2 “患者水平”纳入研究的基本特征 [n(%)]
2.3 Meta分析
10项研究共计8 539名患者纳入了比较组间LRFS的差异[3, 4, 9-11, 13-16, 18],汇总的结果表明,LRFS在IORT组明显低于WBI组(OR=2.36;95%CI,1.66~3.35;图2A)。同时,有8项研究[2-4, 11, 13-14, 17-18]和10项研究[2-4, 10-15, 18]分别比较组间DMFS和组间OS的差异;汇总的结果表明,IORT组和WBI组的DMFS(OR=0.99;95%CI,0.76~1.29;图2B)和OS(OR=0.95;95%CI,0.79~1.14;图2C)均无明显的统计学差异。

A:局部无复发生存期;B:无远处转移生存期;C:总生存期。IORT:术中放疗组;WBI:全乳照射组。图2 比较两组患者肿瘤疗效的森林图
2.4 偏倚风险评价
我们将纳入的13项研究汇总在一起评价偏倚风险,并绘制了偏倚风险总结图和偏倚风险图(图3)。总体而言,所有的临床试验在分配隐藏、对研究者和受试者施盲以及研究结局的盲法评价方面都显示出了偏倚高风险(100%),而在随机序列产生方面的偏倚高风险率<50%,结局数据的完整性和选择性报告研究结果方面的偏倚高风险率均<25%。

A:偏倚风险总结图;B:偏倚风险图。绿色代表低偏倚风险;黄色代表未知偏倚风险;红色代表高偏倚风险。图3 偏倚风险评价
2.5 发表偏倚评价
如图4所示,比较组间LRFS、DMFS和OS差异的研究都均匀地分布在各自漏斗图中轴的左右两侧,对应的P值分别为0.53、0.74和0.50。这些结果共同表明,IORT和WBI在早期乳腺癌中的疗效比较,对其研究论文meta分析不存在偏倚现象。
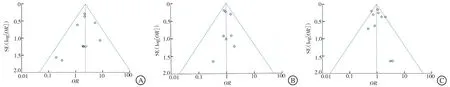
A:局部无复发生存期(P=0.53);B:无远处转移生存期(P=0.74);C:总生存期(P=0.50)。图4 发表偏倚评价
3 讨论
接受保乳手术的早期乳腺癌患者是选择IORT还是WBI才能取得更好的肿瘤治疗效果目前尚无定论。我们meta分析的结果证实了两种放疗技术所取得的DMFS和OS并无明显的差异,而IORT组的LRFS劣于WBI组的LRFS。VAIDYA等[16]研究发现,两组出现任何并发症的总体发生率(IORT组vsWBI组:17.6%vs15.5%;P=0.19)和主要毒性的发生率(IORT组vsWBI组:3.3%vs3.9%;P=0.44)也近乎相等。尽管如此,IORT在早期乳腺癌患者(甚至有局部复发高危因素的患者)中仍然比WBI更受欢迎,我们认为主要有以下原因:①部分患者接受WBI后会出现乳房萎缩、受照射乳房畸形、色素沉着和皮肤粗糙等困扰[3];②IORT会改善患者的生活质量(如乳房外观和乳房疼痛)和更好地节约医疗资源[19-20],比如在英国,IORT的应用每年大约节省了1 500万英镑[21]。基于SEER数据库的一项分析发现,2010—2013年,IORT治疗早期乳腺癌在美国的普及率提高了10倍左右[12]。
在为早期乳腺癌患者做具体治疗计划之前,我们应该关注她们可能达到的LRFS预后。我们研究证实的IORT组劣势的LRFS与一篇中位随访6年的回顾性观察研究的结论相一致[10],而与TARGIT-A三期RCT的结论略有不同(该RCT仅显示出了统计学上的差异趋势)[11]。这两项临床研究人口统计学上在Luminal乳腺癌、T1肿瘤、N0肿瘤和HER2阴性肿瘤的比例方面组间分布非常均衡。不同的是,回顾性研究的两组以G2级肿瘤为主(IORT组为74.9%,WBI组为75.7%),而TARGIT-A RCT的两组以G1级肿瘤为主(IORT组为56.5%,WBI组为63.8%)。另外,回顾性研究中用到的WBI事实上是大分割放疗模式,而TARGIT-A RCT的IORT组患者若出现任何可疑高风险因素,则IORT仅作为瘤床区加量。因此,我们认为肿瘤分级和放疗模式的差异可能会干扰患者的LRFS。鉴于所有研究之间不存在异质性(I2= 0%;P=0.46;图2A),本项meta分析充分证实了接受IORT的早期乳腺癌患者的LRFS明显劣于接受WBI的患者的LRFS。
有充足的临床证据表明IORT组较差的LRFS并不会影响该组患者的DMFS、肿瘤特异性生存期和OS[2, 12, 14, 22]。本篇meta分析的结果与这些数据相一致,即组间DMFS和组间OS均无明显差异。尽管如此,由治疗选择不当而导致的局部控制失败本身对患者造成了不必要损害,也对医疗资源造成了额外的经济负担。因此,在实施IORT之前,需要确定哪些患者属于接受治疗后出现局部复发的高风险组和极低风险组。对于高风险组的患者,应该选择WBI或IORT后再进行WBI。VERONESI等[14]认为具有以下任一特征的患者应该被确立为高风险组,包括:肿瘤大小> 2 cm、G3级肿瘤、阳性淋巴结数目≥ 4以及三阴性乳腺癌。长期ELIOT三期等效性RCT[2]的一项计划外分析为极低风险组制定了一个标准:分化良好的Luminal A乳腺癌,肿瘤增殖分数(Ki-67)<14%,且肿瘤大小<1 cm。这类患者在IORT组和WBI组的5年、10年和15年的同侧乳腺肿瘤复发率都非常低,且组间没有显著差异(风险比= 1.97;95%CI,0.36~10.8;P= 0.45)。然而,高风险组和极低风险组标准的确立尚须在多个独立数据集中进行验证才能被引入到临床指南和共识当中。
本研究还存在一些局限性:其一,超过一半的纳入研究(n=7)都是回顾性研究,这可能表明存在由于数据收集和受试者选择而引起的其他偏倚;其二,由于数据有限,我们没有按照高风险组或极低风险组进行亚组分析;其三,我们的研究没有分析两组间的长期毒性。
综上所述,对于早期乳腺癌患者而言,IORT组的LRFS明显低于WBI组的LRFS,而两组之间的DMFS和OS均无显著差异。
