CEACAM6高表达在胃癌患者中的潜在临床价值
2022-08-01李建棣杨丽桦何融泉赖倩瑶陈思智陈传良李建军陈祖轩
李建棣,杨丽桦,何融泉,赖倩瑶,陈思智,陈传良,李建军,陈祖轩
2020年全球癌症统计资料显示,胃癌(GC)死亡率与发病率分别位列第四和第五[1],已成为人类健康的主要威胁之一。胃癌的治疗手段主要包括手术、放疗以及化疗等,免疫治疗、分子靶向治疗和新辅助放化疗联合治疗方案也使得部分患者获益[2-4]。但胃癌起病隐匿,许多患者确诊时已进入晚期并伴有广泛转移,其临床管理仍不容乐观[5]。因此,为推动胃癌早期诊断和靶向治疗的发展,进一步探索胃癌发生发展的分子机制并寻找更为有效的诊断标志物和分子靶点势在必行[6]。
CEACAM6(CEA cell adhesion molecule 6)与多种癌症的发生和进展均密切相关。有研究指出,CEACAM6可通过激活相关蛋白调节基因,增强细胞转录功能,从而促进肿瘤的发生与发展[7]。Königer等人[8]研究发现,幽门螺杆菌可通过HopQCEACAM相互作用实现细胞毒素相关抗原A转移,由此促进胃腺癌发生发展。Zang等[9]针对CEACAM6过表达对胃癌细胞中Akt磷酸化水平的影响进行了研究,推测CEACAM6可以通过激活胃癌PI3K/Akt信号通路诱导上皮间质转化,并促进胃癌进展。同时,Zang团队[10]还研究发现CEACAM6也可能通过促进FAK磷酸化来促使胃癌细胞增殖和转移。不仅如此,CEACAM6还有助于癌症患者的预后评估。譬如,Maraqa、Kobayashi等人[11,12]就分别证实了CEACAM6高表达与乳腺癌、肺腺癌患者的不良预后显著相关,这也为CEACAM6作为癌症复发预测指标应用于胃癌等其他恶性肿瘤的预后评估提供了更多可能性。更为重要的是,CEACAM6有望成为癌症的潜在治疗靶点。Pandey团队[13]发现CEACAM6敲除可通过改变免疫环境、胰腺导管腺癌线粒体功能等途径抑制肿瘤生长,由此设想CEACAM6可作为癌症的新型治疗靶标。然而,CEACAM6在胃癌进展中饰演的角色错综复杂,迄今为止,其分子机制尚未明了。
因此,本研究旨在探索CEACAM6在全球1531例胃腺癌组织样本的表达水平,初步评估CEACAM6表达的潜在临床价值,并分析其共表达基因在胃癌中的潜在分子机制,为推动胃癌发病机制的研究及精准防治提供新思路。
1 材料与方法
1.1 CEACAM6在胃癌中的mRNA表达水平与潜在临床价值
1.1.1 胃癌中CEACAM6 mRNA表达数据与蛋白表达数据准备 基于GEO、TCGA生物医学公共数据库对2021年3月1日前提交的胃癌基因芯片和高通量测序数据进行检索,其关键词如下:“(stomach OR gastric)AND(cancer OR carcinoma OR tumor OR neoplasm*OR malignan*)”。纳入标准:①标本须为人体组织,而非细胞系;②数据集应同时包含胃癌和癌旁组织或正常胃组织,且样品总数不少于3;③患者术前未接受化疗、放疗等任何辅助治疗。从Xena下载TCGA胃癌测序数据并进行log2转换。通过The Human Protein Atlas了解CEACAM6蛋白表达水平。
1.1.2 胃癌中CEACAM6表达与临床参数的关系从Xena中获取TCGA胃癌测序数据匹配的临床病理资料(如年龄、分期、肿瘤分化程度、肿瘤有无转移等)并根据相应的临床参数将患者分为不同组别。应用两独立样本t检验评估CEACAM6 mRNA在不同临床病理参数特征胃癌人群中的表达情况。
1.1.3 CEACAM6在胃癌中的预后价值 以CEACAM6中位表达值为界将TCGA胃癌患者分为CEACAM6高表达组与CEACAM6低表达组,绘制KM曲线与timeROC曲线以判断CEACAM6表达高低程度对患者预后的影响。
1.2 CEACAM6在胃癌中的生物学功能与潜在分子机制
1.2.1 胃癌差异表达基因与CEACAM6相关基因的鉴定 基于纳入的基因芯片与高通量测序数据,用limma-voom程序包计算获取胃癌差异表达基因(DEG),其满足|log2FoldChange|>3且P.adjusted<0.05。根据其中位表达值将胃癌患者分为CEACAM6高表达组和CEACAM6低表达组,应用DESeq2和tidyverse程序包计算获取差异表达的CEACAM6相关基因,满足|log2FoldChange|>1且P.adjusted<0.05。
1.2.2 基因富集分析与蛋白相互作用分析 应用ClusterProfiler程序包对胃癌差异表达CEACAM6相关基因进行功能富集分析。进而选取富集的前10条KEGG通路构建蛋白质-蛋白质交互作用(PPI)网络,并利用Cytoscape的CytoHubba插件鉴定PPI网络中的枢纽基因。
1.3 胃癌CEACAM6及其相关枢纽基因初步验证和遗传改变
基于TCGA胃癌测序数据,采用Pearson检验分析枢纽基因与CEACAM6之间的表达相关性,并利用ROCR程序包绘制ROC曲线以评估CEACAM6相关枢纽基因区分胃癌组织和正常组织的特异性及敏感性。应用GEPIA验证枢纽基因在胃癌中的表达水平及其对胃癌患者预后的影响。
基于cBioPortal TCGA胃腺癌(TCGA,Firehose Legacy)(http://cBioportal.org)数据,研究胃癌患者CEACAM6和枢纽基因的突变类型。
1.4 统计学分析
为评价CEACAM6在胃癌和正常样品中的表达差异情况,首先运用Graphpad Prism v8.0绘制小提琴图,比较两组间基因表达量的差异。进而以SPSS v23.0对纳入的数据集进行两独立样本t检验,计算CEACAM6 mRNA表达的例数、平均值和标准差,最后汇总为标准化平均差(SMD)。通过绘制受试者工作特征(ROC)曲线与sROC曲线,评估CEACAM6甄别胃癌患者的潜在临床价值。
2 结果
2.1 全球胃癌基因芯片及高通量测序数据纳入情况
本研究最终从GEO与TCGA数据库纳入了24个含有CEACAM6表达值的胃癌数据集(表1)。所纳入的数据集包含了来自阿根廷、韩国、罗马尼亚、美国、日本、新加坡、雅典、意大利和中国这9个国家的1531例胃癌组织样本及686例正常胃组织样本。
2.2 CEACAM6 mRNA在胃癌组织中呈显著高表达
CEACAM6 mRNA表达水平的小提琴图结果显示,CEACAM6在全球胃癌数据中呈现高表达趋势(图1)。单个ROC曲线图提示CEACAM6 mRNA表达对胃癌及正常胃组织的鉴别能力为中等水平(图2,表2)。

表2 CEACAM6对胃癌潜在鉴别价值的评估

图1 基于全球基因芯片及测序数据呈现CEACAM6 mRNA在胃癌组织中的高表达水平
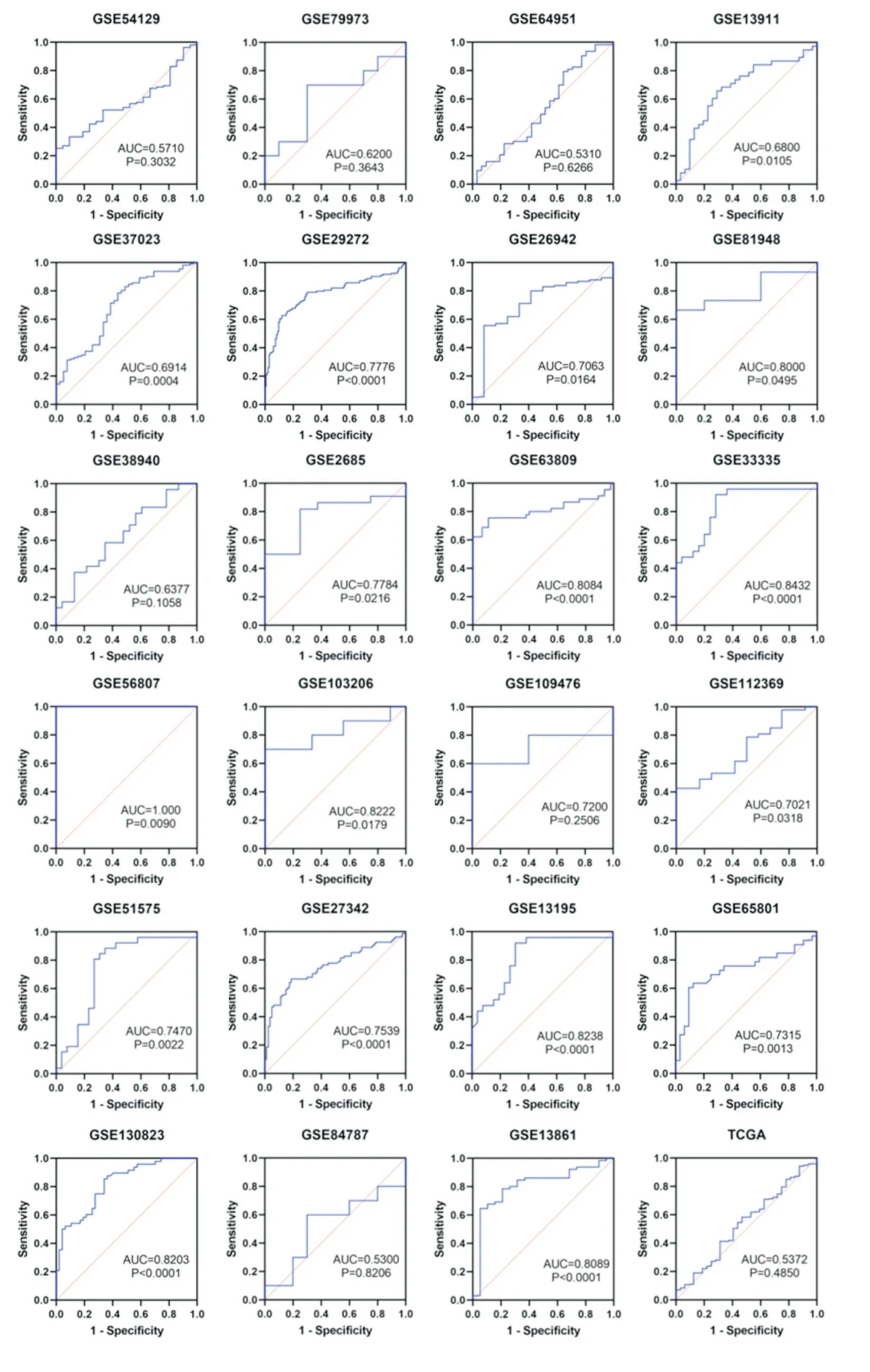
图2 全球基因芯片及测序数据集中CEACAM6 mRNA表达对胃癌及正常胃组织的鉴别能力
更进一步地,表达值标准化平均差整合分析结果表明,与正常胃组织相比,CEACAM6 mRNA在胃癌中被显著上调[SMD=0.72(0.47~0.97)](图3A);且CEACAM6表达值对胃癌与正常胃组织具有中等区分度[AUC=0.82(0.78~0.85);敏感性=0.69(0.61~0.76);特异性=0.82(0.73~0.88)](图3B)。因此,CEACAM6 mRNA在胃癌中被显著上调并且对胃癌有中度区分能力。

图3 全球基因芯片及测序数据集整合分析提示高表达的CEACAM6对胃癌具有中等区分能力 A:与正常胃组织相比,CEACAM6 mRNA在胃癌中显著上调;B:CEACAM6表达值对胃癌与正常胃具有中等区分度
2.3 基于The Human Protein Atlas数据库挖掘CEACAM6蛋白表达水平
为从蛋白水平验证CEACAM6在胃癌中的表达状况,本研究基于The Human Protein Atlas数据库对其蛋白表达水平进行了比较。免疫组化染色结果显示(图4A~D),CEACAM6在胃腺癌组织中的表达明显增强,且其阳性信号主要定位在细胞质与细胞膜,并出现了细胞膜线性阳性反应与细胞质阳性反应。

图4 CEACAM6蛋白在胃癌组织中呈高表达 A、B:正常胃腺组织,患者编号:2411;腺细胞,染色:中等,强度:强,数量:<25%,位置:细胞质/膜。镜下所见:细胞呈柱状,排列规则整齐,胞膜光滑完整,胞质染色较浅呈透明状,胞核浅染呈淡蓝色,内有深蓝色颗粒物,卵圆形胞核靠近基底部,细胞间连接紧密,胃小凹之间有微小的绒毛状突起。C、D:胃腺癌组织,患者编号:2557;肿瘤细胞,染色:高,强度:强,数量:>75%,位置:细胞质/膜状。镜下所见:细胞形态不规则,异型性明显,细胞间间隙缩小,出现了细胞聚集,细胞深染,部分细胞胞核不明显,腺体结构消失,部分细胞坏死脱落。抗体:CAB008370;AC:低倍,B、D:高倍。数据来源:The Human Protein Atlas
2.4 CEACAM6表达与胃癌患者临床参数的关系
鉴于CEACAM6在胃癌组织中被上调,本研究进一步探究了CEACAM6与胃癌患者临床病理参数的潜在联系。统计结果表明,CEACAM6在胃癌组织中的表达水平较正常胃组织明显升高(P<0.05),且CEACAM6的表达在不同胃癌组织分级中有差异(P<0.05)(G1:8.603±1.314vs.G3:5.929±2.710,组内多重比较P=0.008),但在不同分期及年龄中表达则无明显差异(P≥0.05)(表3)。但timeROC曲线及K-M曲线结果皆提示CEACAM6表达程度对胃癌患者的预后无显著影响。

表3 CEACAM6的表达与胃腺癌患者临床病理参数的关系
2.5 CEACAM6共表达基因富集与通路分析
本研究共获取胃癌差异表达的CEACAM6共表达基因550个,通过GO富集分析发现其主要参与了“肌肉系统过程”“中间丝细胞骨架”“金属离子跨膜转运活性”等生物学过程、细胞组分和分子功能。KEGG通路分析发现,CEACAM6及其共表达基因主要聚集在“胰腺分泌”“神经活性配体-受体相互作用”等通路上(图5)。

图5 CEACAM6相关基因功能富集分析 A:GO富集分析生物学过程气泡图;B:GO富集分析细胞组分气泡图;C:GO富集分析分子功能气泡图;D:京都基因与基因组百科全书富集分析通路气泡图

表1全球胃癌基因芯片及TCGA测序数据集中CEACAM6 mRNA的表达情况
2.6 CEACAM6共表达基因编码蛋白相互作用分析
为进一步探究CEACAM6共表达基因在胃癌中的潜在机制,本研究构建差异表达的CEACAM6相关基因PPI网络(图6A),其中SPRR1B、SPRR1A等蛋白与其他多个节点间存在相互作用(图6B),因此,我们可初步认为这些节点在CEACAM6 PPI网络图中处于核心地位。通过运用GEPIA2对CEACAM6前10个枢纽共表达基因进行验证并做Pearson相关性分析,只有在胃癌中差异表达并且与CEACAM6存在正相关关系的基因才最终被确认为CEACAM6在胃癌中的共表达基因,结果显示仅SPRR3满足以上条件(图6C,图6D)。本研究还探索了SPRR3表达水平对胃癌患者预后的影响,然而其结果无统计学意义,故未展示,这提示SPRR3表达程度可能与胃癌的预后无关。
2.7 CEACAM6和SPRR3在胃癌中的遗传改变
体细胞突变分析结果显示,CEACAM6与其相关枢纽基因SPRR3的主要突变类型均为扩增突变(图6E),且各自突变率相仿(分别为2.7%、3%)。有趣的是,CEACAM6与SPRR3突变呈现明显互斥性。

图6 CEACAM6共表达基因网络枢纽基因的鉴定 A:CEACAM6共表达基因蛋白交互网络的构建;B:CEACAM6共表达基因蛋白交互网络中的前10个枢纽基因(从红色至黄色:评分由高到低);C:CEACAM6与SPRR3枢纽基因表达水平呈显著正相关;D:基于基因表达谱交互分析(GEPIA)数据库,SPRR3枢纽基因在TCGA胃腺癌中的表达被显著下调;E:扩增突变为CEACAM6及其SPRR3枢纽基因最常见的突变类型,CEACAM6与SPRR3突变表现出明显互斥性
3 讨论
CEACAM6是一种细胞黏附分子,其参与正常组织结构和细胞极性的形成与维持。CEACAM6表达异常不仅可抑制细胞分化和细胞极化,还可引起组织结构的破坏。CEACAM6过表达可通过改变细胞间黏附性而参与肿瘤的侵袭和发展,这成为一些侵袭性肿瘤细胞的获得性优势之一[14]。不受调控的CEACAM6过表达与肿瘤的多种特征相关,包括不受控制地增殖、无菌斑抗性、新生血管生成、免疫逃避、肿瘤侵袭和转移等[15]。虽然已有部分研究报道了CEACAM6可参与多种恶性肿瘤的发生发展,但其确切的分子机制迄今为止仍未能完全阐明。在本研究中,为验证CEACAM6在胃癌组织中的表达水平及其潜在的临床应用价值,作者利用全球胃癌数据集对CEACAM6的表达情况、甄别能力进行了整合分析,并进一步探究了CEACAM6在胃癌中的潜在共表达机制。
CEACAM6在胃癌中被显著上调。作为一项多中心研究,本研究总共纳入了来自9个不同的国家的1531例胃癌组织样本及686例正常胃组织样本,从而更有说服力地印证了CEACAM6在mRNA水平的高表达趋势。此外,CEACAM6在胃癌患者中的潜在临床价值也被充分挖掘,本研究提示CEACAM6有一定潜力作为鉴定胃癌组织和正常组织的分子指标。
在本研究中,作者初步探索了CEACAM6在胃癌中的可能作用机制。通过GO富集分析发现,CEACAM6与其共表达基因主要参与“肌肉系统过程”“中间丝细胞骨架”“金属离子跨膜转运活性”等生物学过程、细胞成分和分子功能,这表明CEACAM6可能与其共表达基因相互作用,共同参与胃癌细胞骨架和金属离子跨膜转运活性的调控。Hong等[16]人曾指出,异常高表达的microRNA-550a可通过调节肌肉系统过程参与食管癌的发生发展[16]。此外,Qiu等[17]人通过研究肌球蛋白轻链9(myosin light chain 9,MYL9)和钙联蛋白1(calponin,CNN1)与大肠癌复发的关系,发现MYL9和CNN1在“肌肉系统过程”和“细胞骨架蛋白结合”中富集,且其高表达与大肠癌的不良预后密切相关。以上研究均提示“肌肉系统过程”可能与多种癌症的发生发展有关。因此,我们通过GO分析发现胃癌中CEACAM6及其共表达基因主要参与了肌肉系统过程,这有可能进一步支持了CEACAM6与胃癌发生发展相关的假设。
本研究还对CEACAM6共表达枢纽基因进行探究,并发现角质蛋白β抗体(small proline rich protein 3,SPRR3)可能是CEACAM6的共表达基因。SPRR3是表皮分化复合体的成员,定位于线粒体,并与Bcl2相互作用,SPRR3的增强表达可使癌细胞对线粒体外膜电位(Momp)丧失敏感性,从而导致DNA损伤诱导的凋亡[18]。与SPRR3相似,CEACAM6可使MOMP降低的同时增加一种名叫palladin的肌动蛋白结合蛋白的表达,由此介导肿瘤相关成纤维细胞(CAF)的分化[13]。以上研究提示,CEACAM6与SPRR3在癌症中可能起到协同促癌作用。更有趣的是,作者通过在线分析发现,SPRR3与CEACAM6在胃癌中的遗传变异率均相近,并且存在明显的突变互斥性,这进一步提示二者之间可能存在功能协同或是补充关系。然而,以上假说有待进一步论证。
总之,CEACAM6在胃癌中显著高表达,其可能作为促癌基因推动胃癌的发生发展。然而,本研究仅通过计算病理学方法对CEACAM6的分子机制展开了初步分析,更多机理有待实验进一步佐证。
