中国IgA肾病成人疾病负担
2022-07-30杜夕雯肖敦明敖超群张岩磊宣建伟
杜夕雯 肖敦明 敖超群 张岩磊 宣建伟
IgA 肾病是肾脏组织系膜区以IgA 或IgA 为主的免疫球蛋白弥漫性沉积为特点的原发性肾小球肾炎(primary glomerulonephritis,PGN)。全球范围内,约1/3 的PGN 被确诊为IgA 肾病,且亚洲地区占比更高[1]。IgA 肾病临床表现异质性较强,轻者表现为单纯性血尿,重者可表现为急进性肾小球肾炎和肾衰竭,最终进展至终末期肾病(end-stage renal disease,ESRD)[2]。流行病学数据证明肾活检时肾小球滤过率估计值(estimated glomerular filtration rate,eGFR)低、高血压、高蛋白尿、低蛋白血症、高尿酸血症及高脂血症均为IgA 肾病患者病情进展的独立危险因素[3-4]。
目前,IgA 肾病的发病机制仍未明确,给临床用药带来了局限。改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)推荐IgA肾病的治疗目前应以使用肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)抑制剂为基础的支持性治疗为主,后添加糖皮质激素类或免疫抑制剂等药物治疗[5-6]。但由于IgA 肾病目前仍缺少特异性治疗方案,确诊后患者的临床管理和病情控制仍存在困难。
IgA 肾病患者发病后进展至ESRD 患者数量不容忽视,病情进展后,患者通常需要接受透析或肾脏移植等治疗,进而给患者带来更为沉重的经济负担和死亡风险。此外,即使通过透析维持生命,ESRD患者死亡风险是一般人群的6~8 倍,可导致严重的生产力损失和疾病负担[7]。因此,IgA 肾病患者的及时治疗,定期随访,以及避免疾病复发及进展对病情管理至关重要。
目前,针对IgA 肾病中国患者的研究相对较少,本研究的目的是通过检索10年间国内外公开发表的关于中国IgA 肾病流行病学、疾病负担、生命质量以及临床治疗的文献,全面收集关于IgA 肾病的疾病信息和研究进展,体现中国IgA 肾病的疾病负担,以文献综述的方法更好地了解IgA 肾病疾病管理中的未满足需求,进而为临床决策提供参考。
1 流行病学
本综述纳入5 篇[8-12]源于28 项全国性基于人群或大样本的肾小球疾病流行病学研究。研究结果发现,IgA 肾病在青壮年中高发,首诊时IgA 肾病患者平均年龄为30.5~40.0 岁,性别比例无明显差异[10-11],其中25~44 岁患者占全部患者的57.1%~67.0%[9-11]。
PGN 为最常检出的肾小球疾病,在全部肾穿刺活检中检出率为 65.1%~78.8%(加权均值为70.5%);在所有PGN 患者中,IgA 肾病是最常见的分型,占34.0%~52.7%(加权均值为37.8%),因此IgA 肾病在肾活检患者中检出率为24.1%~41.0%(加权均值为26.7%)。见表1。由于目前暂无IgA肾病在我国全人群中的患病率直接研究,基于我国慢性肾脏病(chronic kidney disease,CKD)、肾小球肾炎(glomerulonephritis,GN)及PGN 等患者流行病学及疾病谱构成相关研究,选择具有全国代表性或综述后的加权平均数据对我国IgA 肾病患者数量进行推算。全国性横断面流行病学调查结果显示,我国成人CKD 患病率约为10.8%,按照2019年中国成人人口数量为10.9 亿人估计,中国成人CKD 患者约为1.2 亿,其中仅有12.5%已知患有肾脏疾病[13]。我国慢性肾病网络(China kidney disease network,CK-NET)最新的CKD 流行病学研究提示,由GN导致的CKD(GN-CKD)患病率约占全部CKD 患者的14.4%[14]。据此推算,在CKD 患者中,原发疾病为GN 的成人患者约为1 722 万人。GN 中PGN 占比约为70.5%,即1 214 万人;PGN 中,IgA 肾病占37.8%,由此预估我国IgA 肾病成人患者约为459 万人,其中已诊患者约为57 万人[8-13]。
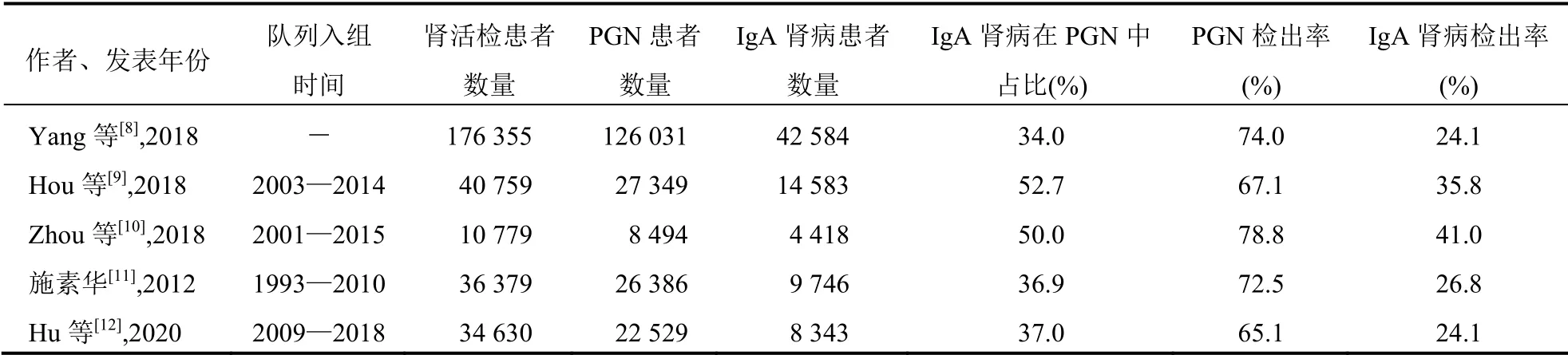
表1 IgA 肾病病理分型研究主要信息
本研究纳入多个基于中国IgA 肾病成年患者的真实世界注册登记研究[15-22],旨在了解IgA 患者在真实世界诊疗情境下疾病复发和进展比例,以及疾病进展的风险因素。在IgA 肾病患者长期随访的回顾性研究中,5.5年随访期后,15.5%IgA 肾病患者疾病复发,复发间隔为24~30 个月,且疾病复发患者是未复发患者进展至ESRD 风险的28 倍[18];随访3~4年、10年、15年及20年后分别有9%~12%、17%、26%以及36%患者进展至ESRD[15-17,19-20]。在ESRD透析患者中,GN 为最高发的原发疾病,占患者的42.5%~55.1%[21-22]。IgA 肾病复发及进展至ESRD存在多种风险因素。男性较女性疾病复发及进展风险均更高[16,18],但患病年龄与疾病进展无显著相关性[15]。患者基线的检验指标中,不同IgA 肾病风险预测模型结果均显示,IgA 肾病患者肾活检时肾小管萎缩、低eGFR、高血压、高蛋白尿、低蛋白血症、镜下血尿、高尿酸血症及高脂血症均为进展至ESRD的独立风险因素[17-20,23]。IgA 肾病随访期间,患者平均尿蛋白定量(time-average proteinuria,TA-P)>1.0 g/d 为IgA 肾病进展至ESRD 的最危险因素,TA-P>1.0 g/d 的患者进展至ESRD 是TA-P<1.0 g/d 患者的9.4 倍;平均动脉压(time-average mean arterial pressure,TA-MAP)、显微镜下平均红细胞(time- average red blood cell,TA-RBC)计数也是随访期疾病进展至ESRD 的风险因素[20]。
患者进展至ESRD 后疾病不可逆转,大部分需要透析或肾移植治疗维持生命,选择腹膜透析及血液透析患者比例分别为7.0%~15.7%和71.3%~93.0%[24-26]。我国肾移植供体有限,因此可接受移植的患者仅占所有ESRD 患者的13.1%[25],接受移植的患者中,肾源等待的中位期达17.1 个月[27]。
2 经济负担
我国IgA 肾病患者的经济负担研究非常有限。在3 篇纳入本综述的IgA 肾病患者疾病负担的研究中,汇报了IgA 肾病住院患者的直接医疗负担及医疗资源的使用情况。IgA 肾病患者次均住院费用为4 867~14 900 元,年均住院次数为1.0~1.3 次,单次住院时长为8.1~14.3 d。住院费用主要包括肾活检手术费用、药物(西药及中成药)、化验检查(血压、血白蛋白、血肌酐、eGFR、24 h 尿蛋白定量、C 反应蛋白)及诊疗费用[28-30]。其中,药费占总住院费用26.6%~59.1%[29-30]。患者出院后6 个月内门诊随访率约为81%[29]。
若IgA 肾病进展至ESRD,因患者需要透析等后续治疗,疾病将为患者、家庭及全社会带来沉重的经济负担。研究结果显示,腹膜透析的医疗费用低于血液透析,需要腹膜透析和血液透析的ESRD 患者人年平均直接治疗费用分别为7.3 万~9.6 万元和8.7 万~12.0 万元。血液透析合并贫血、高血压、糖尿病和血脂异常患者较多,因此疾病程度更重,所需的医疗费用也更多[14,24-26,31]。2015—2016年我国接受透析治疗的ESRD 患者为57.8 万~60.8 万人,患者接受腹膜透析和血液透析时,总直接医疗花费为507 亿~519 亿元。透析患者直接医疗费用可通过医保支付76.0%,其中门诊及住院期间的支付比例分别为64.1%和82.5%,因此,医保需要每年为透析患者支付386 亿~394 亿元。虽然ESRD 透析患者仅占全部医保人群的0.2%,医保支付金额却占医保基金的2.4%[14,27]。若ESRD 患者在透析后疾病持续进展,患者需要接受肾脏移植,年人均直接医疗费用则更高,第1年为19.5 万~20.3 万元,包括供受者手术期产生的费用、免疫抑制剂药物费用及住院相关费用;第2年及第3年费用虽有所降低,但仍达7.2 万~8.4 万元和6.7 万~10.4 万元[25,32]。
3 生命质量
本研究共检索7 篇有关IgA 肾病、透析前CKD以及透析后ESRD 患者生命质量研究。研究使用疾病特异性量表KDQoL-36 或普适性量表36 项健康调查简表(SF-36)、匹兹堡睡眠质量量表及抑郁量表BDI-Ⅱ,来评估疾病对患者生命质量的影响。
总体而言,IgA 肾病及透析前CKD 患者生命质量较差,主要体现在患病后身体症状对生理机能的影响和抑郁症状对心理机能的影响。使用SF-36 评价IgA 肾病患者生命质量的观察性研究结果表明,由于IgA 肾病患者伴随高血压、糖尿病、营养不良及肺功能异常导致新陈代谢变缓及心肺功能减弱,患者活动能力差,SF-36 生理健康总测量(PCS)评分较低(39.9~41.6)。心理上30% IgA 肾病患者因患病产生抑郁症状,使用BDI-Ⅱ评估70%患者抑郁症状为中重度,进而影响其SF-36 心理健康总测量(MCS)评分及生命质量[33]。含IgA 肾病在内的透析前CKD患者也会由于肾功能下降带来的疲乏、虚弱、体能下降、皮肤瘙痒和身体疼痛带来的身体症状,PCS评分低于一般人群,其中生理功能、生理职能、疼痛及一般健康评分均显著低于一般人群[34-36]。此外,60%CKD 患者合并睡眠障碍,睡眠障碍症状会进一步降低患者生命质量,SF-36 PCS 及MCS 评分均显著降低[34]。
进展至ESRD 后,由于疾病症状及长期透析治疗带来的营养不良、贫血、失眠和肌肉含量损失,患者活动能力更差,从而生命质量下降;其中年龄、文化程度、婚姻状况、合并症、并发症以及透析时长均会影响患者生命质量[37-39]。血液透析患者较腹膜透析患者生命质量更差,使用SF-36 评估透析患者生命质量的研究中,血液透析患者PCS 评分为34.5~44.8,腹膜透析患者PCS 评分为41.3[37-39]。
IgA 肾病患者病情进展至ESRD 后除生命质量更差外,随着透析时间的增加,死亡风险逐渐升高。ESRD 生存预后回顾性研究显示,我国经血液透析的ESRD 患者年死亡率为3.8%~11.2%,高于一般人群(50~64 岁为0.4%~1.0%),死亡的首要原因为心脑血管事件及全身衰竭[20,22]。
4 临床治疗现状
中国IgA 肾病治疗主要依据为2012年KDIGO提出的IgA 肾病治疗指南。KDIGO 指南推荐RAAS抑制剂为具有蛋白尿和高血压IgA 肾病患者的一线治疗用药,也被称为支持治疗,包括使用血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)或血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB)。其中,针对24 h 尿蛋白定量>1 g 患者,推荐使用长效RAAS 抑制剂治疗。经历3~6 个月的最佳支持治疗后,24 h 尿蛋白定量持续>1 g 且GFR>50 ml/(min·1.73 m2)患者,推荐使用6 个月的糖皮质激素治疗。此外,除新月体性IgA 肾病伴有肾功能快速下降外,不建议应用糖皮质激素联合免疫制剂[5]。
目前,关于IgA 肾病的临床治疗已有的中国循证医学证据比较有限,本次文献综述共检索并纳入27 篇中国人群IgA 肾病临床治疗相关研究,其中16 篇为临床试验[40-55],11 篇为前瞻性及回顾性真实世界研究[56-66]。我国真实世界回顾性研究结果发现,IgA 肾病患者RAAS 抑制剂使用率为90.0%~96.2%[15-16,19-20,23],使用较多的为氯沙坦钾或缬沙坦,约占85%以上[60]。糖皮质激素治疗率为10.8%~53.7%[15-16,18-20,65],药物为口服注射用甲泼尼龙琥珀酸钠或泼尼松[15,19-20,65]。使用免疫抑制剂治疗患者占2.4%~33.2%[15-16,18-20],包括吗替麦考酚酯、环磷酰胺、环孢素、他克莫司及来氟米特[15,17,19-20,65]。药物依从性方面,RAAS 抑制剂6 个月及以上使用率为89.0%~90.0%[19-20,23,57,66];糖皮质激素初始剂量为0.4~1.0 mg/(kg·d)使用2 个月后减量,直至6~12 个月后停药[56-57,59-61,63,65]。除西药治疗外,我国IgA肾病患者也会选择中药治疗,其中以雷公藤多苷为主,治疗率约为72%[20];除雷公藤多苷外,目前也存在例如植物类药物黄蜀葵治疗IgA 肾病的疗效及安全性的随机对照试验[55]。
疗效方面,60.4%~74.4% IgA 肾病患者经6 个月治疗后可以达到缓解[18-19];37.3%患者仅使用RAAS 抑制剂即可达到蛋白尿缓解(TA-P<1 g)[19]。针对使用RAAS 抑制剂后控制不佳患者,即未达到蛋白尿缓解(TA-P>1 g)、合并大量蛋白尿(持续TA-P>3 g)或进展至肾小球损伤(新月体性IgA 肾病及肾小球坏死),RAAS 抑制剂联合糖皮质激素或使用免疫抑制剂可显著降低短期尿蛋白水平及延缓肾功能进展(降低eGFR 下降率)[52,54,58,60-61,63-64]。此外,目前没有明确证据证明RAAS 抑制剂联合糖皮质激素及免疫抑制剂能减少疾病进展至ESRD 的风险。TESTING 试验和观察性研究结果均表明,使用糖皮质激素及免疫抑制剂一年后进展至ESRD 患者数量低于单纯使用支持治疗组,但5年肾脏结局组间无显著差异,长期获益暂不明确[52,61]。糖皮质激素联合免疫抑制剂方案也被证明可进一步降低尿蛋白水平、血肌酐,但仍缺乏长期随访证据证实糖皮质激素联合免疫抑制剂方案的长期获益[43,50-51,53]。除西药治疗外,雷公藤多苷及黄蜀葵等中药也可有效降低蛋白尿定量及血肌酐、升高血清白蛋白或降低eGFR 下降率[40-42,44-49,55]。
安全性方面,鲜少有研究报告RAAS 抑制剂的不良反应事件,纳入研究的一项RCT 汇报使用RAAS 后患者出现中性粒细胞减少及高钾血症各1 例[54];使用糖皮质激素及免疫抑制剂不良反应事件主要为糖尿病、感染(以上呼吸道及肺部感染为主)、失眠、肝功能异常及库欣综合征[53-54]。对于老年高血压患者以及eGFR 较低患者,糖皮质激素在治疗期间严重不良反应(severe adverse event,SAE)发生率较高,主要为需收住院或导致死亡的感染,股骨头坏死或骨折、糖尿病、白内障及心血管不良反应(包括心肌梗死或心力衰竭)。因此,临床上使用糖皮质激素仍需考虑患者疾病特征后平衡利弊[52,65]。
5 总结
IgA 肾病是PGN 中最常见的分型,患者数量众多,部分患者因疾病控制不佳最终进展至ESRD,进而带来沉重的临床和经济负担,并严重影响患者的生命质量。本研究结果提示,中国IgA 肾病患者占PGN 的34.0%~52.7%,高于西方国家(南美:6.1%;北美:11.8%;欧洲:22.1%)[1,67]。本研究推算,在中国现有IgA 肾病患者约为459 万人,其中已诊患者约为57 万人。根据全球GN-CKD 患病率10年增长率为20.4%推断,至2027年我国IgA 肾病成人患者将达553 万人。在纳入本综述关于IgA 肾病患者疾病负担的研究中,IgA 肾病直接医疗成本主要来自于肾穿刺活检手术费及药物费用,若疾病进展至ESRD,肾脏透析产生的费用将给患者、家庭及全社会带来沉重的经济负担。因此,IgA 肾病需要有效的长期干预方案,以避免疾病进展后给患者及全社会带来的经济负担。
目前,中国尚无关于IgA 肾病的成人诊疗指南,因此该疾病在我国的治疗多参考国际的KDIGO 指南。我国IgA 肾病患者中RAAS 抑制剂使用率约90%,与KDIGO 指南推荐RAAS 抑制剂作为长期支持治疗方案一致。本研究发现,针对使用RAAS 抑制剂后仍未缓解的患者,10.8%~53.7%选择使用糖皮质激素治疗,2.4%~33.2%使用免疫抑制剂治疗。全球多中心的VALIGA 回顾性研究结果显示,IgA肾病患者使用RAAS 抑制剂后,46%患者使用了糖皮质激素或免疫抑制剂治疗,其中98%患者使用了糖皮质激素[68]。目前,我国糖皮质激素及免疫抑制剂使用比例差异较大,且患者基线水平各异,这或许与我国不同地域间药物可及性不同以及医生处方习惯有关,未来需要真实世界中药物合理使用及药物依从性数据来更好地支持临床决策。
综上所述,以综述的方法全面收集整理我国关于IgA 肾病的疾病信息和相关证据,了解中国IgA肾病患者的治疗现状及未满足需求。在中国IgA 肾病作为PGN 中最常见分型,患者数量较大。由于暂无疗效及安全性俱佳的特异性疗法,部分患者进展至ESRD 后经济负担沉重,并影响患者生命质量。由于现有中国IgA 肾病的研究相对较少,仍需更多证据进而为临床决策提供参考。
