miR-520f-3p靶向MCL1抑制结肠癌细胞生长及移植瘤发生
2022-07-30陶正贵杜静虎田葵王东华胡凤琪陈满宇
陶正贵 杜静虎 田葵 王东华 胡凤琪 陈满宇
(湖北文理学院附属医院 襄阳市中心医院 1普外科,湖北 襄阳 441000;2肾内科)
在世界范围内,结肠癌是全世界癌症死亡的第二大主要原因〔1〕。结肠癌特征是结肠部分细胞的异常凋亡和恶性生长,结肠癌的常用治疗方法是手术、化学疗法、放射疗法和靶向疗法〔2〕。由于人们生活水平的提高、饮食的变化、多脂食品和多糖食品等食品的消费增加、生活节奏加快、工作压力增加和环境污染,结肠癌的发病率逐年增加〔3〕。尽管在结肠癌的治疗方面取得了显著进展,结肠癌的5年生存率已超过60%,但在治疗过程中仍然存在很多问题〔4〕。鉴于此,迫切需要更有效和新颖的结肠癌治疗药物和策略。miRNA参与了许多细胞过程的调节,包括代谢稳态、细胞增殖和细胞凋亡〔5〕。miRNA的异常表达已经与多种人类疾病的发病机制紧密相关,几乎所有类型的癌症都存在。miRNA在癌症发展中的作用相当复杂,miRNA既可以通过抑制肿瘤抑制基因充当癌基因,也可通过负调控癌基因mRNA发挥肿瘤抑制作用〔6〕,其中miR-520f-3p是有效的mRNA之一。已有研究表明,miR-520f-3p靶向性别决定区Y框蛋白(SOX)9抑制胃癌细胞增殖〔7〕;也有研究表明miR-520f-3p通过负调控高氨酸拉链下调因子(LDOC)1增加胶质瘤的干性〔8〕。但miR-520f-3p在结肠癌中的作用尚不清楚。本文主要研究miR-520f-3p对结肠癌的作用及机制。
1 材料与方法
1.1主要试剂及仪器 miR-NC、pc-NC、miR-520f-3p mimic、miR-520f-3p inhibitor、pc-髓样细胞白血病蛋白(MCL)1质粒和实验所用各种引物由北京奥科生物科技有限公司设计并合成,Lipofectamine2000转染试剂(上海少辛生物科技有限公司,货号:11668-019),胎牛血清(北京百奥莱博科技有限公司,货号:QS071),RPMI1640培养基(北京清大天一科技有限公司,货号:MD800),青霉素和链霉素双抗溶液(北京沃比森科技有限公司,货号:C0160-611),SYBR-Green聚合酶链反应(PCR)试剂盒(嘉兴蓝诺盛生物科技有限公司,货号:RT0411-03),RIPA裂解缓冲液(上海雅酶生物科技有限公司,货号:PC101),双荧光素酶报告基因检测试剂盒(北京威格斯生物技术有限公司,货号:T002),二喹啉甲酸(BCA)试剂盒(西安浩特生物科技有限公司,货号:WB027),辣根过氧化物酶标记的山羊抗兔二抗、Ki67、增殖细胞核抗原(PCNA)、cleaved caspase-3、B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)、MCL1抗体(上海艾博抗生物科技有限公司,货号:ab36151、ab92742、ab18197、ab2302、ab32503、ab182858、ab32087),裸鼠购自四川夏派森医药科技有限公司,许可证:SYXK(川)2017-203。FluorChem HD2凝胶成像系统购自美国Proteinsimple公司,BS-1101全自动多功能酶标仪购自北京华泰和合商贸有限公司,FACSCalibur流式细胞仪购自美国BD公司,Seahorse XF24分析仪购自美国Seahorse公司。
1.2细胞及培养 正常结肠上皮细胞HCoEpiC和结肠癌细胞系(HT-29、SW480、LOVO、HCT15、Colo205、SW620)均购自上海素冉生物科技有限公司。在37℃、5% CO2条件下,所有细胞于含体积分数为10%胎牛血清、100 U/ml的青霉素和链霉素双抗溶液的RPMI1640培养基中培养。
1.3组织样品 在2018年2月至2020年2月期间,从湖北文理学院附属医院行肿瘤瘤切除术的患者中获取组织。该研究得到医院研究伦理委员会批准,并根据《赫尔辛基宣言》的道德准则进行,且获得患者同意并签订知情同意书。
1.4实时荧光定量(RT-q)PCR检测miR-520f-3p mRNA表达 将正常结肠组织和结肠癌组织剪碎并研磨,然后裂解提取总RNA。对于细胞,将正常结肠上皮细胞HCoEpiC和结肠癌细胞系(HT-29、SW480、LOVO、HCT15、Colo205、SW620)接种在12孔板中,当细胞达到近85%融合时,用RIPA裂解提取总RNA。用 cDNA逆转录试剂盒逆转录,以cDNA为模板按SYBR-Green PCR试剂盒说明书操作进行RT-qPCR。miR-520f-3p的循环条件为:95℃ 15 s和61℃ 35 s的40个循环,用U6标准化。使用2-ΔΔCt方法计算。每个样品进行3次重复分析。引物序列为:miR-520f-3p正义链:5′- ACACTCCAGCTGGGCCTCTAAAGGGAAGCG-3′,反义链:5′-CTCAA CTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAG-3′;U6正义链:5′- CTCGCTTCGGCAGCACA-3′,反义链:5′-AACGCTTCACGAATTTGCGT-3′。
1.5细胞转染 取对数期结肠癌HT-29细胞,以每孔1×106密度接种于12孔板。当达到85% 融合,根据Lipofectamine2000说明书按照分组将miR-NC、miR-520f-3p mimic、miR-520f-3p inhibitor和pc-NC、pc-MCL1质粒分别或联合转染进入HT-29细胞。
1.6克隆形成实验检测细胞生长能力 将1.5转染的结肠癌HT-29细胞接种于6孔板,每孔1×106,直到生长至可见克隆细胞。用甲醇固定可见克隆细胞,0.25% 结晶紫染色30 min,计数克隆细胞数量。
1.7流式检测细胞凋亡率 取1.5转染的结肠癌HT-29细胞培养24 h后,离心收集细胞,并按1×106个细胞/ml的浓度重悬。细胞悬液中加入5 μl FITC标记的膜联蛋白V和碘化啶,避光孵育15 min,然后用流式细胞仪分析细胞凋亡率。
1.8裸鼠移植瘤实验 所有裸鼠分为4组:Control组、miR-NC组、miR-520f-3p mimic组、miR-520f-3p inhibitor组。在每只裸鼠左腋下皮下注射100 ml磷酸盐缓冲液(PBS)中5×106各转染的结肠癌HT-29细胞,继续在SPF条件下正常饮食饲养〔9〕。第30天颈椎脱位法处死裸鼠,完整取出皮下肿瘤,测定移植瘤体积和重量,TUNEL检测细胞凋亡率,Western印迹检测Ki67、PCNA、cleaved caspase-3、Bax和Bcl-2蛋白表达水平。其中移植瘤体积测量方法是用游标卡尺分别测出a:长径;b:宽径;c:高,再用公式:V=πabc/6进行计算。
1.9Western印迹检测Ki67、PCNA、 cleaved caspase-3、Bax、Bcl-2和MCL1蛋白表达水平 收集1.5转染的结肠癌HT-29细胞和1.8移植瘤组织。用RIPA裂解液裂解细胞和组织并提取总蛋白。然后用BCA试剂盒定量蛋白的浓度。将蛋白样品用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,再用半干转膜仪转移到聚偏氟乙烯膜,室温下于脱脂牛奶中封闭蛋白2 h。接着加入对应的兔来源的单克隆一抗(Ki67 1∶1 000、PCNA 1∶1 500、cleaved caspase-3 1∶1 000、Bax 1∶800、Bcl-2 1∶1 000、MCL1 1∶1 000),于4℃ 封闭过夜。然后,加入对应辣根过氧化物酶标记的山羊抗兔单克隆二抗(1∶2 000)室温封闭1 h,最后滴电化学反应液曝光。以GAPDH为内参,使用软件ImagePro Plus6.0分析蛋白条带灰度,蛋白相对表达水平=目标蛋白积分吸光度值/内参蛋白GAPDH积分吸光度值。
1.10TUNEL染色检测移植瘤细胞凋亡 取移植瘤组织固定后,常规石蜡切片,玻片预先用多聚赖氨酸处理以防止脱片。切片脱蜡入水后按TUNEL染色试剂盒内使用说明操作,二氨基联苯胺(DAB)染色,常规脱水、透明、封片,光镜下检查。棕褐色细胞代表凋亡细胞,计算细胞凋亡率。
1.11免疫组化检测Ki67阳性表达水平 石蜡切片经脱蜡水化,过氧化物酶阻断内源性过氧化物酶活性,加入兔来源Ki67单克隆抗体(1∶250),4℃过夜,滴加生物素标记二抗,DAB显色,蒸馏水冲洗,苏木素复染,梯度酒精脱水,二甲苯透明,封片观察统计。着色为棕黄色的表示细胞阳性。随机选取5个视野用Image J计数阳性着色细胞,计算阳性细胞百分率(%)。
1.12双荧光素酶报告检测靶向关系 收集生长至对数期的结肠癌HT-29细胞,接种于24孔板中,并在37℃、5%CO2条件的培养箱培养24 h。然后,将1 μg PGL3-MCL1-WT(MCL1野生型)或PGL3- MCL1-MUT(MCL1突变型)及miR-NC或miR-520f-3p mimic和PRL-CMV质粒共转染入结肠癌HT-29细胞,转染48 h后,结肠癌HT-29细胞裂解15 min,双荧光素酶检测系统测量荧光素酶的相对活性,荧光素酶的相对活性(R/F)=萤火虫荧光素酶活性/肾荧光素酶活性。
1.13统计学方法 采用SPSS22.0软件进行单因素方差分析、t检验。
2 结 果
2.1miR-520f-3p在结肠癌组织和细胞中的表达情况 与正常结肠组织(0.45±0.07)相比,结肠癌组织中miR-520f-3p 的mRNA表达(0.45±0.07)显著下调(P<0.01);与人正常结肠上皮细胞HCoEpiC(1.00±0.08)相比,结肠癌细胞系(HT-29、SW480、LOVO、HCT15、Colo205、SW620)中miR-520f-3p 的mRNA表达(0.34±0.07、0.42±0.08、0.51±0.09、0.38±0.06、0.47±0.08、0.44±0.09)显著下调(均P<0.01),选取HT-29细胞做后续实验。
2.2miR-520f-3p对HT-29细胞增殖和凋亡的影响 与Control相比,miR-NC组HT-29细胞克隆细胞数目、细胞凋亡率均无明显变化(P>0.05);miR-520f-3p mimic组HT-29细胞克隆细胞数目显著减少,细胞凋亡率显著增加(P<0.01,见表1,图1);miR-520f-3p inhibitor组HT-29细胞克隆细胞数目显著增加,细胞凋亡率显著减少(P<0.01,表1,图2)。进一步运用Western印迹检测HT-29细胞中增殖和凋亡相关蛋白的表达。与Control组相比,miR-NC组HT-29细胞中Ki67、PCNA、cleaved caspase-3、Bax和Bcl-2蛋白的表达均无明显变化(P>0.05);miR-520f-3p mimic组HT-29细胞中Ki67和PCNA蛋白表达水平显著下调,cleaved caspase-3和Bax/Bcl-2蛋白表达水平显著上调(均P<0.01),miR-520f-3p inhibitor组HT-29细胞中Ki67和PCNA蛋白表达水平显著上调,cleaved caspase-3和Bax/Bcl-2蛋白表达水平显著下调(均P<0.01,见表2,图3)。
表1 miR-520f-3p对结肠癌HT-29细胞克隆形成和凋亡率的影响

图1 克隆形成实验检测细胞增殖(结晶紫染色,×100)

图2 流式检测各组细胞凋亡率
表2 各组HT-29细胞中增殖与凋亡相关蛋白的影响
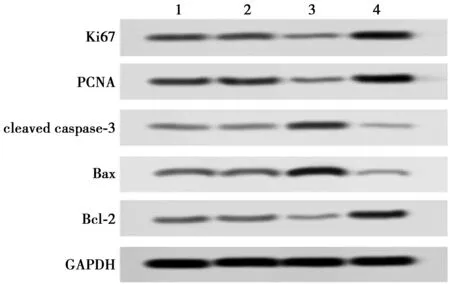
1~4:Control组、miR-NC组、miR-520f-3p mimic组、miR-520f-3p inhibitor组图3 Western印迹检测Ki67、PCNA、cleaved caspase-3、Bax、Bcl-2蛋白表达水平
2.3miR-520f-3p对结肠癌HT-29移植瘤生长的影响 与Control组相比,miR-NC组结肠癌HT-29移植瘤体积和重量、细胞凋亡率、Ki67阳性细胞百分率均无明显变化(P>0.05);miR-520f-3p mimic组结肠癌HT-29移植瘤重量和体积显著减少,细胞凋亡率显著增加,Ki67阳性细胞百分率显著降低(均P<0.01);miR-520f-3p inhibitor组结肠癌HT-29移植瘤重量和体积及Ki67阳性细胞百分率显著增加,细胞凋亡率显著减少(均P<0.01)。见图4,表3,图5,图6。进一步运用Western印迹检测了肿瘤组织中增殖和凋亡相关蛋白的表达。与Contro组相比,miR-NC组结肠癌HT-29移植瘤组织中Ki67、PCNA、cleaved caspase-3、Bax和Bcl-2蛋白的表达均无明显变化(P>0.05);miR-520f-3p mimic组结肠癌HT-29移植瘤组织中Ki67和PCNA蛋白表达水平显著下调,cleaved caspase-3和Bax/Bcl-2蛋白表达水平显著上调(均P<0.01);miR-520f-3p inhibitor组结肠癌HT-29移植瘤组织中Ki67和PCNA蛋白表达水平显著上调,cleaved caspase-3和Bax/Bcl-2蛋白表达水平显著下调(均P<0.01)。见表4,图7。
2.4miR-520f-3p和MCL1靶向关系 通过 Targetscan软件预测发现,miR-520f-3p与MCL1具有靶向关系,在3′UTR区存在结合位点;通过双荧光素酶发现,与miR-NC组(1.00±0.07)相比,miR-520f-3p mimic与PGL3-MCL1-WT共转染使荧光素酶活性(0.41±0.08)显著降低(P<0.01)。与Control组(0.58±0.05)相比,miR-NC组(0.56±0.06)和pc-NC组HT-29细胞中MCL1表达(0.57±0.06)无明显变化(P>0.05),miR-520f-3p mimic组HT-29细胞中MCL1表达(0.01±0.07)显著下调,pc-MCL-1组HT-29细胞中MCL1表达(0.86±0.08)显著上调(P<0.01)。见图8。

图4 各组移植瘤

表3 miR-520f-3p对HT-29移植瘤生长的影响
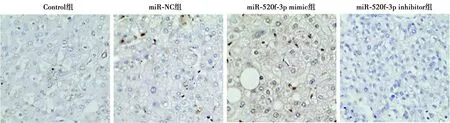
图5 TUNEL染色检测各组移植瘤细胞凋亡(×200)

图6 免疫组化检测各组Ki67表达水平(×200)
表4 miR-520f-3p对肿瘤组织中增殖与凋亡相关蛋白的影响
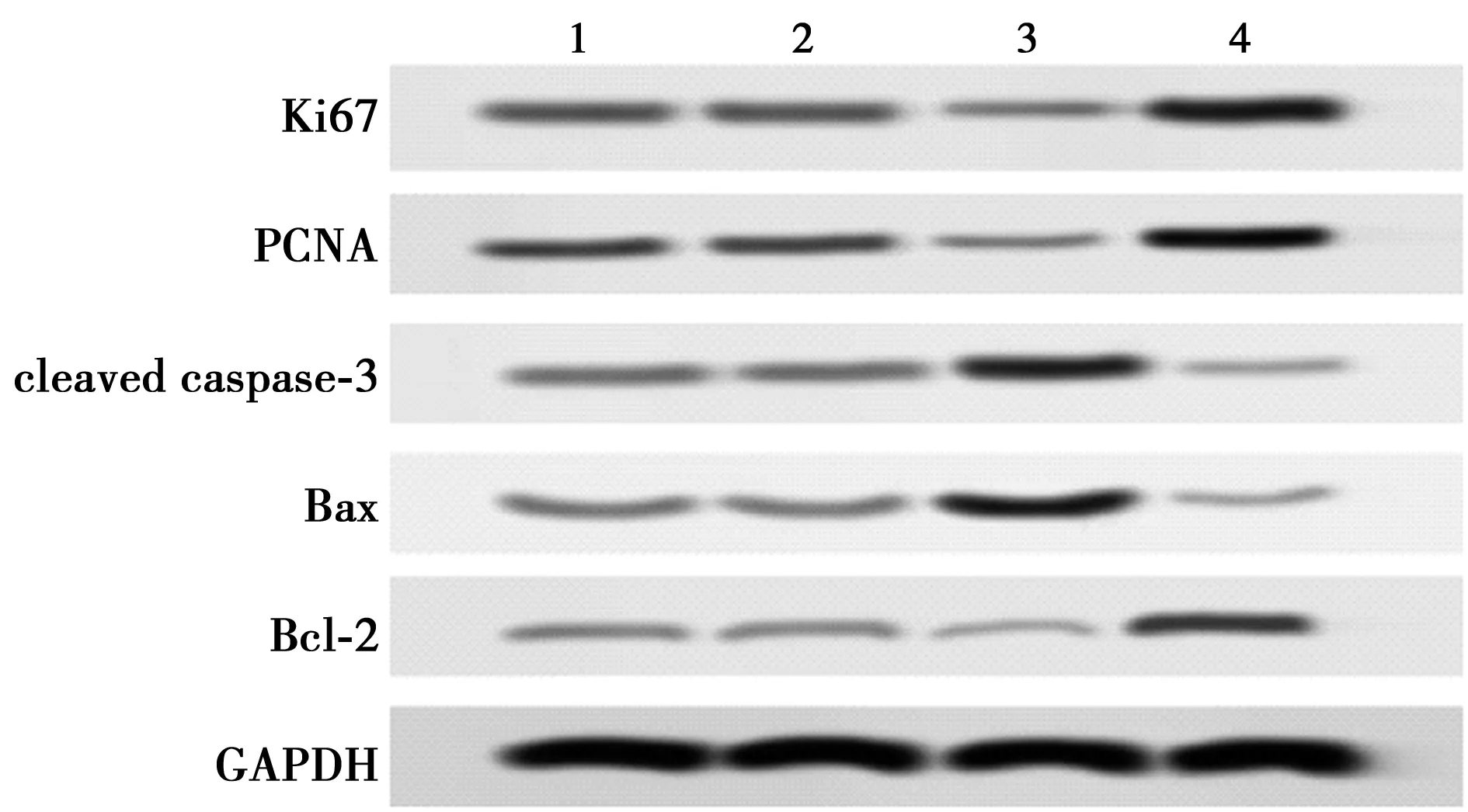
图7 蛋白印迹法检测Ki67、PCNA、cleaved caspase-3、Bax、Bcl-2蛋白表达水平

A:Targetscan软件预测miR-520f-3p与MCL1靶向关系;B:Western印迹法检测MCL1蛋白表达水平;1~5:Control组、miR-NC组、miR-520f-3p mimic组、pc-NC组、pc-MCL1组图8 miR-520f-3p和MCL1靶向关系
2.5MCL1过表达对miR-520f-3p在HT-29细胞增殖和凋亡的影响 与miR-520f-3p mimic+pc-NC相比〔(44.15±7.14)个、(28.53±5.78)%〕,miR-520f-3p mimic+pc-MCL1组HT-29细胞克隆细胞数目〔(98.27±10.52)个〕显著增加,细胞凋亡率〔(9.43±3.45)%〕显著减少(P<0.01)。与miR-520f-3p mimic+pc-NC相比,miR-520f-3p mimic+ pc-MCL1组HT-29细胞中Ki67和PCNA蛋白表达显著上调,cleaved caspase-3和Bax/Bcl-2蛋白表达显著下调(P<0.01),见图9、表5。

A:克隆形成实验检测细胞增殖(结晶紫染色,×100);B:流式检测细胞凋亡率;C:Western印迹法检测Ki67、PCNA、cleaved caspase-3、Bax、Bcl-2蛋白表达水平;1~2:miR-520f-3p mimic+pc-NC组、miR-520f-3p mimic+pc-MCL1组图9 MCL1过表达对miR-520f-3p在HT-29细胞增殖和凋亡的影响

表5 MCL1过表达对miR-520f-3p在肿瘤组织中增殖与凋亡相关蛋白的影响
3 讨 论
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤,随着人们生活水平的提高,结肠癌的发病率也缓慢上升〔10〕。由于miRNA在体液中稳定,无论是在分泌的微泡中还是与载体蛋白结合,miRNA都可以作为早期癌症诊断的生物标志物。已有研究提出,miR-520f可作为肺癌诊断的生物标志物〔11〕。同一RNA在不同种类的肿瘤细胞中也具有不同的作用,如在人类黑色素瘤细胞中,miR-520f通过调控Itch表达促进细胞增殖,从而发挥致癌作用〔12〕;在肝癌中,miR-520f靶向TM4SF1抑制肿瘤细胞增殖和侵袭,从而发挥抑癌作用〔13〕。结肠癌特征是结肠部分细胞的异常和恶性生长。本研究表明,miR-520f-3p 过表达抑制结肠癌HT-29细胞增殖及移植瘤的生长,并诱导细胞凋亡,下调Ki67和PCNA蛋白表达,上调cleaved caspase-3和Bax/Bcl-2蛋白表达;miR-520f-3p 低表达促进结肠癌HT-29细胞增殖及抑制瘤的生长,并抑制细胞凋亡,上调Ki67和PCNA蛋白表达,下调cleaved caspase-3和Bax/Bcl-2蛋白表达。Ki67和PCNA蛋白是增殖标记蛋白,其表达量与细胞的增殖情况呈正比;cleaved caspase-3、Bax和Bcl-2是凋亡标记蛋白,其cleaved caspase-3表达量及Bax/Bcl-2表达量比值均与细胞的凋亡情况呈正比〔14〕。因此,miR-520f-3p在结肠癌中作为抑癌基因,抑制结肠癌细胞生长及移植瘤发展。这与miR-520f通过靶向ATP酶家族AAA含域蛋白2抑制胃癌细胞的生长结果相类似〔15〕。
miRNAs通过与靶mRNA的3′-UTR结合来调控基因表达。为了更好地了解其机制,本研究通过基因预测软件预测发现,miR-520f-3p与MCL1具有靶向关系,在3′-UTR区存在结合位点。并通过荧光素酶实验验证了miR-520f-3p与MCL1具有直接靶向关系。MCL1位于染色体lq21,是一种属于Bcl-2家族的抗凋亡基因,通常在许多恶性肿瘤中表达上调,发挥致癌作用〔16〕。已有研究表明,MCL1在结肠癌中高表达,MCL1降解是靶向治疗结肠癌所必需的〔17〕。已有研究表明,在胶质瘤中,沉默MCL1基因可通过抑制磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)信号通路促进肿瘤细胞的衰老和凋亡〔18〕;在胃癌,中miR-125b通过靶向MCL1抑制肿瘤细胞增殖和侵袭〔19〕;在骨髓瘤中,miR-126通过下调抗凋亡蛋白MCL1诱导细胞凋亡〔20〕;在喉癌细胞中,miR-363的上调导致MCL1表达下降,可使细胞的增殖和侵袭减弱,加速细胞凋亡〔21〕。因此,通过抑制MCL1的表达抑制肿瘤细胞的增殖,并诱导肿瘤细胞的凋亡是癌症预防的一种手段。本研究这说明miR-520f-3p通过靶向下调MCL1,来抑制结肠癌细胞生长及移植瘤的发展。这与MCL-1异常高表达与Bax和caspase-3的低表达共同抑制肝癌细胞的凋亡,并且三者在原发性肝癌的发生和发展过程中发挥作用〔22〕。
综上,miR-520f-3p靶向MCL1抑制结肠癌细胞增殖及移植瘤的发展,说明miR-520f-3p 和MCL1可作为潜在的分子治疗靶点。但本文仅为作用机制的初步探讨,具体的分子通路机制还有待研究。
