Barx2和Axin2在ALS转基因小鼠脊髓中表达变化
2022-07-30郑怡雯周永佳罗梦秋刘金梦梁婵婵王巧真陈燕春王箐
郑怡雯 周永佳 罗梦秋 刘金梦 梁婵婵 王巧真 陈燕春 王箐
(潍坊医学院 1临床医学院,山东 潍坊 261053;2神经疾病与再生修复实验室;3基础医学院人体解剖学教研室)
肌萎缩侧索硬化症(ALS)是一种慢性进行性神经系统变性疾病,病变主要累及脊髓、大脑皮质等部位的神经元,表现为进行性的肌力下降和肌萎缩,最后导致呼吸循环系统器官衰竭而死亡〔1〕。ALS发病机制复杂,目前无有效治疗方法。Bar家族同源域因子(Barx)2,可调控细胞黏附分子表达,影响细胞在不同环境中的分化,在细胞黏附和细胞重构中发挥重要作用〔2〕。有研究表明Barx2是胚胎和成人成肌细胞的新标志物,是人出生后生长和修复所必需的指标〔3〕。有相关报道发现Barx2参与调控Wnt/β-catenin信号传导途径〔2,4〕。轴向抑制蛋白(Axin)2是一种主要的支架蛋白,是Wnt/β-catenin信号通路的负调节因子〔5,6〕。Wnt/β-catenin信号传导途径在ALS发病中发挥重要作用,该信号传导途径异常与ALS发病紧密相关〔7〕。但目前关于Barx2和Axin2在ALS转基因小鼠脊髓内的表达变化尚未阐明。本研究选用SOD1-G93A基因突变的ALS转基因小鼠,应用分子生物学和形态学等方法检测Barx2和Axin2在ALS小鼠脊髓内的表达情况,探讨其与ALS发病的关系。
1 材料和方法
1.1实验动物 野生型(WT)及突变型超氧化物歧化酶(SOD)1-G93A转基因小鼠即ALS转基因小鼠,购自Jackson实验室(合格证编号为3100079226)。参照Chen等〔7,8〕方法严格按转基因鼠饲养条件进行饲养,将4周龄小鼠剪尾约0.5 cm,进行DNA检测,基因扩增检测鉴别ALS小鼠和WT小鼠。将33只成年ALS小鼠按照不同发病时期分为早(95 d)、中(108 d)、晚(122 d)期ALS组各11只,并且每组配以同窝WT小鼠作为对比参照,分别为早(95 d)、中(108 d)、晚(122 d)期WT组各11只。
1.2实验试剂及主要仪器 小鼠源抗体Barx2购自Santa Cruz Blotechnology公司,兔源抗体Axin2购自Arigo Biolaboratories公司,小鼠源性和兔源性β微管蛋白(β-tubulin)Ⅲ抗体分别购自R&D公司和Abcam公司;小鼠源性 GAPDH 抗体购自Proteintech Group公司。羊抗兔辣根过氧化物酶(HRP)酶标二抗、羊抗小鼠HRP酶标二抗、驴抗小鼠Alexa fluor 488及羊抗兔Cy3荧光二抗试剂均购自北京中杉金桥生物技术有限公司。Western印迹增强型化学发光液购自Thermo Fisher Scientific公司,聚偏氟乙烯(PVDF)膜购自Millipore公司。Barx2、Axin2和内参照β-actin引物均购自Samgon Biotech公司。反转录试剂盒购自Toyobo公司。
1.3标本制备 按照前期实验方法取发病不同时期ALS转基因小鼠和WT小鼠脊髓〔7,8〕,其中一部分组织研磨提取RNA用于反转录(RT)-聚合酶链反应(PCR),一部分组织超声震碎提取蛋白用于Western印迹检测;部分ALS小鼠和WT小鼠心脏灌注固定后制备脊髓冰冻切片,用于免疫荧光技术检测。
1.4RT-PCR检测 参照文献〔7〕实验方法提取RNA和反转录cDNA。引物序列为:Barx2:上游GATGGTCCTTAAAGGTGGACAG,下游TGGGCTCC-TGGGTATCACAG;β-actin:上游GAGCTACGAGCTGCCTGACG,下游CCTAGAAGCATTTGCGGTGG;Axin2:上游ATGAGTAGCGCCGTGTTAGTG,下游GGG-CATAGGTTTGGTGGACT;以cDNA为模版分别进行Barx2基因和Axin2基因扩增,用β-actin作为内参照。反应体系如下:2×Master Mix 10 μl,目的基因上、下游引物各0.5 μl,β-actin内参照基因上、下游引物各0.5 μl,cDNA 模板1 μl,用无菌水加至总体积为20 μl。在PCR仪中94℃ 3 min预变性,94℃ 30 s变性、58℃ 30 s退火和72℃ 30 s 延伸依次循环30次,最后1个循环延伸72℃ 3 min后冷却至4℃。琼脂糖凝胶电泳,将RT-PCR所得图像应用IPP6.0软件测量分析。
1.5Western印迹检测 参照文献〔7〕实验方法提取脊髓组织并进行电泳和转膜。将完成转膜后的PVDF膜放置在5%脱脂牛奶内进行抗原封闭2 h,磷酸盐缓冲液(PBS)清洗PVDF膜,裁膜后孵育一抗:小鼠Barx2(1∶500),小鼠GAPDH(1∶2 000),兔 Axin2(1∶1 000)。其余步骤参照Chen等〔8〕实验方法将结果应用IPP6.0软件分析Barx2、Axin2蛋白和内参照GAPDH蛋白的相对表达水平。
1.6免疫荧光标记 将冰冻切片晾干,PBS冲洗后滴加0.3% Triton X-100,置于暗盒内常温放置10~15 min。PBS冲洗,滴加正常羊血清封闭抗原,37℃孵育30 min;取出后甩掉羊血清,分别滴加稀释好的兔 Axin2(1∶80)与小鼠β-tubulinⅢ(1∶200)混合一抗工作液及小鼠Barx2(1∶100)与兔β-tubulinⅢ(1∶100)混合一抗工作液,置于暗盒中4℃过夜。次日,PBS中漂洗后滴加驴抗小鼠Alexa fluor 488(1∶400)和羊抗兔Cy3(1∶400)混合二抗,37℃ 孵育40 min,PBS清洗,甩干;Hoechst33258标记细胞核,37℃温箱中孵育15 min后,PBS冲洗。滴加荧光防淬灭剂,封片,应用Olympus 荧光显微镜观察并拍照记录。
1.7统计学处理 采用SPSS20.0软件进行独立样本t检验。
2 结 果
2.1各组脊髓内Barx2 mRNA及蛋白表达比较 RT-PCR检测发现,与早、中、晚期WT组(100.2±9.8、98.3±8.3、97.7±15.1)相比,早、中、晚期ALS组脊髓内Barx2 mRNA表达水平(39.3±5.5、54.9±5.3、67.7±4.2)均明显下降(P<0.05)。Western印迹结果显示,与早、中、晚期WT组(106.1±12.2、97.2±15.6、91.0±11.6)相比,早、中、晚期ALS组Barx2蛋白表达水平(66.6±10.4、32.8±5.1、65.1±8.4)均显著下降(P<0.05),见图1、图2。免疫荧光检测发现,在晚期ALS组及WT组脊髓中均可检测到 Barx2阳性细胞,且与β-tubulinⅢ标记的神经元共表达,阳性细胞集中在灰质前角,该处是病变损害所在部位。与晚期WT组相比,晚期ALS组脊髓中Barx2免疫阳性减弱,与Western印迹检测结果一致,见图3。
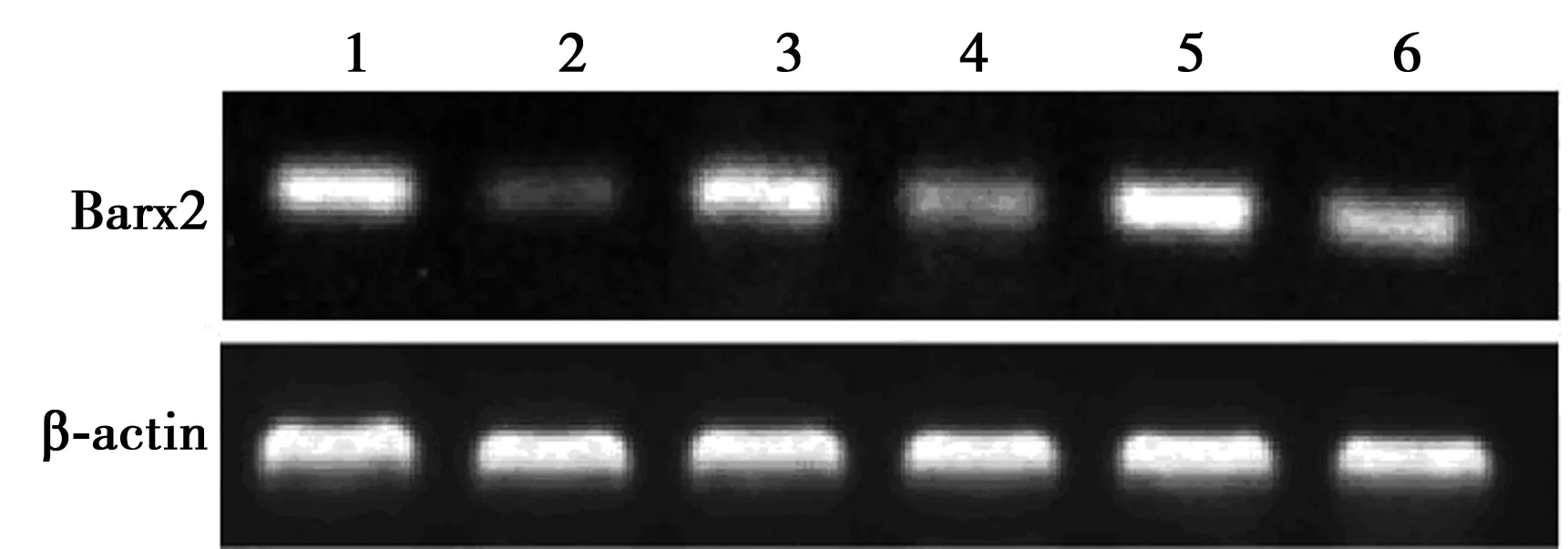
1~6:早期WT组,早期ALS组,中期WT组,中期ALS组,晚期WT组,晚期ALS组;图2、4、5同图1 RT-PCR检测脊髓中Barx2 mRNA表达

图2 Western印迹检测各组脊髓中Barx2蛋白水平表达
2.2各组脊髓内Axin2 mRNA及蛋白表达比较 RT-PCR检测结果表明,与早、中、晚期WT组(91.5±14.9、102.0±2.7、100.3±10.0)相比,早、中、晚期ALS组脊髓中Axin2 mRNA表达(24.9±3.9、71.0±13.2、68.7±8.3)明显降低(P<0.05)。Western印迹检测结果表明,与早、中、晚期WT组(78.3±6.3、86.2±8.8、76.7±2.9)相比,早、中、晚期ALS组Axin2蛋白表达(47.0±2.7、34.0±6.4、34.2±0.8)显著下降(P<0.05),见图4、图5。免疫荧光检测发现,在晚期ALS组及WT组脊髓中阳性细胞集中在灰质前角,Axin2阳性细胞均与β-tubulinⅢ标记的神经元共表达。ALS组脊髓内Axin2免疫阳性反应较WT组减弱,与Western印迹检测结果一致,见图6。
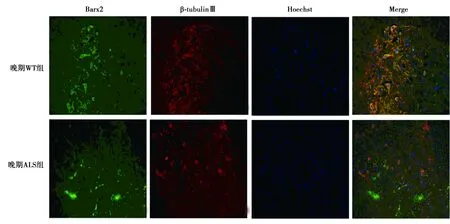
图3 免疫荧光检测晚期WT及ALS组脊髓中Barx2的表达(×200)
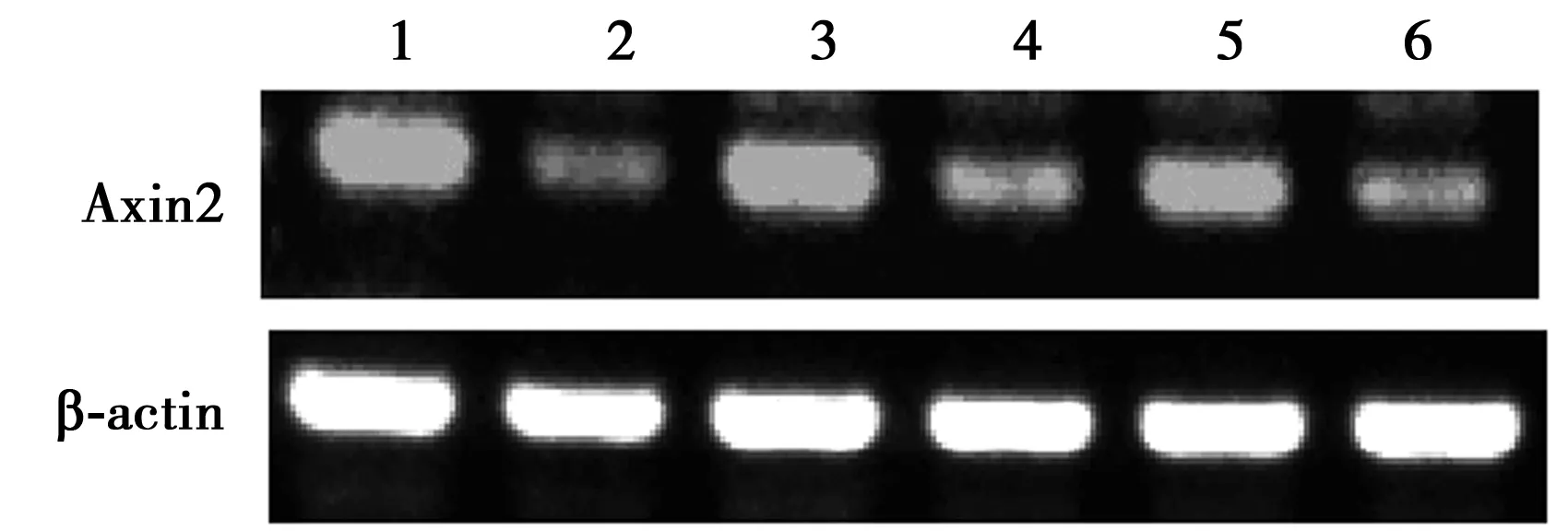
图4 RT-PCR检测各组脊髓中Axin2 mRNA表达
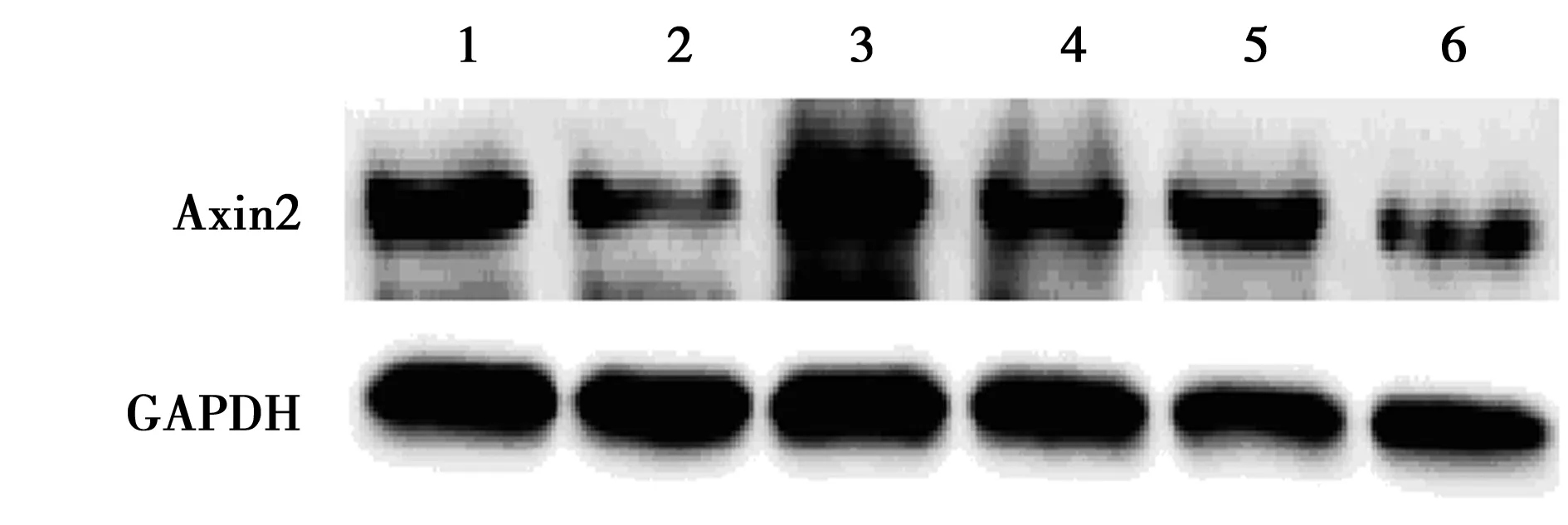
图5 Western印迹检测各组脊髓中Axin2蛋白表达

图6 免疫荧光检测晚期WT及ALS组脊髓中Axin2的表达(×200)
3 讨 论
ALS是一种影响上、下运动神经元的退行性疾病,发病机制复杂,涉及多种信号通路与多种调控因子,至今仍没有很好的治疗方法,进一步探讨ALS的发病机制与病变中的改变对于其治疗尤为重要。
Barx2是Bar类的一种新的同源盒基因,在发育过程中表达于神经和颅面结构中。有丝分裂后神经元所在的外套层、底板和背根神经节中,Barx2显著表达〔9〕。在中枢神经系统发育的过程中Barx2表现出与黏附分子(CAM)表达模式重叠的动态表达,参与转录调控神经细胞(N)-CAM启动子的区域〔10〕。有研究表明,Barx2和转录因子(Pax)6与HPD(L1基因调控区域中的一种DNA元素)特异结合在激活N-CAML1表达有重要作用,HPD通过同源域蛋白和Pax蛋白调控神经组织L1的表达,其中HPD核内的ATTA序列是与同源域蛋白Barx2结合所必需的〔11〕,提示Barx2在神经的再生与发育中发挥重要作用。同时,Chen等〔4〕发现Barx2能抑制细胞增殖、迁移,并通过有氧糖酵解抑制Wnt/β-catenin信号传导途径。Zhuang等〔12〕发现Barx2是Wnt信号通路效应复合物新的组分,其在Wnt信号通路调控中的拮抗作用可能有助于介导成肌细胞从增殖向分化转变。干扰Barx2基因能导致Wnt靶基因表达异常。有研究〔7〕证实,经典Wnt信号通路即Wnt/β-catenin信号途径与ALS发病密切相关,在ALS发病过程中,Wnt信号通路被激活。本研究中Barx2降低导致其对Wnt信号通路拮抗作用减弱,与以往研究〔7〕结果相一致。
Axin2已经被公认为是抑制糖原合酶激酶(GSK)3β介导的Snail1降解的负调控因子,是E-钙黏蛋白的转录抑制因子,Axin2还可通过β-catenin降解来阻止Wnt信号传导〔13〕。Wnt/β-catenin信号传导由3种多蛋白复合物控制,其中第一个被发现的是β-catenin破坏复合物,其核心成分包括Axin支架蛋白、肿瘤抑制基因(APC)和2种丝氨酸苏氨酸激酶〔GSK3和酪蛋白激酶(CK)1〕,该复合物在没有Wnt信号的情况下具有活性,可磷酸化β-catenin的N-末端中的特定残基,标记该Wnt效应子专用于泛素化和蛋白酶体降解,这确定了信号传导途径的关闭状态〔14〕。以往研究〔15〕发现CK1ε在ALS转基因小鼠大脑皮层中随病程进展而升高,表明CK1ε与ALS发病有密切联系,推测同为复合物核心成分的Axin2可能在ALS中也有重要作用。本研究结果表明ALS小鼠脊髓中Axin2表达下调,减弱了对Wnt信号通路的负反馈调节从而达到对Wnt信号通路的激活作用。
有研究〔16〕表明,Barx2可通过与转录因子(TCF)/β-catenin复合物的相互作用促进Axin2表达,终止对Wnt信号的应答。本研究结果显示,在ALS转基因小鼠的发病过程中,Barx2和Axin2表达均下调,推测Barx2可能通过调控Axin2影响Wnt信号通路传导参与ALS发病,但是Barx2和Axin2的关系及通过何种方式调控Wnt信号通路影响病变过程有待于继续深入研究,详细的机制也有待于通过离体实验进一步阐明。
