替考拉宁高产菌选育及发酵条件优化
2022-07-30赵鹏鹏郄丽萍马婕赵国忠米贯东任风芝姜明星
赵鹏鹏 郄丽萍 马婕,* 赵国忠 米贯东 任风芝 姜明星
(1 华北制药集团新药研究开发有限责任公司 微生物药物国家工程研究中心 河北省工业微生物代谢工程技术研究中心,石家庄 050015;2 华北制药集团华胜有限公司,石家庄 050015)
替考拉宁是与临床相关的糖肽类抗生素,由游动放线菌产生,是5个化学结构相似化合物(T-A2-1、T-A2-2、T-A2-3、T-A2-4和T-A2-5)的混合物,其中,T-A2-2是主要有效成分。替考拉宁是治疗成人和婴儿的多重耐药革兰阳性病原体引起的严重感染的一线疗法[1]。同时也是目前为数不多的临床有效活性药物之一,其未来具有广阔的应用前景。但是目前存在着产量低等问题,限制了应用。
微生物产生次级代谢产物的能力主要由微生物的遗传特性决定,遗传特性可以通过诱变来改变。目前诱变的手段有很多,如热处理、紫外照射、常压室温等离子体(atmospheric and room temperature plasma, ARTP)等。已有大量关于热处理、紫外照射等处理技术的研究[2],但是关于替考拉宁产生菌的诱变处理应用相对较少,而且处理效果并不理想。因此,我们采用了ARTP诱变技术来进行菌种选育。
ARTP诱变技术是近年来新兴的一种具有高效率特点的诱变手段,尤其是在微生物菌种改良选育领域。该技术主要是利用高浓度的活性粒子均匀地作用于微生物,从而改变细胞膜或细胞壁的结构并引起基因损伤,诱发生物细胞启动SOS修复机制,最终导致微生物基因序列及其代谢网络发生相应变化[3-4]。已有相关研究利用ARTP诱变技术来进行菌种选育工作,并且取得了一定的效果[5-6]。但是有关替考拉宁产生菌株方面的报道较少。
本研究利用ARTP诱变技术来进行替考拉宁产生菌株的选育工作,并从转速、接种量、温度和pH等因素进行了发酵工艺优化。最后,成功筛选得到了一株新的高产突变株,形成了一个新的发酵工艺,显著提高了替考拉宁的产量。这表明,ARTP诱变技术在替考拉宁产生菌菌种诱变方面拥有较大的应用潜力,发酵工艺的优化对实际工业化生产具有指导性意义。
1 仪器与试药
超净工作台(苏州安泰空气技术有限公司);ARTP-ⅡS型诱变育种仪(无锡源清天木生物科技有限公司);DELTA 320型pH计(Mettler-Toledo有限公司);Pico型高速离心机(赛默飞世尔科技有限公司);LC-2030C型高效液相色谱仪(岛津有限公司)。
替考拉宁标准样品(纯度为92.28%)。乙腈和甲醇为色谱级,其他试剂均为分析纯,水为去离子水。
替考拉宁产生菌游动放线菌(Actinoplanes teichomycetics)T19,本实验室保藏。
2 试验方法
2.1 培养基的配制[7]
固体培养基(平板、斜面培养基):精密称量可溶性淀粉20 g,K2HPO40.5 g,KH2PO40.5 g,(NH4)2SO40.5 g,NaCl 1 g,葡萄糖10 g,蛋白胨5 g,琼脂20 g,置于1000 mL量瓶中,加水溶解并定容,用6 mol/L的氢氧化钠溶液调至pH为7.2。
种子培养基:精密称量淀粉40 g,黄豆粉20 g,酵母粉5 g,蛋白胨5 g,NaCl 4 g,MgSO40.5 g,(NH4)2SO42 g,CaCO35 g,置于1000 mL量瓶中,加水溶解并定容,用6 mol/L的氢氧化钠溶液调至pH为7.2。
发酵培养基:精准称量淀粉40 g,葡萄糖20 g,NH4Cl 3 g,NaNO32 g,黄豆粉20 g,MgSO40.5 g,玉米油5 g,CaCO35 g,置于1000 mL量瓶中,加水溶解并定容,用6 mol/L的氢氧化钠溶液调至pH为7.2。
2.2 培养方法
固体培养:将保存的菌种T19(甘油管)用无菌水稀释后,涂布于平板或斜面培养基上,置于28℃培养室,培养7 d。
种子培养:从成熟斜面培养基挖块(1 cm×0.5 cm),转接到装液量为30 mL的250 mL三角瓶中,置于28℃培养室,摇床转速为220 r/min,培养2 d。
发酵培养:将培养2 d的种子液以10%的接种量转接到装液量为40 mL的250 mL三角瓶中,摇床转速为220 r/min,培养7 d。
单孢子悬液的制备:取生长状态良好的T19新鲜斜面一支,加入10 mL无菌生理盐水,用接种针刮下,玻璃珠打散,过滤,制成单孢子悬液。
2.3 抗性筛选浓度的确定
将出发菌株的单孢子悬液分别涂布于不同浓度(1、2、4、6和8 mg/mL)替考拉宁平板培养基中,在28℃培养室内,培养10 d,观察平板上菌落的生长状况,确定替考拉宁游动放线菌抗自身代谢产物替考拉宁的最小抑菌浓度。
2.4 ARTP诱变方法
取10 μL菌悬液滴加在无菌的不锈钢载片上,将载片放于诱变育种仪中,按照一定的时间进行照射处理,照射间距为2 nm。设置诱变功率为100 W,气流量为10 SLM。设置不同的处理时间分别为10、20、30、40、50、60、70、80和90 s。统计致死率、正突变率和负突变率,从而确定出最佳的诱变条件。
致死率=(未经诱变处理菌落数-经诱变处理菌落数)/未经诱变处理菌落数×100%。
正突变率=相对效价大于110%的菌落数/突变菌落数×100%。
负突变率=相对效价小于90%的菌落数/突变菌落数×100%。
2.5 遗传稳定性试验
将突变高产替考拉宁菌株连续传代5次,测定每一代突变菌株产替考拉宁的能力,从而验证突变菌株生产性能的稳定性。
2.6 发酵培养条件优化
以诱变后产量最高的菌株为实验菌株,对原始发酵培养基的培养条件进行优化。
转速:考察不同转速(200、210、220、230和240 r/min)对替考拉宁产量的影响。
接种量:考察不同接种量(2.5%、5%、7.5%、10%、12.5%和15%)对替考拉宁产量的影响。
温度:考察不同温度(24℃、26℃、28℃、32℃和34℃)对替考拉宁产量的影响。
pH:考察不同pH(5.0、5.5、6.0、6.5、7.0和7.5)对替考拉宁产量的影响。
2.7 发酵液的效价测定
发酵液的效价测定参考已有研究[8]。取发酵液3 mL,与乙醇以1:1(V:V)混匀,静置1 h,3000 r/min离心10 min,取上清液,进行HPLC分析。
2.8 分析条件
HPLC检测:C18柱(4.0 mm×250 mm,5 μm);A相0.02 mol/L乙酸铵,B相色谱级乙腈,梯度洗脱(条件见表1);检测波长254 nm,进样温度40 ℃,进样量20 μL;流速1 mL/min;tR7.3 min,tc14.6 min。
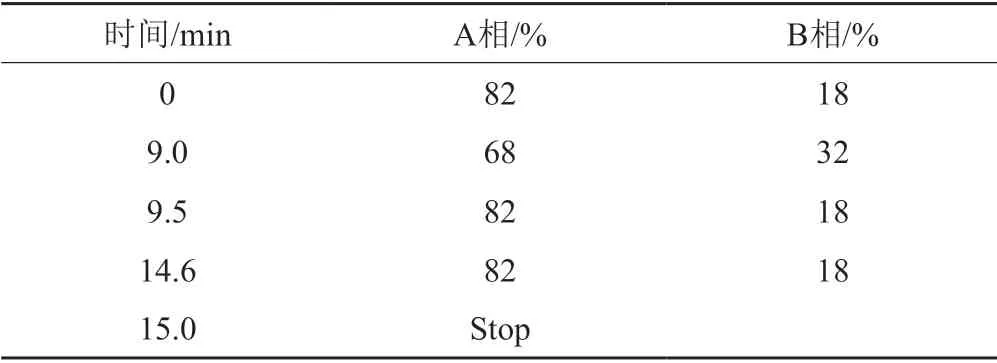
表1 梯度洗脱条件Tab.1 Gradiet elution condition
3 结果与讨论
3.1 替考拉宁抗性筛选浓度的确定
为了确定替考拉宁的抗性筛选浓度,在替考拉宁浓度为1~8 mg/mL范围内的平板上,观察T19菌落生长状况,发现菌株在1和2 mg/mL的替考拉宁抗性平板上生长状态良好,在4 mg/mL替考拉宁抗性平板上呈现微弱生长的状态,在6 mg/mL替考拉宁抗性平板上菌落完全不生长。这表明菌株T19的耐自身代谢产物替考拉宁浓度低于6 mg/mL,从而确定替考拉宁抗性筛选浓度为6 mg/mL,这与已有相关研究一致[9]。
3.2 ARTP处理时间的确定
为了确定最佳的ARTP处理时间,在固体平板培养基上涂布经ARTP诱变处理不同时间的菌悬液,在28℃培养室内培养7 d,以未诱变处理的菌悬液为对照,摇瓶筛选ARTP诱变处理不同时间的菌落,计算致死率和突变率,结果见图1。
由图1可知,随着ARTP诱变处理时间的延长,菌株T19的致死率逐渐升高,在90 s以后,致死率增加速率减慢;正突变率随着处理时间的延长呈现出先升高后降低的趋势,在90 s时达到最高值(18.4%);负突变率随着处理时间的延长呈现逐渐上升的趋势,在90 s以后,负突变率趋于平缓;综合考虑,我们确定最佳ARTP诱变处理时间为90 s。
3.3 诱变菌株摇瓶筛选
以T19菌株为出发菌株,将经ARTP处理90 s后的孢子液混匀后,梯度稀释涂布于含6 mg/mL替考拉宁平板上,挑选66株单菌落进行发酵生产替考拉宁效价分析,以出发菌株相对效价为100,计算突变株的相对效价,结果如表2所示,17株为正突变菌株(相对效价在110以上),约占28.8%;35株为未突变菌株(相对效价在90~110),约占54.5%;14株为负突变菌株(相对效价在90以下),约占16.7%。正突变率较之前的18.4%高出了10.4%,这说明抗性筛选在一定程度上降低了非正突变率菌株的比例。

表2 替考拉宁抗性突变株筛选结果Tab.2 Screening results of teicoplanin-resistant mutants
通过多次复筛之后,有4株抗性突变菌株显示出了很好的产替考拉宁能力,其发酵效价超过原始菌株T19的20%,且比较稳定,其中T190226-2的发酵的相对效价最高,达到142%,为出发菌株T19的1.42倍,见表3和图2。

表3 4株高产突变菌株的摇瓶发酵情况Tab.3 Shaking flask fermentation conditions of four highyielding mutant strains
3.4 突变菌株T190226-2的遗传稳定性考察
菌种的传代稳定性是决定其能否实现工业化生产的重要因素。采用斜面传代、摇瓶验证的方法,考察经过诱变和抗性筛选得到的这一株新的突变菌株T190226-2的传代稳定性。连续传代5代,测定每一代菌株的相对效价,结果由图3所示。从图3中可以看出,高产菌株T190226-2经稳定性传代检测,在第五代时相对效价(95.4%)稍有下降。由此可以表明,高产菌株T190226-2具有稳定的遗传特性。
3.5 诱变前后菌落形态变化
经过诱变筛选后,菌株内部的基因会发生一定的改变,从而导致其性状的一些改变。如图4所示,突变菌株与出发菌株相比,在形态上已经有了显著的差异,在固体培养基上,出发菌株经培养后,颜色为橙色,褶皱较多;突变菌株的形态与出发菌株稍有差异,颜色为肉粉色,褶皱相对较少。这一新突变菌株也是首次报道。突变菌株的生长形态发生了一定的变化,表明经过诱变及抗性筛选,菌丝内部基因可能发生了一定的变化,具体发生变化的基因还需进一步验证。
3.6 发酵培养条件优化
在摇瓶实验中,通过对转速、接种量、温度和pH等因素的考察,确定最佳培养条件。结果如图5所示。
(1)转速对发酵效价的影响:研究了不同转速(200、210、220、230、240 r/min)对菌株T190226-2发酵的影响。如图5a所示,随着转速的增加,相对效价呈现出先增长和下降的趋势,在转速为220 r/min时,发酵的相对效价最高。有研究表明[10],微生物发酵过程中所需的溶氧量各有差异,高转速可以增加发酵液中的溶解氧含量。摇瓶实验结果表明,菌株T190226-2在发酵过程中对溶氧的需求是有一定限度的。
(2)接种量对发酵效价的影响:研究了不同接种量(2.5%、5%、7.5%、10%、12.5%和15%)对菌株T190226-2发酵的影响。接种量对微生物的发酵有着重要的影响,接种量的大小也受多个因素影响,包括菌种类别、发酵条件和种子液生长状态。如图5b所示,随着接种量的增加,菌株T190226-2发酵的相对效价呈现出先增高后降低的趋势,接种量为7.5%时,相对效价达到最高值(165%)。这表明,接种量过小或过大都会影响微生物的正常生长代谢,接种量过小会引起菌体生长缓慢,无法得到饱和的菌体密度,进而影响替考拉宁的产生;接种量过大会过早可能会引起营养物质匮乏,不利于次级代谢期替考拉宁的产生。
(3)温度对发酵效价的影响:研究了不同温度(24℃、26℃、28℃、30℃和32℃)对菌株T190226-2发酵的影响。从图5c中可以看出,温度对微生物的生长发育有着重要影响[11],随着温度的升高,菌株T190226-2发酵的相对效价先增加后降低,在28℃时达到最大值。这表明菌株T190226-2具有嗜温性,温度过高会对菌株生长和替考拉宁生成产生负面影响。同时适宜的温度,也能降低发酵过程中发酵液的蒸发。
(4)pH对发酵效价的影响:初始pH对微生物发酵有着重要的影响。研究了不同pH(5.0、5.5、6.0、6.5、7.0和7.5)对菌株T190226-2发酵的影响。如图5d所示,随着pH的升高,替考拉宁的相对效价先增加后减少,在pH为6.5时,替考拉宁的相对效价达到最大值(180%)。这表明,pH过高或过低都会影响菌株的正常生长发育。
4 结论
以替考拉宁产生菌游动放线菌T19为出发菌株,通过ARTP诱变以及抗性选育等手段对替考拉宁产生菌T19进行了遗传选育研究,得到了一株新的高产突变菌株T190226-2,并且具有较好的遗传稳定性,替考拉宁的效价水平为出发菌株的142%。通过发酵条件的优化,包括转速、接种量、温度和pH等因素的考察,确定了最优的发酵条件:转速为220 r/min,接种量为7.5%,发酵培养的温度为28℃,初始pH为6.5,替考拉宁的最高发酵相对效价可达180%,较出发菌株提高了80%。这表明ARTP技术可以有效用于替考拉宁产生菌游动放线菌的选育;同时,对新菌种优化后的发酵工艺,可大幅度提高替考拉宁的产量,对其工业化生产有重要的意义。
