P53 对基于MRI 的骨关节炎间隙狭窄程度影响的临床研究
2022-07-30张双信瑞强石逸杰李艳翠彭如臣
张双,信瑞强,石逸杰,李艳翠,彭如臣
骨关节炎(osteoarthritis,OA)是一种慢性、渐进性、炎症性的关节退行性疾病,常累及膝关节、手和髋部[1]。OA 常表现为软骨破坏、骨赘增生、滑膜增生,以疼痛为主要临床表现[2]。OA 患者中以中老年患者多见,且女性患者多于男性,OA已经成为严重影响身体健康及生活质量的骨关节病[3]。然而,OA病因及发病机制尚不明确。目前的药物治疗常使用非甾体抗炎药,主要是为了改善疼痛症状,然而治疗效果有限,且有胃肠道及心血管并发症风险的副作用。手术疗法包括膝关节镜及膝关节置换,然而OA 患者往往身体状况较差,手术风险较高[4]。最近有人提倡使用微创干预治疗OA,如关节腔注射、射频消融,但治疗效果及副作用有待进一步研究。MRI是一种灵敏的无创工具,具有早期检测骨关节结构改变的能力,并可以直接可视化地关节组织结构进行量化。MRI 已成为评估OA的重要手段[5-6]。其对于OA 的发现以及诊断有很好的帮助作用,并且还能够指导后期疾病的治疗。
研究发现40%~80%的OA患者发病具有遗传性,与某些基因的突变及表达变化有很强的相关性[7]。Meyer等[8]发现细胞周围基质(pericellular matrix,PCM)在表观遗传、代谢或生物力学刺激下,通过与软骨细胞作用参与OA的发生发展。Lee等[9]发现CCL17 参与粒细胞巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)诱发OA相关信号通路,提示CCL17 阻滞剂可作为OA 及疼痛治疗的靶点分子。并且目前越来越多学者提倡个体化治疗[10]。因此,在个体化遗传基因方面探索OA的发病机制,对于预防与治疗OA具有重要临床价值。
生物信息学(bioinformatics)是利用生命科学与计算机科学技术挖掘分析生物大数据并探索疾病发病原理的一门新学科。而MRI 检查的结果能够显示关节软骨的病理变化,反映软骨组织的成分含量,在此基础上利用生物信息学结合影像分析和病例的基因分析,有效筛选疾病患者与正常个体间差异表达基因,从而发现潜在的治疗靶点。随着学科发展,越来越多研究者使用生物信息学技术研究各种疾病进程中的差异表达基因(differentially expressed genes,DEGs),并探索其在生物过程、分子机制和信号传导通路中的作用[11-13]。
本研究筛选OA 患者与正常人的DEGs,利用基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG) (https://www.kegg.jp/)对DEGs数据进行分析,同时用两组数据中所有基因进行基因集合富集分析(gene set enrichment analysis,GSEA),进而用DEGs构建蛋白—蛋白互作(protein-protein interaction,PPI)网络,同时筛选PPI网络中的重要模块并且鉴定核心基因。初步分析差异表达基因在OA 发生发展中的作用,进一步研究P53基因对基于MRI的OA间隙狭窄程度的影响。
1 材料和方法
1.1 微阵列芯片数据的获得
GSE55235 基因表达谱数据从基因表达综合数据库(Gene Expression Ominibus,GEO) (https://www.ncbi.nlm.nih.gov/geo/)中下载。GEO 是一个公共功能性基因组学数据仓库,接受基于数组和序列的数据。GSE55235 的芯片数据由10 个OA 样本和10 个对照样本的mRNA 表达谱组成。该基因表达谱由Affymetrix HG-U133A chip (Platform GPL96)生成。所有OA样本均取自OA患者滑膜组织,对照组样本取自未患关节疾病的健康个体正常滑膜组织。
1.2 差异表达基因的识别
GEO2R (https://www.ncbi.nlm.nih.gov/geo/geo2r/)是一个交互式的在线工具,用于从GEO 系列中识别差异表达基因。GEO2R可用于鉴别对照组与OA组滑膜组织标本的差异表达基因。如果一个探针集没有同源基因,或者一个基因有多个探针集,数据将被删除。筛选标准为P≤0.01,且|log(FC)|≥3。
1.3 利用GSEA进行GO和KEGG富集分析
GO是一种广泛应用于生物信息学的本体论,它涵盖了生物学的三个方面,包括细胞成分、分子功能和生物过程。KEGG是世界上最常用的生物信息数据库之一,旨在了解先进的功能和生物系统。在分子水平上,KEGG专门整合了大量来自高通量实验技术的实用程序数据库资源。GSEA可以分析两个样本组中的所有测序基因, 它的输入是一个基因表达矩阵,在这个矩阵中,基因被分成两组,所有的基因先进行测序,然后用来表示两组之间基因表达水平的变化趋势。GSEA分析在序列列表的顶部或底部是否富集了一个先验定义集的所有基因。利用GSEA软件对OA 滑膜组织和正常滑膜组织的所有测序基因进行GSEA分析,在导入基因注释文件、参考函数集和GSE55235中OA 滑膜组织和正常滑膜组织所有基因数据之后,GSEA软件会进行分析并根据运算法则进行基因测序,从而获得基因序列表, 后分析基因序列表中所有基因的位置,并将其累加得到富集分数(enrichment score,ES),对ES进行标准化处理后,通过功能富集可以全面了解基因的生物学功能。以P值<0.05为筛选标准。
1.4 PPI网络和重要模块的构建与分析
将常用的差异表达基因导入STRING (search tool for the retrieval of interacting genes) (version 10.5)(http://string-db.org)系统后,这一在线工具可以预测和跟踪PPI网络。应用免费可视化软件Cytoscape (version 3.6.1)对PPI 网络进行可视化。基于拓扑原理,Cytoscape 插件MCODE(Molecular Complex Detection) (version 1.5.1)可以发现紧密耦合区域。采用MCODE对PPI网络的各个模块进行筛选,筛选标准为degree cut-off=6,node score cut-off=0.2,当设置度≥4时,可挖掘出关键基因。利用R语言软件制作核心基因的热图谱。
1.5 患者资料
选取我院2020 年6 月至2021 年6 月收治的OA 间隙狭窄患者。纳入标准:(1)全部患者经过MRI 检查后被诊断为OA 间隙狭窄;(2)临床资料齐全;(3) 18 岁≤年龄≤80 岁;(4)凝血功能正常。排除标准:(1)具有精神疾病或认知障碍;(2)心、肝、肺功能差。本研究经过首都医科大学附属北京潞河医院伦理委员会批准(2018-LHKY-008-02),所有患者均签署了书面知情同意书。
1.6 扫描参数
使用西门子3.0 T Skyra磁共振扫描仪(德国)对全部患者进行MRI检查。扫描序列和参数如表1所示。

表1 扫描序列参数
1.7 诊断标准
根据患者的临床资料,按性别(男/女)、年龄(≤60/>60)、MMP1 (低/高)、VEGFA (低/高)、CXCL8 (低/高)、P53 (低/高)、MRI下OA 间隙狭窄程度(轻/重)进行分类。OA 间隙轻度狭窄:内外侧间隙不均衡,伴有轻度骨赘及软骨下骨硬化,下肢的机械力线轻度内移,膝关节有轻度内翻。OA 间隙重度狭窄:内外侧间隙不均衡或者一侧消失,伴有骨赘形成,软骨下骨硬化明显,下肢机械力线明显内移,膝关节严重内翻畸形。
应用关节镜诊治方法取患者滑膜组织,进行聚合酶链反应(polymerase chain reaction,PCR)检测,分析MMP1、VEGFA、CXCL8以及P53的表达水平(以均值为界,低于均值水平为低表达,高于均值为高表达)。
1.8 统计学方法
所有的统计分析使用SPSS 21.0软件。计量资料用均数±标准差表示。采用Pearson卡方检验,分析临床参数与OA间隙狭窄程度的关系。采用Spearman-rho检验将临床资料与OA间隙狭窄程度进行相关性分析。采用多因素Logistic回归分析,计算OA间隙狭窄程度各变量的OR值。P<0.05认为差异有统计学意义。
2 结果
2.1 OA差异表达基因的识别
通过GEO2R 对GSE55235 数据集的分析,可以看出火山图中对照组与OA 组滑膜组织的差异。GSE55235 的分析结果识别出91个差异表达基因(图1)。

图1 使用GEO2R 对微阵列数据(GSE55235)进行分析,火山图显示了对照组与骨关节炎组滑膜样本的差异。
2.2 对OA中差异表达基因进行GO和KEGG通路富集分析
GO富集分析显示OA中有2126/4081个基因组上调,323个基因组在名义P值<0.05时显著富集,107个基因组在名义P值<0.01时显著富集。此外,OA中1955/4081个基因组下调,481个基因组在名义P值<0.05时显著富集,212个基因组在名义P值<0.01时显著富集。此外,KEGG富集分析表明OA组与正常组滑膜样本相比,有101/168个基因组上调,18个基因组在名义P值<0.05时显著富集,9个基因组在名义P值<0.01时显著富集。OA组中67/168个基因组下调,11个基因组在名义P值<0.05时显著富集,5个基因组在名义P值<0.01时显著富集。OA相关的差异表达基因主要富集在“GO_CELLULAR_RESPONSE_TO_HYDROGEN_PEROXIDE”和“KEGG_P53_SIGNALING_PATHWAY”(图2)。
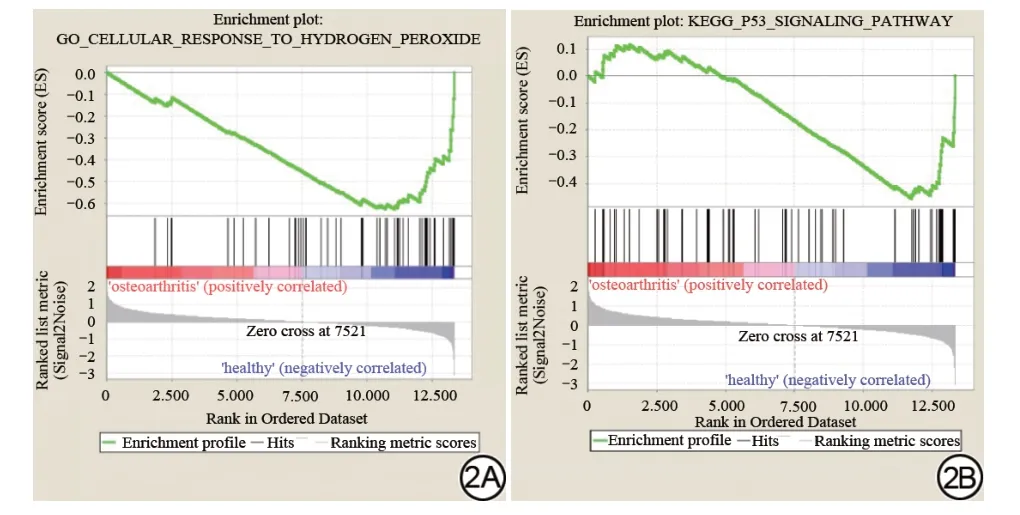
图2 利用基因集合富集分析(GSEA)对微阵列数据(GSE55235)中骨关节炎组与正常组滑膜样本间差异表达基因进行功能富集分析的2个显著富集图。2A:GO_CELLULAR_RESPONSE_TO_HYDROGEN_PEROXIDE富集图;2B:KEGG_P53_SIGNALING_PATHWAY富集图。
2.3 网络的构建及重要模块和关键基因的识别
构建PPI网络,识别显著性模块,PPI网络可以得出OA相关的差异表达基因之间具有交错复杂的关系(图3A),重要模块中有26条边和8个节点(图3B)。以Degree≥4为判断标准。通过Cytoscape 鉴定出了4 个关键基因:MMP1、CXCL8、VEGFA 和JUN(图3C)。热图显示关键基因基本可以将OA滑膜样本与正常滑膜样本区分开。与正常组对比,MMP1在OA组中高表达,CXCL8、VEGFA和JUN在OA组中低表达(图4)。

图3 使用Cytoscape构建差异表达基因的PPI(蛋白—蛋白互作)网络、重要的模块及核心基因网络。3A:PPI 网络;3B:使用MCODE 鉴定的重要模块;3C:核心基因网络。

图4 微阵列数据(GSE55235)中对照组与骨关节炎(OA)组滑膜样本关键基因的层次聚类热图。X 轴表示样本符号(从左至右为10 个对照组滑膜组织样本和10个OA组滑膜样本),Y轴表示差异表达探针。低表达:浅蓝色;中表达:浅紫色;高表达:紫色。
2.4 Pearson卡方检验OA间隙狭窄程度与临床参数的相关性
MRI 观察OA 间隙狭窄影像如图5 所示。通过Pearson 卡方检验显示了OA 间隙狭窄程度与相关临床因素的关系。在个体中,P53 (P=0.003)与OA 间隙狭窄程度显著相关。然而,性 别(P=0.536)、年 龄(P=0.258)、MMP1 (P=0.402)、VEGFA (P=0.768)、CXCL8 (P=0.555)和OA 间隙狭窄程度之间没有显著的相关性(表2)。
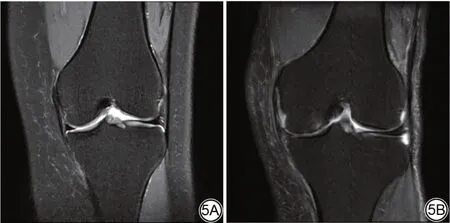
图5 MRI 观察下骨关节炎间隙狭窄影像。5A:女,49 岁,膝关节不适半年,冠状位FS T2WI 示内外侧关节间隙不等,内侧关节间隙轻度狭窄;5B:女,79 岁,膝关节疼痛1 年,冠状位FS T2WI 示内外侧关节间隙不等,内侧关节间隙重度狭窄。
2.5 Spearman 相关性分析进一步检验OA 间隙狭窄程度与临床参数的关系
为了确认相关临床参数对OA 间隙狭窄程度的作用,本研究进行了进一步的相关性分析。Spearman 相关系数显示P53 (ρ=-0.422,P=0.002)与OA 间隙狭窄程度显著相关。然而,性别(ρ=-0.088,P=0.545)、年龄(ρ=0.160,P=0.267)、MMP1(ρ=0.119,P=0.412)、VEGFA (ρ=-0.040,P=0.774)、CXCL8 (ρ=-0.084,P=0.564)、P53 (ρ=-0.422,P=0.002)与OA 间隙狭窄程度无显著相关性(表2)。
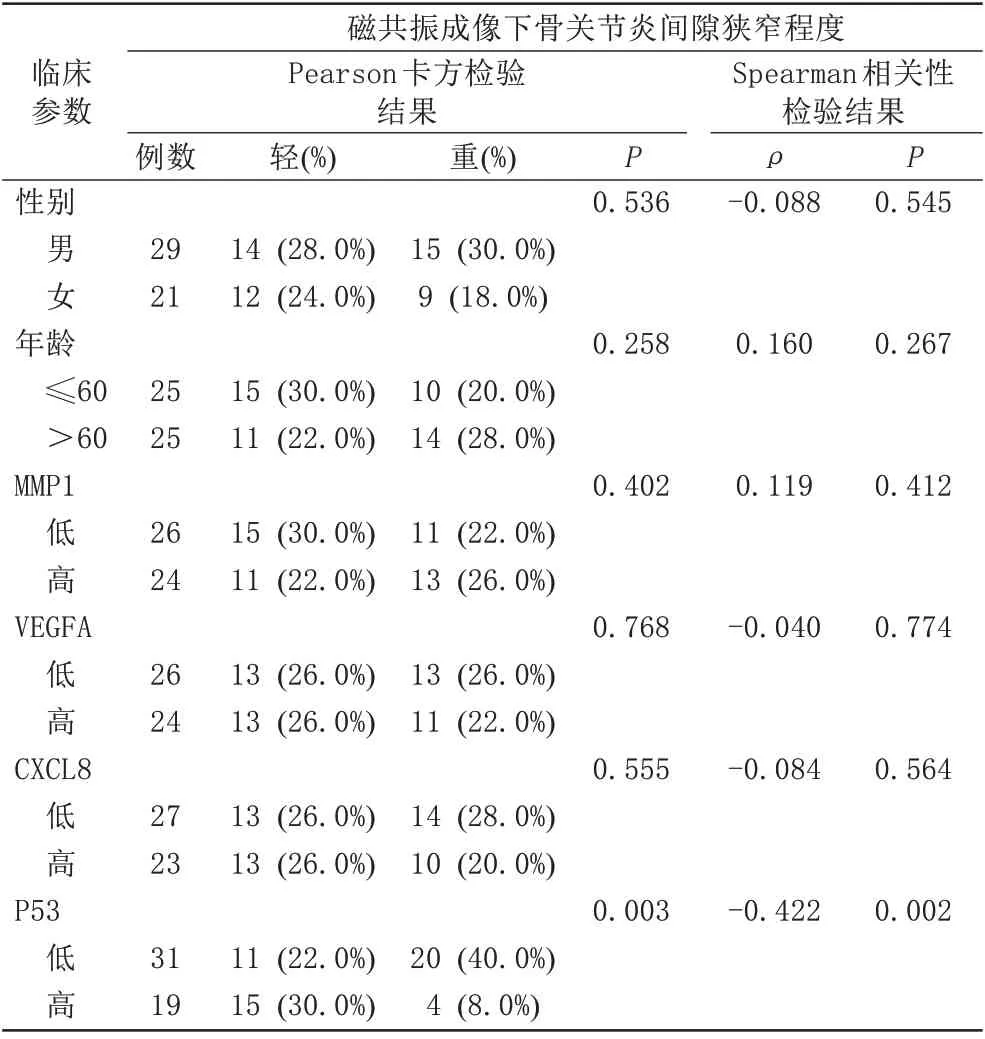
表2 Pearson卡方检验、Spearman相关性分析骨关节炎间隙狭窄程度与临床参数的相关性
2.6 多因素Logistic回归分析OA间隙狭窄程度的相关因素
应用多因素Logistic回归描述研究对象在多因素水平上的OR 和95%CI,回归分析显示,P53 (OR=0.112,95%CI: 0.025~0.495,P=0.004)与OA间隙狭窄程度显著相关,而性别(OR=0.584,95%CI:0.130~2.610,P=0.481)、年 龄(OR=3.498,95%CI:0.814~15.028,P=0.092)、MMP1 (OR=2.030,95%CI:0.479~8.597,P=0.336)、VEGFA (OR=0.564,95%CI:0.139~2.292,P=0.423)、CXCL8 (OR=0.487,95%CI:0.109~2.186,P=0.348)与OA间隙狭窄程度无显著相关性(表3)。

表3 多因素Logistic比例回归分析骨关节炎间隙狭窄程度的相关因素
3 讨论
本研究通过生物信息学分析广泛用于筛选疾病患者与正常个体间差异表达基因与分子,从而为选择治疗靶点提供可靠方法及依据。通过提取OA患者与正常滑膜样本间的差异表达基因,利用MRI技术,对组织样本进行鉴别,滑膜和软骨都与OA有着紧密的联系,然而在本研究中对于滑膜组织的分析并不能完全取代关节软骨。本研究通过OA的基因表达谱,利用生物信息学分析筛选了DEGs。DEGs基因集富集分析全面概述了OA的一些主要病理生理机制:细胞对过氧化氢的反应、P53信号通路。临床统计结果表明P53与OA间隙狭窄程度显著相关,而性别、年龄、MMP1、VEGFA、CXCL8与OA间隙狭窄程度无显著相关性。为OA的治疗发展提供了P53这一潜在靶点。
3.1 MRI检查对早期OA治疗的优势
OA是一种以疼痛及骨关节功能退化为主要表现的临床慢性疾病[14]。目前OA发病机制尚未阐明,治疗主要针对疼痛症状,然而治疗效果不理想,且耗费大,严重影响了OA患者的生活质量和预期寿命。另外OA的相关机制研究及治疗假说仍需要进一步研究。随着MRI检查技术的不断发展完善,其在OA的诊断当中显示出巨大作用[15]。在大多数国家,MRI检查多在疑似OA患者中进行[16]。MRI具有高分辨率、多参数、多平面的优势。它不仅能够直接、全面地显示关节及其软骨的早期微小病变,而且对于软组织的分辨率高,能够清晰地显示关节周围的软组织,比如关节囊、韧带、滑膜等的早期病变[17-18]。MRI检查尤其对液体极为敏感,能够发现关节腔内的少量液体[19]。MRI检查可以更准确地发现韧带滑膜的早期损伤,对OA的早期诊断有很大帮助[20]。因此,探讨OA发生发展的分子机制,有利于OA患者的早期筛查、诊断及治疗,是降低OA发病率的有效方式之一。
3.2 细胞对过氧化氢的反应与OA的发生发展关系
细胞对过氧化氢的反应作为细胞重要功能参与机体多种生理活动。Tiku等[21]发现活性氧通过影响软骨细胞脂质过氧化氢参与OA 发病。Jovanovic 等[22]发现一氧化氮能作用于过氧化氢等氧化物质诱导关节滑膜细胞死亡进而诱发OA。Khan用过氧化氢处理关节软骨发现,高水平的氧化应激能引起软骨组织局部基因表达改变,这些异常表达的基因与关节退化和关节炎相关,提示氧化刺激在OA 发病中扮演重要作用[23]。另外Goutas 等[24]发现OA 软骨细胞对氧化损伤的自噬反应降低,提示过氧化氢等氧化刺激引起OA 的机制仍待进一步研究。与上述研究结果一致,本研究通过生物大数据分析发现OA软骨组织中细胞对过氧化氢的反应表达明显上调。我们推测氧化刺激通过某些信号通路促进了OA 的发生发展,并可能作为潜在的治疗靶点,相关分子机制值得进一步探索。
3.3 P53作为OA治疗过程潜在靶点的验证
P53信号通路是机体相当重要的一条信号通路,参与机体多种生理活动。Slattery等[25]发现P53信号通路激活可引起某些miRNAs异常表达,进而通过影响细胞周期、凋亡、血管生成参与肿瘤的发生发展。Yang等[26]同样发现P53信号通路在调节细胞周期、维持机体正常免疫应答、组织修复及器官功能等方面具有重要作用。Seemayer等[27]发现P53信号通路激活参与类风湿关节炎滑膜成纤维细胞(RASF)体内和体外的功能反应。另外,Yan等[28]发现P53乙酰化状态改变参与miR-34a对SIRT1/P53信号通路的直接调控,进而影响OA的发生发展。Yang等[29]通过对OA患者软骨组织测序发现,lncRNA-ROR在mRNA和蛋白水平上均抑制P53的表达;进一步研究发现lncRNA-ROR通过HIF1α和P53调控软骨细胞的凋亡和自噬;有研究提示lncRNA-ROR在OA发病机制中起重要作用并能作为潜在的治疗靶点,P53在其中扮演的具体作用值得进一步研究。最近有研究报道透明质酸(HA)和富血小板血浆(PRP)关节腔注射对OA的个体化治疗效果好,Chiou等[30]发现ROS、P53、MMP1在治疗过程中发挥重要作用。Li等[31]发现硫酸软骨素镁(MGCS)能有效地促进OA软骨细胞的增殖,减少软骨细胞的凋亡,在此过程中凋亡相关基因P53表达下调起到重要作用。有研究表明,P53 的上调在OA 诱导的持续性疼痛中也起着重要作用[32]。软骨细胞衰老被认为在OA的发展中发挥重要作用,而P53的激活被认为是衰老调控的重要步骤[33],可能对于OA具有治疗作用[34]。与上述研究结果一样,本研究通过对比OA患者软骨组织与正常组织发现,OA 患者软骨组织KEGG_P53_SIGNALING_PATHWAY的表达明显下调,提示P53信号通路很可能参与了OA的发生与发展,并能作为潜在的治疗靶点。
3.4 本研究的不足及展望
尽管本研究进行了严谨的生物信息学分析,但仍有不足。本文仅是进行了生物信息学数据分析和临床样本验证,没有进行动物实验的综合验证。在今后的研究中,应增加生物信息学技术的临床样本种类和数量,另外进行动物实验相关的综合验证,增加研究的可信度。
综上所述,生物信息学技术可作为预测OA 进展、探讨OA发生发展机制的有效工具。MRI有利于OA患者早期的诊断与治疗,并降低OA 发病率。另外,OA 患者与正常人软骨组织之间存在差异表达基因,其可能参与OA 发生发展的相关机制,特别是“细胞对过氧化氢的反应、P53 信号通路”能为OA 的诊断和治疗提供新的研究靶点。P53 在OA 患者中低表达,可能作为其预测和治疗的潜在靶点。
作者利益冲突声明:全体作者均声明没有利益冲突。