肠杆菌Enterobacteria sp. X57 富集铀(Ⅵ)的初探
2022-07-29李飞泽杨远友杨吉军廖家莉
曾 倩,朱 婷,2,李飞泽,杨远友,杨吉军,兰 图,廖家莉,*,刘 宁
(1.四川大学 原子核科学技术研究所 辐射物理及技术教育部重点实验室,四川 成都 610064;2.四川大学 生命科学学院 生物资源与生态环境教育部重点实验室,四川 成都 610064)
作为核能利用中最主要的元素之一,铀(U)具有较强的化学和放射性毒性[1-3]。相关研究[4-6]表明,铀在进入生物体后会引起肾功能衰竭、DNA损伤、酶失活等诸多问题。随着核能与核技术的开发,无论是在前端的铀矿开采,还是后续的放射性废物处理处置,铀都会不可避免地迁移至环境[2-8],并随食物链逐渐富集,最终威胁到人类的生命健康[1]。在当前众多的铀污染环境修复方法中,微生物修复法具有独特优势[6-7]。首先,微生物具有比表面积大、生物转化效率高、环境适应性强等特点,其表面存在丰富的活性位点,可高效富集环境中的金属离子[6-10],被认为是替代传统的物理和化学材料的一种低廉、环保且高效的修复材料[3,6-7]。其次,微生物还可通过生物还原、沉淀以及矿化等更复杂的机制直接或间接地改变环境中铀的溶解度,实现对铀的长期原位固定[10-17]。因此,国内外学者近年来开展了大量关于微生物与铀相互作用的研究,以期利用微生物对铀的富集特性实现铀污染环境的原位修复。研究发现,细菌、真菌以及单细胞藻类等绝大部分微生物均具有富集铀的能力,但不同类型的微生物对铀的富集行为可能并不一致[10-11]。如Gadd课题组[13]监测了A.Niger和P.javanicus等真菌在含铀培养基中的生长过程,发现U(Ⅵ)被转化为难溶的晶矿形式沉积在菌丝基质上。Suzuki等[14]也发现Desulfosporosinusspp.可使溶液中的U(Ⅵ)以UO2纳米颗粒的形式析出。王铁山课题组[15]的研究则表明,除吸附作用外,S.cerevisiae还可通过生物代谢活动刺激铀的矿化。本课题组[16-17]在近期开展的铀与Bacillussp. dwc-2相互作用研究中发现,该菌可通过调控生物吸附、还原、矿化沉积等不同的生物机制实现多种环境条件下对U(Ⅵ)的富集。

基于此,本文从某铀污染场所分离出一株新型肠杆菌Enterobactersp. X57,对其进行研究,考察相关环境影响因素和微生物活性对其富集铀行为的影响。在此基础上,利用动力学分析和傅里叶红外光谱(FT-IR)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)、能谱(EDS)及X射线衍射(XRD)等多种分析手段进一步探索铀在Enterobactersp. X57中的富集机制,以寻找对铀具有较高耐受性和富集能力的新型微生物。
1 实验
1.1 主要试剂及仪器
1) 菌体分离与培养
Enterobactersp. X57菌分离自我国西南地区某铀污染场所排污口土壤。在铀的胁迫下,利用改良的Luria-Bertani (LB)琼脂培养基(5 g/L 酵母粉、10 g/L 胰蛋白胨、10 g/L NaCl、15 g/L 琼脂以及100~400 mg/L硝酸铀酰)对土壤中的微生物进行培养、分离以及纯化。提取纯化菌株的基因组DNA进行16S rRNA测序分析。序列对比结果显示,Enterobactersp. X57与EnterobacterHormaecheisubsp.hoffmannii.菌最接近,相似度约为99.5%。
实验所需菌体的制备方法如下:将Enterobactersp. X57接种于灭菌的LB液体培养基中,30 ℃下培养约20 h,以5 000 r/min、10 min离心收集菌体,并用无菌水多次洗涤。将获得的菌体等量分为若干份,活菌于4 ℃中保存,死菌则分别通过高温加热(85 ℃、30 min)和超声破碎(70%功率、6 s间隔、3 s脉冲、60 min)两种方式灭活制得。
2) 铀溶液配制
将U3O8(纯度≥99.5%,湖北楚盛威化工有限公司)在850 ℃下煅烧30 min后密封,存于干燥塔内。称取适量预处理过的U3O8,用浓硝酸进行多次消解,直至固体溶解完全。加入硝酸酸化水稀释,制成pH=2.00的1 g/L硝酸铀酰储备液[23]。其余化学试剂除特别说明外均为市售分析纯。
3) 主要仪器
ZQLY-180GF振荡培养箱,上海知楚仪器有限公司;pHs-3C型pH计,上海雷磁仪器厂;TG16G离心机,湖南凯达科学仪器有限公司;Optima 8000型电感耦合等离子体发射光谱仪(ICP-OES),美国PerkinElmer;IRTracer-100型傅里叶变换红外光谱仪(FT-IR),日本Shimadzu;SU8000型扫描电子显微镜(SEM)、HT7700型透射电子显微镜(TEM),日本Hitachi;XRD-6100型X射线衍射仪(XRD),日本Shimadzu。
1.2 铀富集
将1 g/L的硝酸铀酰储备液稀释至实验所需浓度,添加10 mmol/L 甘油磷酸钠(C3H6NaO7P,SGP)作为菌体生存的唯一磷源和碳源。随后,用0.1 mmol/L NaOH或HCl溶液调整溶液pH值。溶液经真空膜过滤法灭菌后,在无菌环境中添加1 g/L(干重)的菌体,进行恒温振荡培养。为扣除其他非生物因素对铀富集的影响,另设了对照组,对照组中除不添加菌体外,其余条件均与实验组一致。分别考察接触时间(t)、初始pH值、初始U(Ⅵ)浓度(c0)、温度(T)、无机离子及生物活性对Enterobactersp. X57富集铀的影响。
培养一定时间后,以10 000 r/min离心分离固液相。用ICP-OES测定上清液中U(Ⅵ)的浓度(ct)。对离心收集的菌体用无菌纯水洗净后,分别进行真空冷冻干燥和3.0%戊二醛溶液低温固定处理。
1.3 表征
对于冷冻干燥后的菌体,将其置于玛瑙研钵中研磨成粉后进行FT-IR和XRD分析。对于经戊二醛预固定处理的菌体,用30%、50%、70%、80%、90%、95%、100%的乙醇对其进行梯度脱水,每次10 min。然后用超临界CO2干燥样品,采用SEM对其进行分析。用于TEM分析的菌体在预固定后还需进行包埋、切片、染色以及干燥处理。
1.4 数据处理
按照式(1)、(2)计算菌对U(Ⅵ)的富集率R以及富集量qt:
R=(c0-ct)/c0×100%
(1)
qt=(c0-ct)/ccell
(2)
式中:ct为t时刻的U(Ⅵ)浓度,mg/L;qt为t时刻菌体对铀的总富集量,mg/g(干重);ccell为溶液中添加的菌体浓度,g/L(干重)。
采用Origin软件进行数据处理分析;采用Visual MINTEQ 3.1软件模拟铀的存在形态。
2 结果与讨论
2.1 Enterobacteria sp. X57富集U(Ⅵ)的影响因素
1) 接触时间
c0=100 mg/L、ccell=1 g/L、初始pH=7.00、T=303 K条件下,接触时间对Enterobacteriasp. X57富集U(Ⅵ)的影响示于图1。由图1可知,对照组中铀的浓度几乎没有变化,而实验组的富集率随时间增大,说明实验组中U(Ⅵ)浓度的降低全部归因于菌体对铀的富集。Enterobacteriasp. X57对U(Ⅵ)的富集率随接触时间的增加而不断增加。在最初的4 h内,溶液中的U(Ⅵ)被菌体快速富集,随后富集速率逐渐减慢,约在20 h时逐渐趋于表观平衡。此时菌体对U(Ⅵ)的富集率约为96.58%。Enterobacteriasp. X57对U(Ⅵ)的富集过程较为缓慢,这可能与微生物对铀的应激响应机制有关[11]。已有研究表明,微生物与U(Ⅵ)接触后,会自发启动一系列生物响应机制以抵抗或缓解铀的毒性,从而在一定程度上对U(Ⅵ)产生排斥[1]。但随着菌体自身防御性能的逐渐减弱,溶液中的U(Ⅵ)仍不可避免地缓慢富集在细胞上。

图1 接触时间对Enterobacteria sp. X57富集铀(Ⅵ)的影响Fig.1 Effect of contact time on U(Ⅵ) enrichment by Enterobacteria sp. X57
为进一步了解Enterobacteriasp. X57对U(Ⅵ)的富集过程,采用准一级动力学模型、准二级动力学模型和粒内扩散模型对该过程进行评估,相关方程的线性表达式示于式(3)~(5):
ln(qe-qt) =lnqe-k1t
(3)
(4)
qt=kdit1/2+Ci
(5)
式中:qe为平衡时对铀的富集量,mg/g;k1(min-1)和k2(g/(mg·min))分别为准一级和准二级动力学模型的速率常数;Kdi为粒内扩散模型速率常数,mg/(g·min0.5);Ci为边界层厚度决定的常数,mg/g。
Enterobacteriasp. X57富集U(Ⅵ)的准一级动力学和准二级动力学模型拟合参数列于表1。由表1可见,其相关系数R2分别为0.927 3和0.999 8,且准二级动力学模型的理论富集量qe,cal与实验测得的富集量qe,exp非常接近,表明准二级动力学模型可更好地描述Enterobacteriasp. X57对U(Ⅵ)的富集过程。通常情况下,准二级动力学模型假设反应速率由固体表面未被占有的反应空位数的平方值决定,即整个过程由化学反应控制[8-9],因此可认为Enterobacteriasp. X57与U(Ⅵ)之间发生了电子共用或电子转移。

表1 Enterobacteria sp. X57富集U(Ⅵ)的动力学参数Table 1 Kinetics parameter of U(Ⅵ) enrichment by Enterobacteria sp. X57
注:qe,cal和qe,exp分别为理论和实验富集量
粒内扩散模型的拟合结果示于图2。由图2可见,该生物对U(Ⅵ)的富集过程由3条不过原点的线性部分构成,各部分依次代表溶液中的U(Ⅵ)与菌体快速络合的传质阶段、U(Ⅵ)在菌体中的跨膜扩散阶段以及U(Ⅵ)在胞内的缓慢反应阶段。这一结果表明粒内扩散不是控制U(Ⅵ)在Enterobacteriasp. X57上富集的唯一限速步骤。

图2 Enterobacteria sp. X57富集U(Ⅵ)的粒子内扩散模型拟合结果Fig.2 Fitting plot of U(Ⅵ) enrichment by Enterobacteria sp. X57 with intra-particle diffusion model
2) pH值
c0=100 mg/L、ccell=1 g/L、T=303 K、t=1 440 min条件下,溶液初始pH值对Enterobacteriasp. X57富集U(Ⅵ)的影响示于图3。由图3可见,初始pH=7.00时,Enterobacteriasp. X57对U(Ⅵ)的富集率最高,溶液偏酸或偏碱均不利于Enterobacteriasp. X57对U(Ⅵ)的富集,且在酸性条件下,pH值的影响更显著。

图3 pH值对Enterobacteria sp. X57富集铀(Ⅵ)的影响Fig.3 Effect of pH on U(Ⅵ) enrichment by Enterobacteria sp. X57
3) 温度
c0=100 mg/L、ccell=1 g/L、pH=7.00、t=1 440 min条件下,温度对Enterobacteriasp. X57富集U(Ⅵ)的影响示于图5。由图5可见,在293~313 K温度范围内,随着温度的升高,Enterobacteriasp. X57对U(Ⅵ)的富集速率以及富集量均显著提升。当温度由293 K升至303 K时,菌体中U(Ⅵ)的富集量增加了约18.37 mg/g,而当温度进一步提高至313 K时,平衡时间由20 h缩短至6 h左右,但对U(Ⅵ)的富集量无显著提升。富集效果的提升可能是由于较高的温度增强了细胞的表面活性和溶液介质的动能[16]。为贴近环境温度并保证菌体活性和对铀的富集效果,后续研究仍在303 K下进行。
4) 初始铀浓度
ccell=1 g/L、pH=7.00、T=303 K、t=1 440 min条件下,初始U(Ⅵ)浓度对Enterobacteriasp. X57富集U(Ⅵ)的影响示于图6。由图6可见,初始U(Ⅵ)浓度对Enterobacteriasp. X57富集U(Ⅵ)的影响呈两个不同的变化趋势。在一定范围内,初始铀浓度的升高可能增加了铀与单位质量菌体之间相互作用的机会,使得铀的富集量不断升高。因此当初始浓度为25~200 mg/L时,菌体中U(Ⅵ)的富集量也随铀浓度的升高而不断增加。但过量的铀可能会引起物生物的急性应激响应,破坏细胞结构或致菌体死亡[1,11,20]。因此当U(Ⅵ)浓度高于200 mg/L时,Enterobacteriasp. X57对U(Ⅵ)的生物富集能力随浓度的升高而显著下降。U(Ⅵ)浓度为200 mg/L时,Enterobacteriasp. X57对铀的最大富集量约为175.52 mg/g(干重)。该结果与文献报道的Bacilluscereus12-2[12]、Bacillusthuringiensis016[21]、Kocuriasp.[22]等天然细菌在相同U浓度条件下对U的富集容量(170~200 mg/g)相当。整体上,Enterobacteriasp. X57具备较好的U污染环境修复的潜力。

图6 初始铀浓度对Enterobacteria sp. X57富集铀(Ⅵ)的影响Fig.6 Effect of initial uranium concentration on U(Ⅵ) enrichment by Enterobacteria sp. X57
5) 共存离子


图7 共存离子对Enterobacteria sp. X57富集铀(Ⅵ)的影响Fig.7 Effect of coexistence ion on U(Ⅵ) enrichment by Enterobacteria sp. X57
6) 微生物细胞活性
c0=100 mg/L、ccell=1 g/L、pH=7.00、T=303 K、t=1 440 min条件下,U(Ⅵ)在不同生物活性Enterobacteriasp. X57中的富集行为示于图8。由图8可见,与活菌相比,灭活后的菌体对铀的富集量有所降低,且不同灭活处理的菌体对U(Ⅵ)的富集行为存在一定差异。菌体经高温热灭活后,细胞出现了少量的自溶,导致菌体对U(Ⅵ)的富集量一定程度降低,且由于细胞完全失活,不再具备抵抗外界胁迫的作用,使得U(Ⅵ)在菌体中快速富集,约4 h达到平衡。已有研究也证实,微生物对金属离子的生物吸附不依赖细胞的代谢活性[15],相反,对于具有相同完整细胞结构的低活或死亡菌体,其表现出的吸附性能更佳[7,9,11]。而对于超声灭活的菌体,绝大部分菌体被瓦解成细胞碎片,其对铀的富集量也随之降低。考虑到超声处理后,胞内流出物仍保留了一定的生物活性,这些物质也可能与U(Ⅵ)络合形成可溶性的化合物[12],一定程度上影响了细胞碎片对U(Ⅵ)的富集。

图8 细胞活性对Enterobacteria sp. X57富集铀(Ⅵ)的影响Fig.8 Effect of activity of Enterobacteria sp. X57 on U(Ⅵ) enrichment
2.2 Enterobacteria sp. X57富集U(Ⅵ)的机理分析
1) FT-IR分析

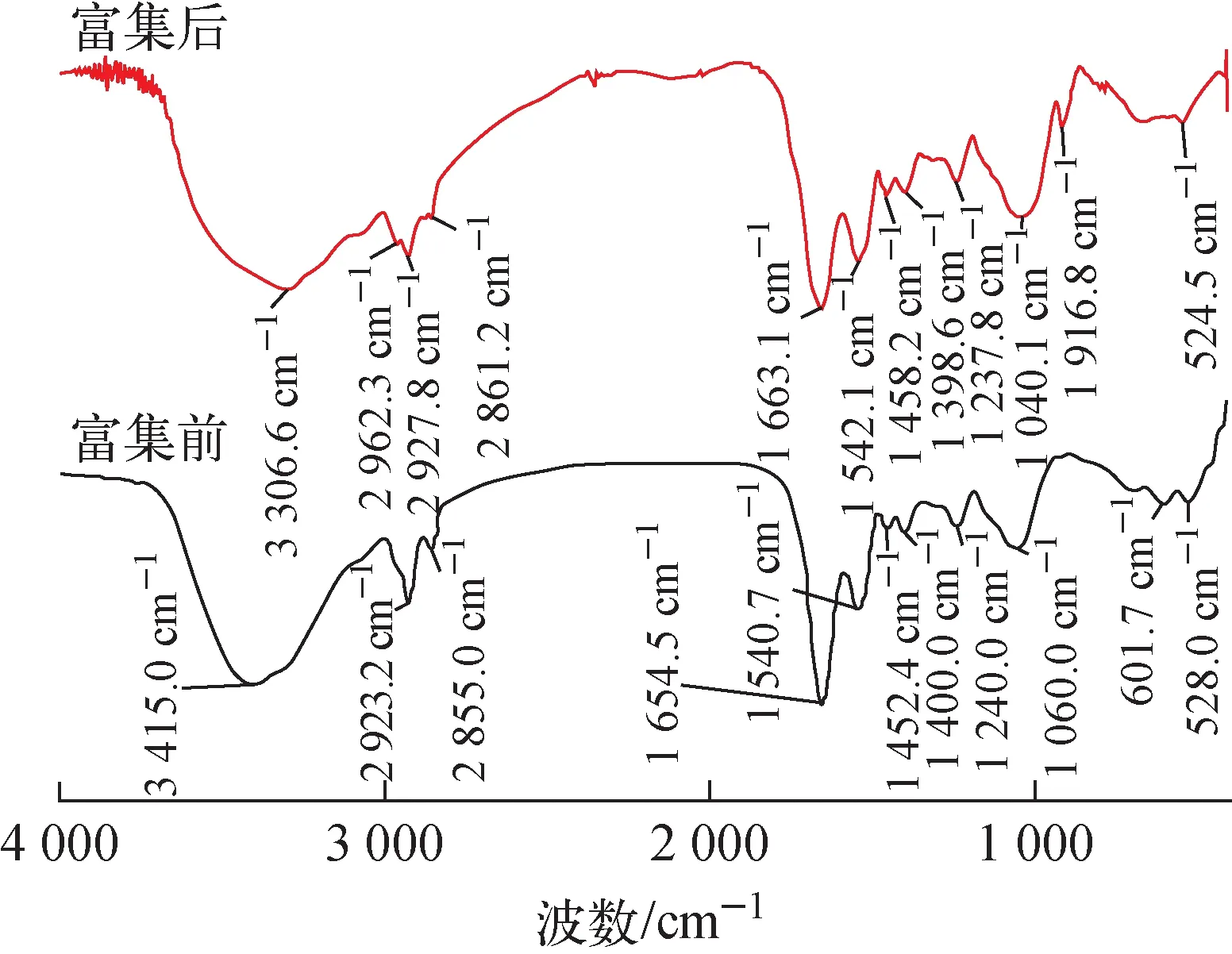
图9 Enterobacteria sp. X57的FT-IR谱Fig.9 FT-IR spectrum of Enterobacteria sp. X57
2) 电镜分析
为进一步掌握U(Ⅵ)在Enterobacteriasp. X57中的分布以及富集过程中菌体的形貌变化,采用SEM、TEM和EDS对富集铀前后的菌体进行了分析,结果如图10所示。从图10a、d可看出,富集前菌体细胞表面光滑,呈饱满杆状。富集后,细胞质皱缩、细胞结构塌缩,且在细胞周质空间和细胞质内观察到长为100~200 nm的针状沉积物(图10b、e)。EDS能谱证实,这些沉积物中含有U、P、C、O、N等元素(图10c、f),表明Enterobacteriasp. X57具有将U(Ⅵ)胞内沉积的能力。铀作为一种非生命必需元素,目前尚无研究表明微生物中存在铀的受体[1,11]。因此,普遍认为U(Ⅵ)是通过其生物毒性破坏了细胞膜的选择通透性,从而扩散至胞内。

a,d——富集前SEM与TEM图像;b,e——富集后SEM与TEM图像;c,f——富集前后EDS分析结果
3) 铀沉积物的XRD分析
利用XRD进一步分析细胞中铀沉积物的结构及组成,Enterobacteriasp. X57的XRD谱示于图11。由图11可发现菌体在富集铀后出现了几个主要的晶体衍射峰,通过与ICDD数据库的标准卡片对比可知,相关衍射峰可归属为磷铵铀矿(NH4UO2PO4·3H2O, PDF #33-0085)。这一结果表明,Enterobacteriasp. X57细胞中的针状沉积物极有可能为铀-磷酸盐矿物,即除表面络合和静电吸附外,Enterobacteriasp. X57还可通过磷酸盐矿化富集溶液中的U(Ⅵ)。在微生物诱导铀矿化的研究中,微生物的磷酸盐代谢被视为细胞对铀的解毒机制之一[11],但其具体过程及机制仍有待进一步研究。

图11 Enterobacteria sp. X57的XRD谱Fig.11 XRD pattern of Enterobacteria sp. X57
3 结论