基于风险监测的药品生产质量监管方法研究
2022-07-29陈锋
陈锋
国家药品监督管理局信息中心
一、研究背景
当前监管部门在主动发现药品生产质量风险与问题的方面能力仍存在明显短板。按照“四个最严”的要求,党中央、国务院有关部门陆续印发了系列重要文件:2018年印发《关于改革和完善疫苗管理体制的意见》;2019年印发《疫苗管理法》,并修订《药品管理法》;2021年印发《关于全面加强药品监管能力建设的实施意见》;2021年印发《“十四五”国家药品安全及促进高质量发展规划》。上述法规文件均对强化药品生产质量动态持续监管提出明确要求。面对这些要求,监管部门面临巨大挑战:监管人员数量、专业能力、监管手段、设施设备与产业发展、科技进步、风险防控需求不匹配,必须创新监管方式方法。
当前,部分省级药品监管部门对药品生产质量监管创新进行了不同程度的探索。但总的来看,相关工作尚缺乏系统化的方法论,缺乏开展监管创新的技术标准和业务规范,也缺乏推进工作的业务模式和制度保障,急需进一步开展研究和探索,为系统化、集约化、规范化推进药品生产质量监管创新奠定基础。
二、基于风险监测的药品生产质量监管目标定位
1.在质量源于设计理念指导下开展风险治理
按照质量源于设计的理念[1],在药品研发与设计阶段,即确立药品生产质量的关键风险点,作为今后质量改进、质量控制和质量监管的重要依据。按照风险治理理念,药品生产质量监管需尽可能覆盖药品生产全过程关键风险点。
2.落实企业主体责任和政府监管责任
生产企业作为药品质量第一责任人,应履行对药品生产质量的持续改进和控制。监管部门履行监督职能,主动监测、发现企业药品生产质量风险,并采取法律措施。政府部门基于风险监测的监管行为,不替代企业自身质量控制责任。
3.遵循科学性、合法性、经济性、保密性原则
推行基于风险监测的监管,要体现科学性、合法性、经济性、保密性原则。所采用的方法要经过科学论证;所采取的行为要有法律依据;在经济上可行,不增加企业不合理的成本;不泄露企业商业机密。
三、基于风险监测的药品生产质量监管方法研究
《ICH Q9 质量风险管理附录Ⅰ》列举了可能用于行业及监管机构的质量风险管理的9 类主要方法和工具[2]:基本风险管理简化方法,失效模式与影响分析(FMEA),失效模式、影响和关键性分析(FMECA),过失树分析(FTA),危害分析和关键控制点(HACCP),危害源可操作性分析(HAZOP),初步危害源分析(PHA),风险排序和筛选,支持性统计学分析工具[3]。结合实际应用场景,重点选择HACCP、统计过程控制图和过程能力分析工具来监测和预警药品生产质量风险。
1.HACCP
HACCP 是确保产品质量、有效性及安全性的系统性、主动性及预防性工具,是一种结构化方法,应用技术和科学原理来分析、评估、预防及控制因产品设计、开发、生产及使用所致的危害源风险或不利后果。在对产品及工艺的理解足够全面,足以支持关键控制点的识别时,HACCP 最能发挥价值,其分析输出的风险管理信息,不仅在生产工艺中,在其他生命周期阶段,都有助于对关键点进行监测。
HACCP 由以下7 步组成:①进行危害源分析并为过程的每一步确定预防性措施。②确定关键控制点。③设立关键控制限度。④建立关键控制点的监控体系。⑤制定纠正措施,以便在监测表明关键控制点未处于受控状态时采取这些措施。⑥建立体系,证实HACCP 系统有效运作。⑦建立记录保存系统。
2.统计过程控制和控制图技术
制造过程中,即使工艺条件保持不变,仍不可避免存在影响参数一致性、稳定性的随机波动,有时还可能存在异常扰动。如果过程中只存在由随机原因引起的起伏,不存在异常原因,则称过程处于统计受控状态。如果过程中存在异常原因的影响,则称过程处于失控状态。统计过程控制的作用就是对连续采集的工艺参数数据采用控制图进行定量分析,确定工艺中是否存在异常起伏,从而对工艺过程是否处于统计受控状态做出定量的判断结论。当出现工艺失控或有失控倾向时,立即发出警报,以便及时查找原因,采取纠正措施,使工艺过程一直处于统计受控状态。因此,统计过程控制是一项具有事前预防功能的技术。
控制图又称管理图,由美国贝尔实验室著名质量管理学家、现代质量管理学奠基人之一的休哈特(Walter A.Shewhart)博士于1924年首创,是对过程质量加以测定、记录并进行控制的一种统计方法工具图。控制图在具有控制限的坐标系中,用折线表示工艺参数特征值随批次的变化情况,并根据数理统计原理,从图形上分析导致数据起伏变化的原因中是否存在异常原因,从而判断生产过程是否处于统计受控状态。如果控制图表明生产过程出现失控情况,就应该停止生产,查找导致失控的原因,采取针对性措施,解决问题,维持生产过程的统计受控状态。
统计受控状态的判断根据“小概率事件原理”,在控制图中有8 条判断生产过程失控的基本原则[4]。规则1:控制图上有1点位于控制线以外。规则2:连续9 点落在中心线的同一侧。规则3:连续6 点递增或者递减。规则4:连续14 点中相邻点交替上下。规则5:连续3 点有2点落在中心线同一侧的B 区以外。规则6:连续5 点有4 点落在中心线同一侧的C 区以外。规则7:连续15 点落在中心线两侧的C 区内。规则8:连续8 点落在中心线两侧,且无一点在C区内(图1)。
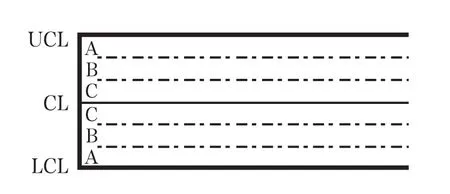
图1 控制线范围的区域分区
3.工序能力指数分析
工序过程处于受控状态,则可以开展工序能力指数评价。一般情况下,工艺参数的一致性体现了工序能力水平,通常使用标准偏差σ 来表示参数的一致性。对于正态分布,参数均值为μ 时,绝大部分参数值集中在μ±3σ范围内(对应6σ),其比例为99.73%,代表参数的正常波动范围幅度。因此,通常将6σ 称为工序能力。为了综合表示工艺水平满足工艺参数规范要求的程度,引入工序能力指数(Cpk),Cpk=T(1-k)/6σ(T 为工艺参数规范范围,k 为工艺参数分布均值对工艺参数规范中心值的偏离度)。Cpk 值实际上直接反映了工艺成品率的高低,也就定量地表征了该工序满足工艺规范的能力。Cpk 值越大,工序满足工艺规范能力越强,成品率越高。通常国内高水平要求Cpk 值达到1.67 以上[4]。
4.相关性分析和回归分析
相关性分析是指对两个或多个具备相关性的变量元素进行分析,从而衡量两个变量因素的相关密切程度。对药品生产过程中的关键工艺参数与质量属性进行相关性分析,进一步验证其关联性,同时也发现新的相关性,不断发现/验证对药品关键质量属性影响较大的参数组合。
回归分析是确定两种或两种以上变量间相互依赖的定量关系的一种统计分析方法。在相关分析的基础上,进一步进行回归分析,探索关键质量属性与关键工艺参数、关键物料属性等变量之间相关关系潜在数学表达式,提高预测和控制风险的能力和水平[5]。
四、基于风险监测的药品生产质量监管核心业务分析
1.确定药品生产关键工艺参数
药品生命周期内,为确保药品的安全性和有效性,首先应当确定关键质量属性,之后确定关键工艺,识别并确认关键工艺参数,获得关键工艺参数和药品或中间体质量的定量关系,并在产品生命周期中不断更新,使其保持持续的验证状态。
这意味着,在工艺开发及生产过程中的各项工艺变更,必须考虑各工艺参数对药品质量可能产生的影响,以便做出正确的决定。其中,识别并控制关键工艺参数十分关键,一旦某一工艺参数被确定为关键工艺参数,就必须对其深入研究,严格管理。关键工艺参数的识别,采取HACCP 或FMEA 方法[6]。
《药品生产质量管理规范(2010年修订)》附录《确认与验证》第六章工艺验证第二十条规定[7]:“企业应当有书面文件确定产品的关键质量属性、关键工艺参数、常规生产和工艺控制中的关键工艺参数范围,并根据对产品和工艺知识的理解进行更新。”关键质量属性是指某种物理化学、生物学或微生物学的性质,应当有适当限度、范围或分布保证预期的产品质量。ICH Q8(R2)对关键工艺参数进行了定义[1]:关键工艺参数是这样一个工艺参数,其变动会对关键质量属性产生影响,因此应当对其进行监测和控制,以保证该工艺能达到预期的质量。在药物开发阶段,应当建立风险管理模式。采用质量源于设计的方法,并使用科学的统计学工具来确认关键工艺参数。设计空间是已被证明的稳健可靠的物料及工艺变量参数及其交互作用的多维组合,反映了关键质量属性和关键工艺参数的相互作用。通过研究工艺参数与关键质量属性之间的相互关系,确定关键工艺步骤及关键工艺参数的变化范围,为确立设计空间提供科学依据。
2.关键工艺参数数据采集
工艺参数数据采集应包括:①数据采集方式和频次。②数据批次的组成、每批包括的数据个数。③关于异常数据的剔除程序和原则。④测试仪器的选用和评价。⑤工艺参数采集要确保真实可信。
3.参数偏差预警、偏差调查与处理
根据工艺参数数据特点,确定采用常规控制图或特殊控制图分析关键工序的统计受控状态。如果根据判定规则,表明生产过程出现失控情况,即出现超标(out of specification,OOS)或超常(out of trend,OOT),应该停止生产,查找失控原因,开展偏差调查,并采取针对性措施,即采取纠正预防措施(corrective action and preventive action,CAPA),解决问题,维持生产过程的统计受控状态[8-10]。
对失控问题进行分析时,首先确认是否是虚假失控,其次判断是“好的失控”(比如有利于参数一致性的失控)还是“坏的失控”(产生不希望的结果的失控)。如果是坏的失控,应查找原因,采取措施,将其“消除”,直到恢复制造过程的统计受控状态。如果是好的失控,也应查找原因,采取措施将其保持,使工艺水平在原有基础上进一步提升,同时使工艺过程进入新的统计受控状态(图2)[4]。
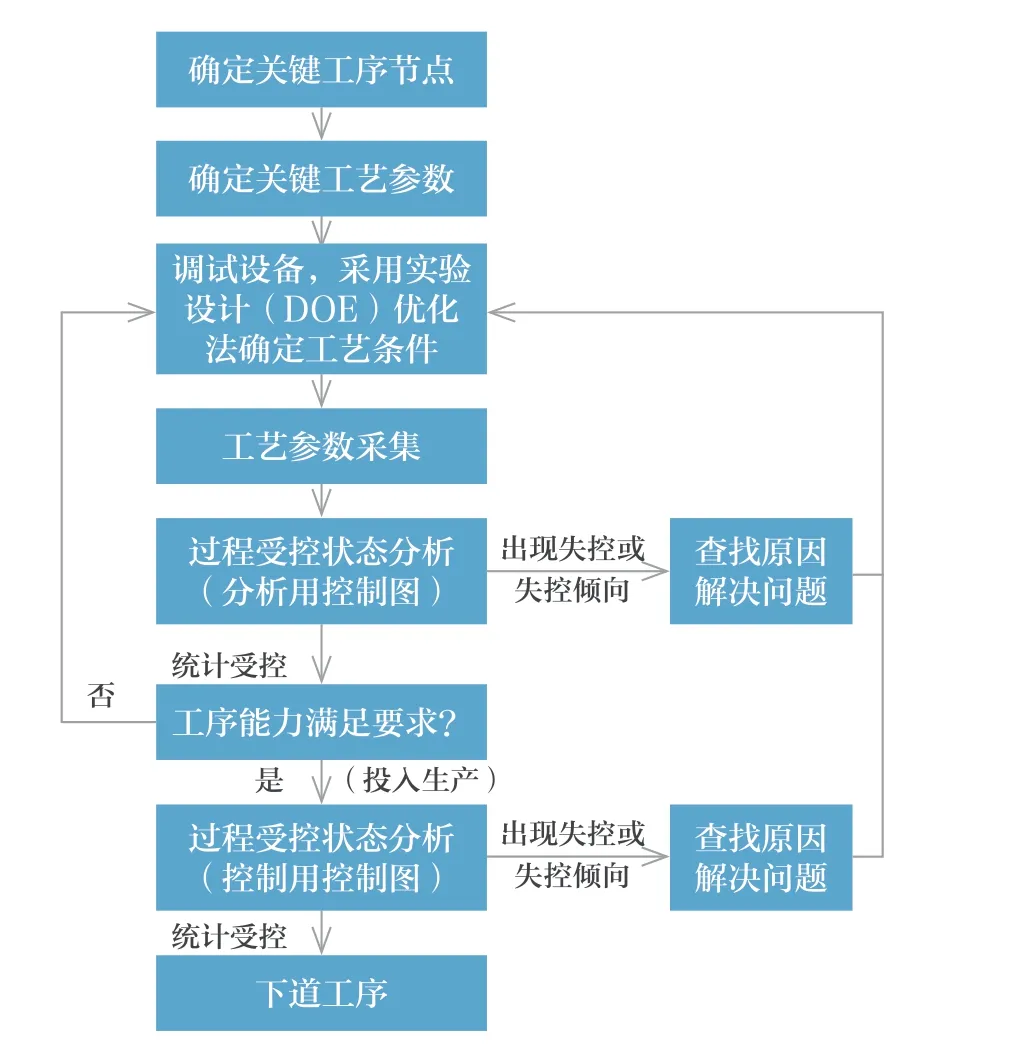
图2 制造过程统计质量控制流程
4.工序能力指数分析
工序能力指数用来表征工艺水平满足工艺参数规范要求的程度。对于处于受控状态的工序,根据工艺参数特点,选用合适的计算模型和方法,计算Cpk 值,并对结果进行分析。目前,国内和国际上对Cpk 值的基本要求分别是不得低于1.33 和1.5,高水平要求则分别是不得低于1.67 和2.0。如果工序能力指数计算结果偏低,提示工艺水平不满足要求,同样需要查找原因,解决问题,提升Cpk 值,满足生产要求(图3)[4]。
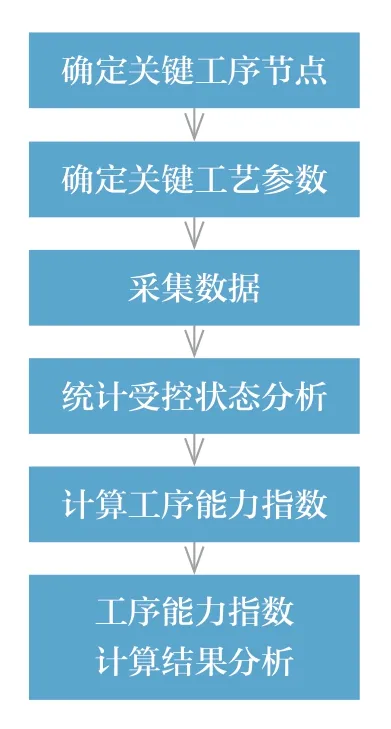
图3 工序能力指数评价流程
五、基于风险监测的药品生产质量监管信息化解决方案
1.业务架构设计
基于诚信和自愿原则,生产企业与监管部门签订诚信生产承诺书,严格按照批准工艺合规生产,并建设诚信生产前置机系统,实时将企业内部生产质量管理与分析数据,包括生产、检验数据和偏差分析处理结果,按照标准规范,提交前置机系统,接受监管部门对其质量监控。
监管部门建立监管系统,与企业诚信生产前置机系统对接,按照与企业的智能合约[11]约定,接受来自企业诚信生产前置机系统风险预警数据及偏差处理信息,监督企业是否建立完善的生产过程可追溯数据记录体系,发现企业生产存在的质量风险,监测企业是否对偏差进行规范处理,是否根据风险预警,对工艺进行持续有效改进。监管部门根据风险研判,决策是否对企业启动现场检查。基于风险监测的药品生产质量监管业务架构见图4。
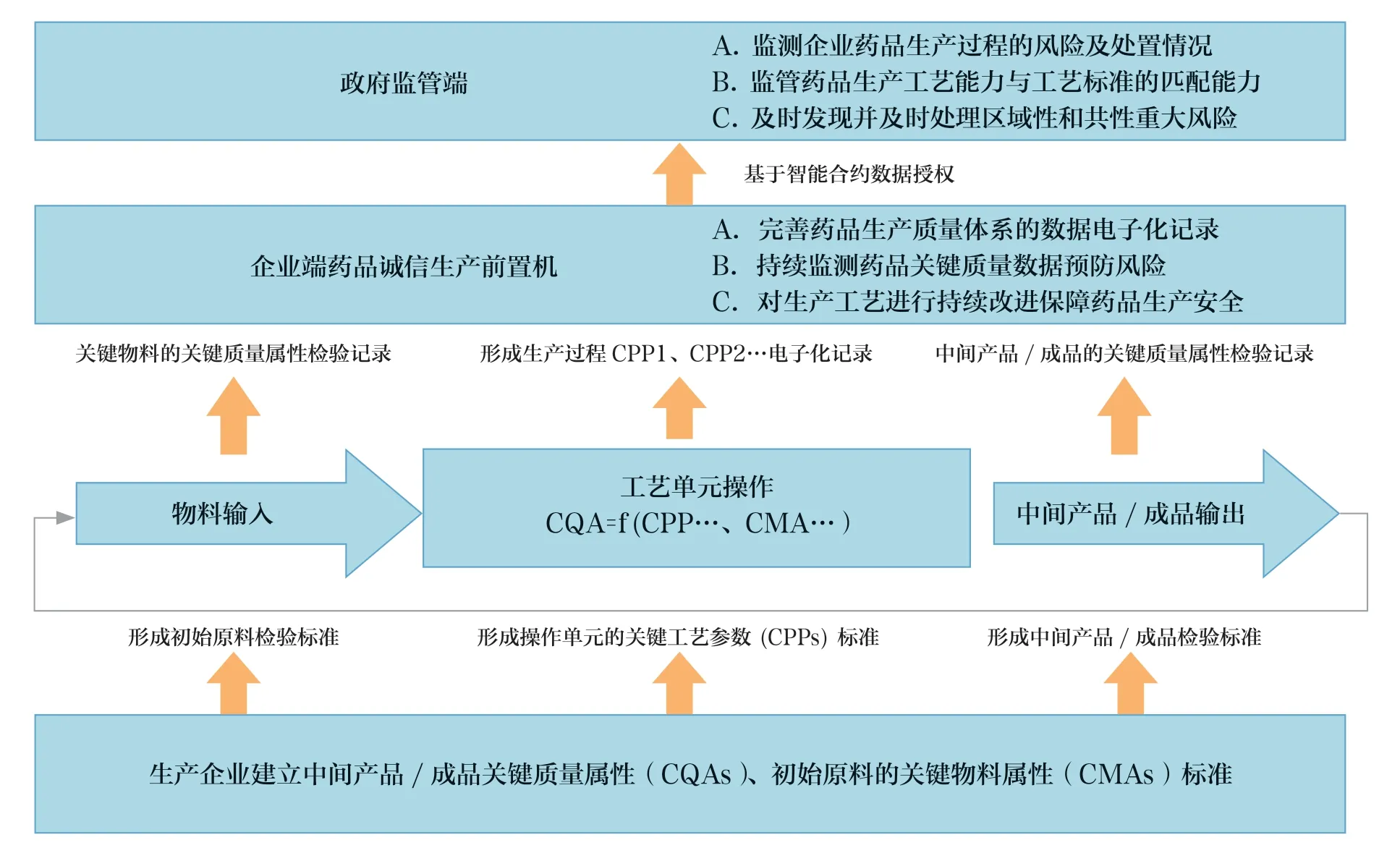
图4 基于风险监测的药品生产质量监管业务架构
2.系统核心功能设计
企业诚信生产前置机系统关键具备以下几方面的支撑能力:①生产过程与检验过程记录系统,关键是确保数据真实性,提供数字签名保障。②能发现企业生产失控风险,并进行预警,提供多种预警模型库和多种控制图支持,能按照风险分类对风险等级进行研判。③基于区块链技术支撑的智能合约授权[11],在约定的风险状态下,接受监管端监管,同时向监管端开放风险预警信息。④能够向监管部门证明前置机系统的可靠性、不可篡改性、安全性。
监管端系统关键支撑能力体现在:①根据与企业签订的智能合约,可以获取来自企业端的风险信息以及查阅企业生产与检验记录、偏差处理记录。②对辖区企业进行风险统计分析和系统性风险研判。③对接日常监管系统,根据风险分析结果,采取监管措施。④能监测被纳管的前置机系统的运行异常状态,如异常离线、位置移动等。
六、当前工作局限性及工作展望
1.当前工作局限性分析
受限于当前制药企业智能制造发展水平和对药品生产质量管控科学规律认识仍不充分,目前的研究在如下方面存在局限性。
(1)数据来源方面:限于当前企业信息化水平,目前企业端前置机的数据来源于企业的相关数据记录,由企业基于诚信的前提提交,即这些数据不一定是从生产线或检测设备上传的原始记录数据,系统无法核验数据的真实性(系统通过区块链技术存证上传,作为今后企业诚信档案)。
(2)风险分析与预警能力方面:主要基于对药品生产过程中,关键工艺参数的统计过程控制和控制图技术、相关性分析与回归分析,分析模型不够丰富,企业对于偏差是否进行适当处置,缺乏有效监管手段。
(3)法规支持方面:目前暂时没有药品生产质量信息化监管相关的法规,本文仅要求企业基于诚信自愿原则,建设企业端前置机系统。企业采取统计过程控制方法进行生产质量控制,目前国内企业还不是很普及,需要培训引导。
2.未来展望
(1)分类分批推广基于风险监测的药品生产质量监管工作。基于当前企业信息化实际水平,拟分三步走:首先实现药品生产与检验记录电子化,其次逐步实现生产与检验数据自动化采集,最后全面实现对生产质量风险实时分析与预警。优先推进有法规支持的疫苗等高风险品种开展试点。

(2)探索建立信息化监管相关制度与标准。充分与已有制度衔接,如与驻场监督员制度、现场检查制度、质量授权人制度等结合,探索研究信息化监管相关政策制度,同时推进相关数据标准、安全存储标准的研制。
(3)完善充实生产质量风险研判算法模型库。提供针对不同品种不同工艺条件下多维度质量风险研判模型,覆盖药品生产全过程质量控制,除关键工艺参数控制外,还包括变更与偏差管理监控、原辅料使用控制、环境洁净控制、产品放行控制等环节。
(4)探索工业互联网架构下药品生产质量监管实现机制。工业互联网已经逐步成为智能制造的“新基建”,研究工业互联网架构下药品生产和检验数据自动采集、分析、应用、安全授权的新模式,促进药品生产质量监管与工业互联网融合发展[12]。
