糖蛋白130在急性肝损伤中负性调控内质网应激作用及机制
2022-07-29李霞李映何伟邓洁蒋小铃姜金莲蒋智钢程其娇刘霞何毅怀
李霞 李映 何伟 邓洁 蒋小铃 姜金莲 蒋智钢 程其娇 刘霞 何毅怀
1遵义医科大学附属医院感染科(贵州 遵义 563000);2遵义医科大学公共卫生学院(贵州 遵义 563099)
糖蛋白-130(glycoprotein 130,gp130)是IL-6(Interleukin-6,IL-6)的重要受体复合物,两者相互作用合成多聚体,通过介导下游JAK-STAT、PI3KAKT 和ERK-MAPK 三种细胞内信号转导途径发挥复杂的生物学效应[1]。gp130 可激活下游信号转导和转录激活因子-3(signal transducer and activator of transcription 3,STAT3)信号通路,在急性期反应、肝脏再生、急慢性肝疾病炎症反应、肿瘤发生等肝病进程中发挥重要作用[2]。早有研究报道,特异性基因敲除小鼠肝细胞gp130 的表达会加重急性肝损伤[3]。骨髓细胞中gp130 的缺失调节IL-6 的释放,并与更严重的Con A 型肝炎肝损伤有关[4]。但gp130 对肝损伤的调控多涉及调控炎症反应,在肝损伤中肝细胞gp130 的表达变化,及其对肝损伤的作用不详。肝细胞凋亡是肝脏疾病发生发展的共同病理特征之一,故提高肝细胞抗凋亡反应是治疗肝病的策略之一。内质网应激(endoplasmic reticulum stress,ERS)是一种细胞发生凋亡的重要信号途径,各种病因作用于肝脏均会促发肝内该通路的激活,其本身通过介导未折叠蛋白反应(unfolded protein response,UPR)参与防御反应[5],但持续或过强的ERS 则诱导凋亡,启动损伤性反应[6]。
为探讨gp130 在急性肝损伤中表达的变化及其对肝细胞凋亡的影响及作用机制,故在本实验中,通过四氯化碳(carbon tetrachloride,CCl4)诱导急性肝损伤模型小鼠,观察肝内gp130 的表达情况,其次,通过4-苯基丁酸(4-phenylbutyric acid,PBA)干预小鼠,观察肝内gp130 表达及肝细胞凋亡情况,最后通过重组8 型腺相关病毒携带的gp130 shRNA 敲减模型小鼠肝内gp130 表达,探讨其对肝损伤、ERS 及肝细胞凋亡的影响及机制。
1 材料与方法
1.1 实验动物144只均来源于遵义医科大学动物实验中心BALB/c雄性小鼠[6~8周龄,(25±3)g],在温度波动于20~24 ℃且没有病原体的环境中饲养,自动12 h 光/暗循环。该实验方案通过遵义医科大学附属医院动物护理使用委员会修订并批准(ZMC-LS[2018]28 号)。
1.2 急性肝损伤小鼠诱导、PBA抑制ERS及gp130病毒敲减小鼠适应1 周后,采用随机数表法将小鼠随机分组:(1)建立急性肝损伤模型小鼠,48 只小鼠分为:未治疗组(正常对照组;n=12)、溶剂对照组(橄榄油;n=12)、24 h CCl4组(n=12)、48 h CCl4组(n=12);(2)用PBA 干预模型小鼠抑制ERS,48 只小鼠分为:对照组(PBS + 橄榄油;n=12)、PBA组(PBA+橄榄油;n=12)、PBA+CCl4组(n=12)、CCl4组(PBS+CCl4;n=12);(3)敲减模型小鼠肝内gp130蛋白表达,48只小鼠分为:对照组(control shRNA + 橄榄油;n=12)、gp130 shRNA 组(gp130 shRNA + 橄榄油;n=12)、gp130 shRNA +CCl4组(n=12)、CCl4组(control shRNA + CCl4;n=12)。模型组:CCl4与橄榄油按体积比为1∶4 的比例混合,5 mL/kg;对照组:橄榄油,5 mL/kg。均腹腔注射,给药1 次,注射前禁饮禁食6 h;前期研究发现在CCl4给药后24 h 肝内ERS 最明显,故选择以24 h 和48 h 为模型组观察点。PBA 溶于PBS,150 mg/kg,腹腔注射预干预2 h,后予CCl4诱导24 h。通过小鼠尾静脉注射剂量1×1010病毒基因拷贝在100 μL 磷酸盐缓冲盐水(PBS)的重组腺相关病毒血清型8(rAVV8),分别表达gp130 shRNA(5′-GCTACATGCCCACCTATTATGCGAACATAATAGGTGGGCATGTAGC-3′;靶点序列:5′-GCTACATGCCCACCTATTATG-3′)或对照shRNA(5′-CCTAAGGTTAAGTCGCCCTCGCCGAAGCGAGGGCGACTTAACCTTAGG-3′)。48 h 后,追加注射相同剂量1 次。在gp130 shRNA + CCl4组中,在AVV 转导后6 周开始CCl4建模,36 h 后收集样品。在每个实验阶段结束时,通过在4 L 安乐死盒中吸入CO2处死小鼠。小鼠失去知觉后,在维持血液循环的同时收集组织和血液样本。
1.3 Western blot 实验取50 mg 肝组织加入含50 μL PMSF 的裂解缓冲液5 mL(10 mg/mL)中,4 ℃下进行匀浆后使用细胞超声破碎仪进一步破碎。然后取1 mL 高速离心(12 000 r/min,15 min),抽取800 μL 上清液与200 μL 的蛋白上样缓冲液混合,在100 ℃的沸水中煮5~10 min,待其冷却后每个孔道20 μL将蛋白加入到8%~12%SDS-PAGE 凝胶上进行电泳分离蛋白,然后切胶至聚偏氟乙烯膜上进行电转。将膜放于含3%~5%脱脂奶粉的TBST 液中并于摇床上封闭至少2 h,然后用TBST洗膜2 次,每次5 min。在4 ℃下,将膜分别用鼠单克隆针对GAPDH、gp130 和STAT3 的一抗,以及兔单克隆针对剪切型Caspase-12、Cleaved caspase-3和磷酸化STAT3(p-STAT3)的一抗,孵育24 h 后用TBST 洗5 次,每次10 min。分别用辣根过氧化物酶(HRP)标记的抗小鼠、抗兔IgG 二抗对相应的蛋白孵育过夜,再用TBST 洗5 次,每次10 min。最后使用Image J 软件进行蛋白定量。
1.4 组织病理和免疫组化分析按照坏死面积百分比(%)=坏死组织面积/总组织面积×100 的标准方法,采用5 μm 厚肝切片进行苏木素-伊红(H&E)染色。或者将切片用抗gp130 抗体(sc-376280,1∶100;美国圣克鲁斯)进行免疫染色,并用DAB 试剂(PV-9002,ZSBIO,中国)检测阳性染色。使用Image-Pro Plus 6.0 软件(美国Media Cybernetics Corporation)对结果进行评价与分析。
1.5 肝功能检测通过全自动生化分析仪,运用速率法检测血清丙氨酸转氨酶(alanine aminotransferase,ALT)水平,运用重氮方法检测血清总胆红素(total bilirubin,TBil)浓度。
1.6 TUNEL 法测细胞凋亡脱氧核糖核苷酸衍生物地高辛与脱氧核糖核苷酸末端转移酶(TdT)按一定比例组成的混合物,滴到经过脱蜡、脱水、去除组织蛋白、破膜后肝组织切片上,37 ℃及一定湿度环境下孵育2 h。最后于显微镜下采集图像。正常细胞核紫外线下呈蓝色,阳性凋亡细胞核则呈绿色。高倍镜下每张切片随机选取5 个视野观察,计数阳性细胞数/总细胞数×100%则为细胞凋亡指数(apoptotic index,AI)。
1.7 统计学方法所有实验数据均使用SPSS 23.0统计软件包进行统计分析。首先进行各组数据正态性及方差齐性检验,符合正态分布的数据用均值±标准差表示,本实验各组定量资料均满足正态分布,各部分组间的比较应为单因素方差分析,两组之间的比较采用LSD 法,P<0.05 表示差异有统计学意义。
2 结果
2.1 CCl4诱导急性肝损伤24 h 和48 h CCl4的诱导模型组,与未治疗组及溶剂对照组小鼠的血清ALT、TBil 水平和肝组织坏死面积比较,经单因素方差分析,差异有统计学意义(P<0.05,表1),进一步采用LSD 法行事后比较,未治疗组与溶剂对照组差异无统计学意义(P>0.05,表1),24 h CCl4的诱导模型的ALT 水平和肝组织坏死面积高于48 h CCl4的诱导模型组,而TBil 水平低于48 h CCl4的诱导模型组,模型组各指标均高于对照组,(P<0.05,表1),模型组肝细胞水肿及坏死明显(图1),由此说明CCl4诱导的急性肝损伤模型造模成功;随后检测肝内gp130蛋白表达上调,且于48 h显著升高;小鼠肝内凋亡标志蛋白Caspase-12 及Cleaved caspase-3的蛋白水平均显著升高,并于24 h表达量最高(P<0.05,图2);此外,免疫组化染色证实肝内gp130 蛋白表达在肝损伤区域显著上调(图3)。
表1 CCl4时间依赖性对小鼠肝功能及肝组织坏死面积的影响Tab.1 Time-dependent effects of CCl4 on liver function and necrotic area of liver tissue in mice±s

表1 CCl4时间依赖性对小鼠肝功能及肝组织坏死面积的影响Tab.1 Time-dependent effects of CCl4 on liver function and necrotic area of liver tissue in mice±s
注:a 与未治疗组相比,a1(P>0.05),a2(P<0.05);b 与溶剂对照组相比,P<0.05;c 与24 h CCl4组比较,P<0.05
组别例数ALT(U/L)TBil(μmol/L)坏死面积(%)未治疗组12 44.29±5.35 1.18±0.12 0.73±0.06溶剂对照组12 43.94±5.18a1 1.24±0.14a1 0.94±0.08a1 24 h CCl4组12 5 932.58±648.38a2.b 5.74±0.45a2.b 41.48±4.61a2.b 48 h CCl4组12 5 294.69±547.68a2.b.c 6.42±0.56a2.b.c 36.37±3.19a2.b.c F 值P 值698.940 629.903 681.718<0.001<0.001<0.001

图1 不同处理组肝组织病理学变化(H&E 染色,20×)Fig.1 Histopathological changes of liver in different treatment groups(H&E staining,20×)

图2 Western blot 法检测不同组gp130、Caspase-12、Cleaved caspase-3 表达情况Fig.2 Western blot method to detect the expression of gp130,Caspase-12 and Cleaved caspase-3 in different groups

图3 CCl4诱导48 h 小鼠的肝组织病理学改变及相应肝内gp130 表达情况(免疫组化)Fig.3 Histopathological changes in the liver of mice induced by CCl4 for 48 h and the corresponding expression of gp130 in the liver(immunohistochemistry)
2.2 PBA 抑制CCl4诱导的肝细胞反应经单因素方差分析示各组间血清ALT、TBil 水平和肝组织坏死面积不全相同(P<0.05,表2);与溶剂对照组相比,单独PBA 预处理没有影响小鼠的血清ALT、TBil 水平及坏死面积(P>0.05,表2),但PBA 干预2 h 显著降低CCl4诱导模型小鼠的血清ALT、TBil水平和肝组织坏死面积(P<0.05,表2),且肝细胞水肿及坏死减轻(图4)。同时,PBA 降低CCl4诱导的小鼠肝内Caspase-12、Cleaved caspase-3 及gp130 蛋白表达(P<0.05,图5)。

图4 PBA 对模型小鼠肝组织病理的影响(H&E 染色,20×)Fig.4 The effect of PBA on the pathology of liver tissue in model mice(H&E staining,20×)
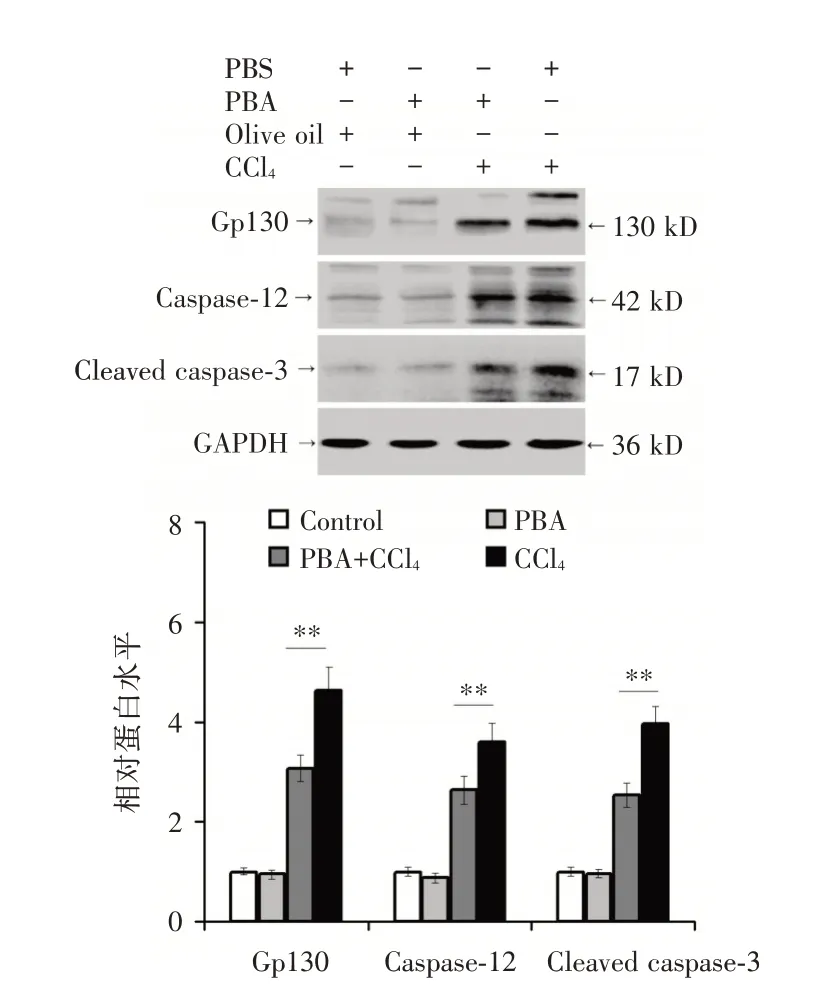
图5 Western blot 法检测PBA 对模型小鼠肝内gp130、Caspase-12、Cleaved caspase-3 表达的影响Fig.5 The effect of PBA on the expressions of gp130,Caspase-12 and Cleaved caspase-3 in the liver of model mice detected by Western blot

表2 PBA 对模型小鼠肝损伤的影响Tab.2 Effects of PBA on liver injury in model mice
2.3 gp130对CCl4诱导的小鼠肝损伤的影响WB法验证gp130 shRNA 下调模型小鼠肝内gp130表达(图6)。各实验组小鼠的血清ALT、TBil 水平、肝组织坏死面积、凋亡指数经单因素方差分析,差异具有统计学意义(P<0.05,表3);gp130 shRNA+CCl4组小鼠的血清ALT、TBil 水平、肝组织坏死面积、凋亡指数均高于CCl4组(P<0.05,表3)。在gp130 shRNA+CCl4组残存的肝细胞较CCl4组显示出更明显的肝细胞水肿,H&E 染色也证明gp130下调增加了CCl4诱导的肝细胞损伤(图7)。此外,gp130下调降低了CCl4诱导的p-STAT3蛋白的表达,证实gp130 shRNA 成功敲减gp130 表达。同时肝内Caspase-12 和Cleaved caspase-3 蛋白水平增加,说明肝细胞凋亡加重(图8)。免疫荧光法提示gp130 下调加重了肝细胞凋亡(图9)。

图6 Western blot 法检测gp130 shRNA 组gp130 表达情况Fig.6 Detection of gp130 expression in gp130 shRNA group by Western blot

图7 不同处理组肝组织病理学变化(H&E 染色,20×)Fig.7 Histopathological changes of liver in different treatment groups(H&E staining,20×)
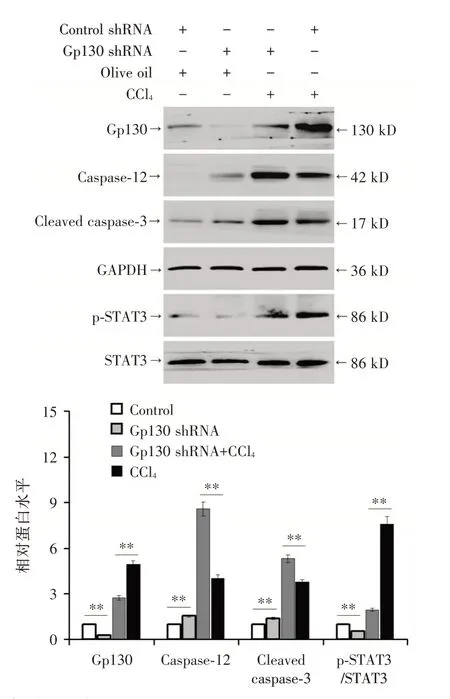
图8 Western blot 法检测不同组gp130、Caspase-12、Cleaved caspase-3、STAT3、p-STAT3 表达情况Fig.8 Western blot method to detect the expression of gp130,Caspase-12,Cleaved caspase-3,STAT3,p-STAT3 in different groups

图9 不同处理组肝内细胞凋亡表达情况(免疫荧光染色40×)Fig.9 Expression of intrahepatic apoptosis in different treatment groups(immunofluorescence staining 40×)
表3 gp130 shRNA 对CCl4诱导的小鼠肝损伤的影响Tab.3 Effects of gp130 shRNA on CCl4-induced liver injury in mice±s

表3 gp130 shRNA 对CCl4诱导的小鼠肝损伤的影响Tab.3 Effects of gp130 shRNA on CCl4-induced liver injury in mice±s
注:a 与对照组相比,a1(P>0.05),a2(P<0.05);b 与gp130 shRNA 组相比,P<0.05;c 与gp130 shRNA+CCl4组比较,P<0.05
分组例数ALT(U/L)TBil(μmol/L)坏死面积(%)凋亡指数(%)对照组12 46.83±5.93 1.32±0.15 0.96±0.8 0.98±0.09 gp130 shRNA 组12 59.82±7.72a1 1.96±0.28a2 2.76±0.33a1 1.43±0.13a1 gp130 shRNA+CCl4组12 6849.75±743.41a2.b 6.49±0.63a2.b 48.6±4.76a2.b 25.42±1.98a2.b CCl4组12 5586.74±632.84a2.b.c 4.84±0.52a2.b.c 40.92±3.18a2.b.c 21.74±1.35a2.b.c F 值P 值596.777 338.839 839.833 1 288.708<0.001<0.001<0.001<0.001
3 讨论
本研究通过小鼠模型研究探讨了肝细胞gp130-ERS-细胞凋亡调控轴在急性肝损伤中的调节作用。研究结果显示在CCl4诱导的急性肝损伤模型小鼠肝内细胞凋亡增加,ERS 激活及gp130表达上调,且gp130 的上调主要发生于损伤的肝细胞中。PBA抑制模型小鼠ERS,肝内gp130 表达下调,肝细胞凋亡减轻。通过gp130 shRNA 下调CCl4诱导的模型小鼠肝内gp130 表达,结果显示不仅肝损伤加重,并且ERS 及肝细胞凋亡加剧。ERS 与IL-6/gp130/STAT3 信号通路均参与肝脏急性期反应,两者间相互调控影响肝病预后。综上结果,在急性肝损伤中ERS 触发肝细胞gp130 表达增加;gp130 的上调可提高肝细胞抗凋亡能力缓解肝损伤,本实验提示其机制可能与负性调控ERS 有关。
gp130 不仅在多种肿瘤性疾病中上调,在非肿瘤性肝病中同样也表现出上调[7]。先前的研究表明,gp130 的表达受到多个环节及水平的调控。gp130 可以识别微环境中的细胞因子并允许信号在细胞内的传递,随之自身内吞抑制持续激活[8]。继细胞因子-膜表面受体相互作用后,gp130 可以被下游的转录调节因子直接激活,从而增强gp130的转录[9]。此外,gp130 的磷酸化、泛素化和各种转录后修饰也可以调节gp130 蛋白膜的稳定性,从而通过溶酶体或蛋白酶体途径降解gp130[10-11]。gp130 的活性决定后续gp30/STAT3 信号途径介导的生物学功能。gp130 被认为是维持肝细胞完整性和控制肝脏再生的基本细胞因子,多项研究已证实IL-6/gp130/STAT3 信号轴可在肝损伤中触发肝脏保护性作用。肝脏受损时激活急性期反应、ERS 等反应保护受损肝细胞,以维持肝脏正常结构及功能[12]。本研究结果示,CCl4诱导的急性肝损伤模型小鼠发生显著ERS,且肝内gp130 表达升高,结合前期研究发现[13],ERS 可通过激活核因子-κB(nuclear factor-kappa B,NF-κB)上调多耐药蛋白2(Multidrug-resistance protein 2,MRP2)缓解肝损伤,gp130 与MRP2 均属于膜蛋白,故推测肝内gp130 上调可能受ERS 调控。为验证肝内gp130表达上调的机制,进一步行PBA 抑制ERS,结果示肝内gp130 表达减少,表明ERS 可增加肝损伤时肝内gp130 的表达,其次肝细胞凋亡减轻,说明急性肝损伤时发生的肝细胞凋亡ERS 参与了介导。免疫组化显示gp130 主要在损伤的肝细胞区域表达上调,提示急性肝损伤后肝细胞上调gp130 表达,可能直接影响肝细胞抗损伤能力,故本实验进一步行模型小鼠肝内gp130 敲减实验探讨gp130 表达上调的意义及作用机制。
gp130/STAT3 信号通路在多种肝脏疾病的发病中发挥不同的作用机制。肝细胞特异性基因敲除小鼠gp130 表达的缺乏促进了急性肝损伤[3]。IL-6/gp130信号通过稳定Mcl-1和阻止p53激活来防止DNA 损伤时的肝细胞凋亡[14]。靶向IL-6/gp130信号通路的抑制剂可能对治疗肝癌有益[15]。此外,在没有NF-κB 激活的情况下,仅肝细胞特异性gp130 激活就足以触发强大的先天免疫应答保护肝细胞[16]。相反,在免疫性肝炎这样的情况下,IL-6/gp130信号传导可加重肝脏损害[17]。由此说明不同病因的肝损伤存在复杂的调控机制,不同细胞膜上gp130 的表达谱可能存在差异。STAT3 是gp130/JAK 的下游信号之一,它可以通过与TNF-α,RIP1、RIP3 和NF-κB 的相互调节来影响凋亡。p-STAT3 是IL-6 信号通路激活的重要标志,IL-6 可以通过维持多种抗凋亡因子的表达来减少肝细胞的凋亡,其次p-STAT3 是肝脏受损伤后急性期反应相关基因表达的关键调节器,可进一步参与促进肝细胞再生[18]。早有研究已发现IL-6 通过gp130/STAT3 在肝细胞中触发关键的下游事件,从而保护肝损伤,缺乏STAT3 激活的肝脏细胞中观察到更多的凋亡[19]。gp130/STAT3 信号通路不仅在急性肝损伤中通过诱导急性期反应,参与肝损伤修复,同时可增加ERS 介导的防御反应,提高肝细胞抗损伤的能力。在本研究中,gp130 shRNA 引起的模型小鼠肝内gp130 下调,并显著降低了CCl4诱导的STAT3 磷酸化,提示gp130 shRNA 成功敲减肝内gp130 表达。gp130 的敲减引起CCl4诱导的小鼠血清ALT、TBil 水平、坏死面积增加,说明gp130 的敲减加重肝损伤,由此证实在急性肝损伤中肝细胞gp130 的上调有利于减轻肝细胞损伤。
细胞凋亡是肝细胞受到损伤刺激的基本机制之一,主要由半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,caspase)与非caspase途径介导[20]。Caspase-3 是细胞发生凋亡过程中标志性的末端剪切酶,活化的Caspase-3 能够通过酶化多聚ADP-核糖聚合酶使蛋白质中与DNA 结合的锌酯的结构被分离,最终导致细胞形态变化从而进展为细胞凋亡[21]。内质网在肝细胞中的含量丰富,许多肝脏疾病与ERS 有关。ERS 被认为是除线粒体及死亡受体途径外,介导细胞凋亡的一种独立信号通路,当ERS 过度激活时,将触发ASK1-JNK 信号通路、Caspase-12 和CHOP 诱导细胞凋亡[22]。尽管目前多项研究提示IL-6/gp130/STAT3通路可抗细胞凋亡及保护肝损伤,但具体机制不详,且研究甚少。在本研究中,敲减gp130的模型小鼠与急性肝损伤小鼠相比较:Caspase-12、Cleaved caspase-3 表达上调均更明显,免疫荧光结果提示凋亡指数更高,且两组间差异有统计学意义(P<0.05),说明缺乏gp130 的小鼠ERS 显著,且更易发生肝细胞凋亡,更可能导致各类肝病的病情进展。有研究发现[23],p-STAT3 可以通过增加抗凋亡蛋白的表达来提高细胞的存活率,p-STAT3 抑制通过降低ATF6α 和p-IRE1α 的表达破坏UPR 的促生存功能。此外,p-STAT3 抑制通过促进CHOP、p-JNK 和procaspase-12 的表达激活ESD。由此说明上调肝内gp130 可能通过参与调控ERS 介导的肝细胞凋亡缓解了肝损伤,其机制与下游分子STAT3 负反馈作用于ERS 有关。因此,此项研究说明ERS 过度应激时也在通过负反馈调控机制维持自身的保护机制,gp130 与STAT3 可能是未来调控ERS 稳态的潜在治疗靶点。
在急性肝损伤中ERS 上调肝细胞gp130 表达。gp130 的上调可能通过STAT3 信号负反馈调控ERS 介导的肝细胞凋亡减轻肝损伤。
