EGF和VEGF的基因多态性及血清表达水平对晚期食管鳞癌预后的影响
2022-07-29刘艳春孟立宁陈宏洋韩爱勇岳燕军
刘艳春,梁 立,孟立宁,杨 曼,陈宏洋,韩爱勇,岳燕军
食管癌是具有高发病率、高病死率的常见消化道恶性肿瘤,一般认为其致病因素包括遗传、饮食、生物化学因素、生活方式、精神、环境、家族史等,是由多种因素联合作用而产生的恶性疾病[1]。食管癌病理类型以鳞癌为主,其早期发病隐匿,部分患者确诊时已发展为癌症中晚期,失去手术治疗时机,同步放化疗是晚期食管鳞癌的重要治疗方式,而不同个体对放化疗敏感度不同,疗效及预后也存在一定差异[2-3]。基因多态性研究可为肿瘤的早期筛查、治疗及预后评估提供可靠的指标及干预靶点。表皮生长因子(EGF)和血管内皮生长因子(VEGF)是临床公认的促血管生成因子,在肿瘤血管新生过程中起重要作用[4-5]。已有研究显示,EGF、VEGF可能与肺癌、皮肤黑色素瘤具有显著相关性[6-7]。本研究回顾性分析晚期食管鳞癌患者EGF、VEGF相关位点基因型分布,探讨EGF和VEGF的基因多态性和血清表达水平对晚期食管鳞癌患者预后的影响。
1 资料与方法
1.1一般资料 选取2019年1月—2020年12月我院收治的108例晚期食管鳞癌为研究对象,其中男72例,女36例;年龄18~76(59.42±10.28)岁。①纳入标准:均符合食管癌临床诊断标准[8],且经内镜及病理组织学检查确诊为晚期食管鳞癌;均失去手术治疗指征,同意接受同步放化疗方案治疗;年龄≥18岁,首次发病;治疗前Karnofsky功能状态评分(KPS)≥60分,预计生存时间≥3个月;获有效随访,临床资料完整。②排除标准:合并其他恶性肿瘤;合并严重肝、肾功能不全;合并全身免疫系统疾病;合并活动性感染、消化道出血、休克;未完成治疗及随访者。本研究已获我院医学伦理委员会批准。
1.2方法
1.2.1同步放化疗:化疗方案为第1天给予多西紫杉醇135~175 mg/m2,第2~3天给予顺铂40 mg/m2,持续治疗21 d为1个疗程,共治疗2个疗程;放疗方案为三维适形放疗,每周5次,每次剂量1.8 Gy或2 Gy,总剂量为40~74 Gy,中位放疗剂量为60 Gy。如患者出现胃肠道反应及骨髓抑制等毒副作用予以对症治疗,毒副作用Ⅲ~Ⅳ度则考虑减少用药剂量或停药。
1.2.2基因多态性检测:所有患者于同步放化疗前采集空腹静脉血2 ml,EDTA抗凝,采用酚氯仿法提取总DNA,扩增目的基因序列,通过基因芯片微阵列法对VEGF rs3025039、rs833061位点及EGF rs11568848、rs11568849位点基因型进行分析。PCR反应体积为20 μl,94 ℃预变性5 min,再按下列程序循环35次,即94 ℃变性40 s,56 ℃退火1 min,72 ℃延伸1 min;末次循环后,72 ℃延伸5 min。VEGF及EGF扩增产物应用ABI3130、ABI3700和ABI3730等DNA测序仪采用Snapshot法进行测序。检测完成后随机抽取5%样本进行重检,以确保检测结果的准确性。
1.2.3资料收集:收集所有患者一般资料,包括年龄、性别、吸烟史[9]、饮酒史[10]、肿瘤部位、肿瘤长度、AJCC分期、肿瘤分化程度、浸润深度、放射总剂量,同时观察所有患者的血红蛋白、血清白蛋白、EGF、VEGF水平,以及VEGF rs3025039、rs833061位点和EGF rs11568848、rs11568849位点基因型。采用希森美康XN-3000血液分析仪及配套试剂盒检测血红蛋白、血清白蛋白水平;采用酶联免疫吸附试验检测血清EGF、VEGF水平,试剂盒均购自中生北控生物科技股份有限公司。
1.3观察指标 观察患者预后情况,嘱患者出院后每3个月门诊随访1次,并行彩超或CT等影像学检查,随访时间为12个月,观察患者复发(原食管瘤床复发、吻合口复发,纵隔、锁骨上淋巴结转移和腹腔淋巴结转移)、肿瘤远处转移(肺、骨、肝、胸膜等远处部位转移)[8]和生存情况,并据此分为预后良好组(病情控制稳定)和预后不良组(疾病复发、新发转移或死亡)。比较预后良好组和预后不良组EGF和VEGF的基因多态性、血清表达水平及临床资料,并分析影响晚期食管鳞癌患者预后危险因素。

2 结果
2.1预后情况 随访12个月,108例晚期食管鳞癌中死亡9例,局部进展13例,远处转移12例,共34例,占31.48%,均纳入预后不良组。74例无进展生存,占68.52%,纳入预后良好组。
2.2预后良好组和预后不良组一般资料比较 预后良好组和预后不良组年龄、性别、吸烟史、饮酒史、肿瘤部位、肿瘤长度、AJCC分期、肿瘤分化程度、浸润深度、放射总剂量比较差异均无统计学意义(P>0.05)。见表1。
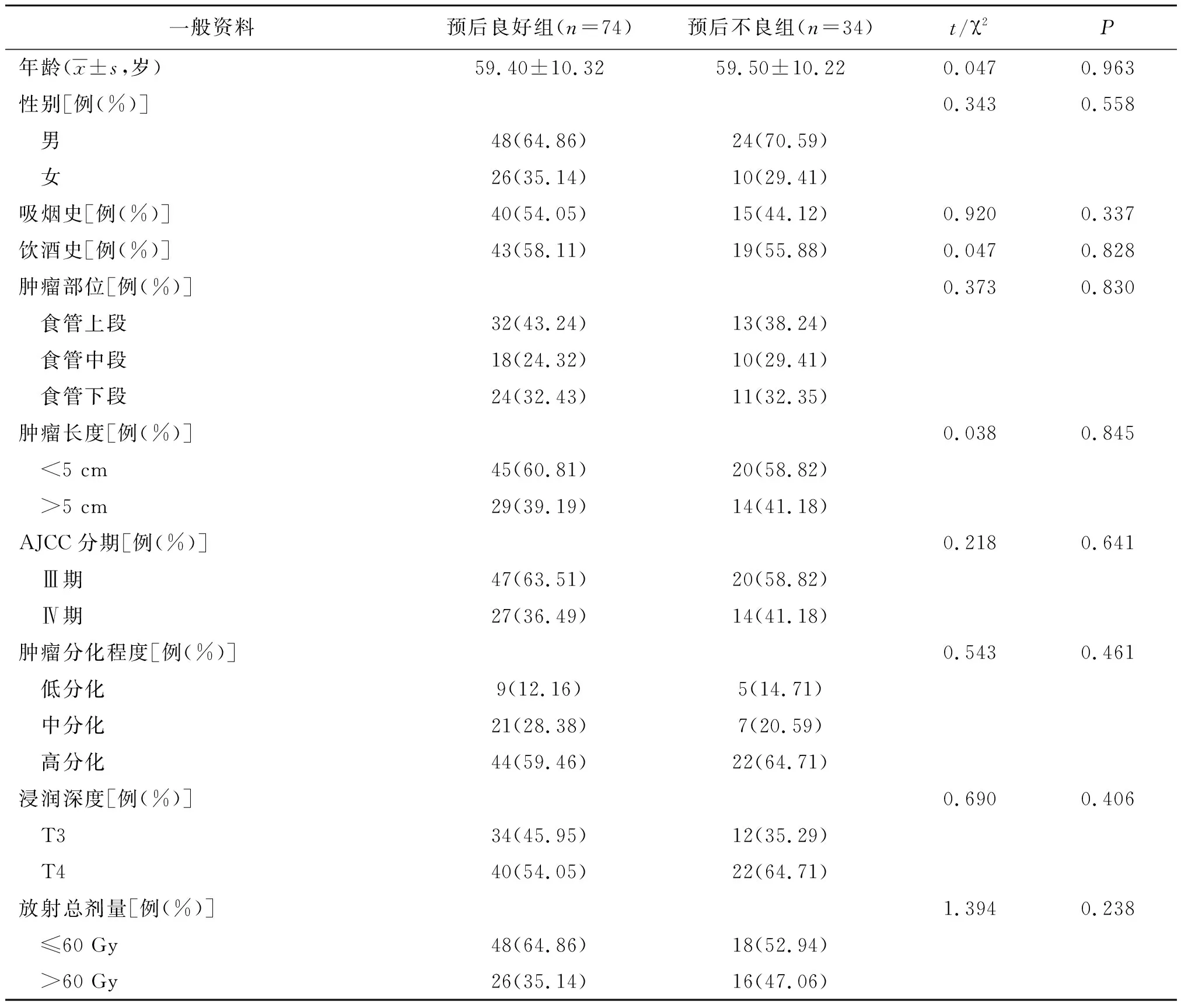
表1 不同预后晚期食管鳞癌两组一般资料比较
2.3预后良好组和预后不良组生化指标及基因型比较 预后不良组血清白蛋白水平显著低于预后良好组,血清EGF、VEGF水平显著高于预后良好组,EGF rs11568848、rs11568849位点基因型GT、AA占比及VEGF rs3025039、rs833061位点基因型TT、CT占比显著高于预后良好组(P<0.05,P<0.01)。见表2。
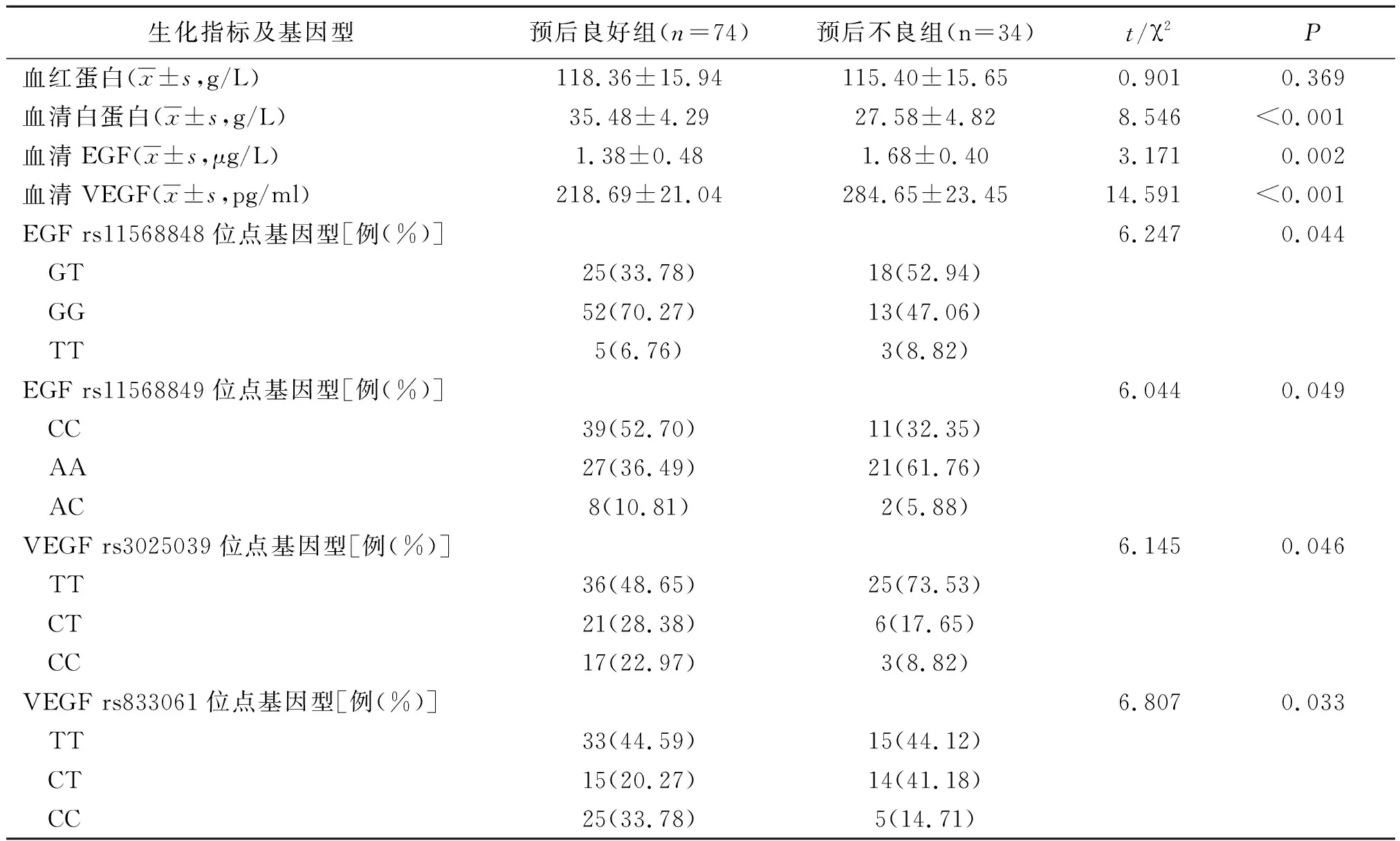
表2 不同预后晚期食管鳞癌两组生化指标及基因型比较
2.4多因素Logistic回归分析 将晚期食管鳞癌患者预后作为因变量,将上述存在差异的相关因素作为自变量,进行量化赋值:预后(良好=0,不良=1)、血清白蛋白(≥31.27 g/L=0,<31.27 g/L=1)、血清EGF(<1.49 μg/L=0,≥1.49 μg/L=1)、血清VEGF(<252.87 pg/ml=0,≥252.87 pg/ml=1)、EGF rs11568848位点基因型(GG和TT=0,GT=1)、EGF rs11568849位点基因型(CC=0,AA和AC=1)、VEGF rs3025039位点基因型(CT和CC=0,TT=1)、VEGF rs833061位点基因型(CC=0,TT和CT=1),纳入多因素Logistic回归分析。结果显示,血清白蛋白、EGF、VEGF水平以及EGF rs11568848、rs11568849位点基因型与VEGF rs3025039、rs833061位点基因型是影响晚期食管鳞癌患者预后的独立危险因素(P<0.05,P<0.01)。见表3。
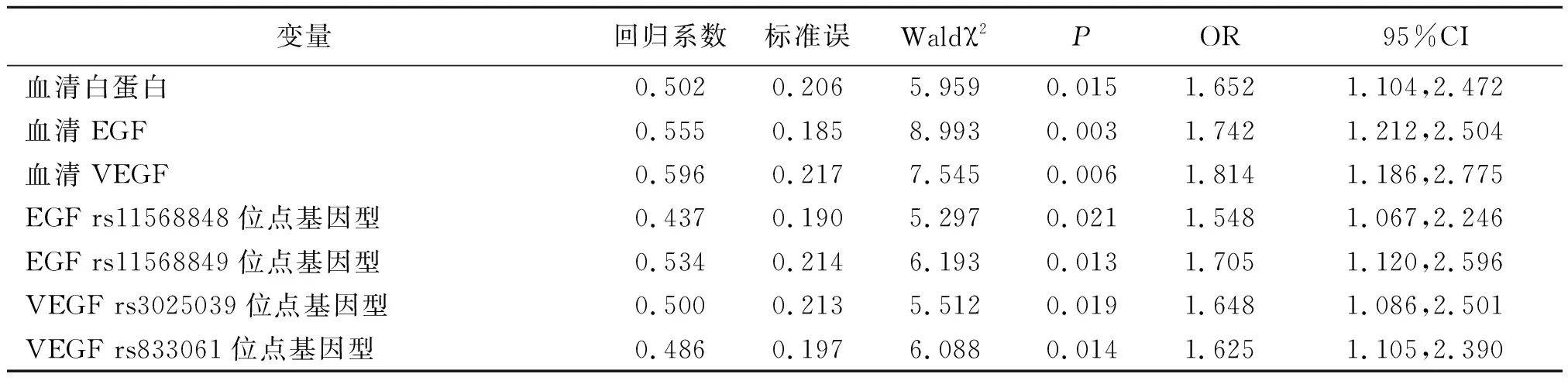
表3 影响晚期食管鳞癌患者预后的多因素Logistic回归分析
3 讨论
目前,单核苷酸多态性是分析复杂疾病、识别群体基因等方面的重要研究手段,相关基因型检测可为癌症筛查增加新的生物学标志物,并提供利于治疗的干预靶点[11-12]。肿瘤血管生成是肿瘤细胞增殖、分化、转移的形态学基础,肿瘤间质血管数增加可促进肿瘤生长,增强侵袭性,同时使血行转移风险升高[13]。肿瘤血管生成过程由众多生长因子调控,EGF基因对有丝分裂具有促进作用,在肿瘤发生、发展中发挥重要作用[14]。VEGF在促肿瘤血管生成过程中起主导作用,具有作用强、特异性高的特点。以EGF、VEGF为药物作用靶点,通过阻断肿瘤血管产生,从而抑制癌症进展是目前临床治疗恶性肿瘤的重要手段[15]。若能在治疗前通过可靠的生物学标志物筛选出潜在获益人群,并预测患者疗效及预后,将显著提升治疗效果。本研究探讨EGF和VEGF的基因多态性和血清表达水平对晚期食管鳞癌患者预后的预测价值。
本研究结果显示,预后不良组血清EGF、VEGF水平高于预后良好组,EGF rs11568848、rs11568849位点基因型GT、AA占比及VEGF rs3025039、rs833061位点基因型TT、CT占比显著高于预后良好组,且多因素Logistic回归分析显示,血清EGF、VEGF水平以及EGF rs11568848、rs11568849位点基因型与VEGF rs3025039、rs833061位点基因型是影响晚期食管鳞癌患者预后的独立危险因素。潘慧文等[16]研究也显示,EGF基因型和血清EGF水平升高可能与食管鳞癌发生及淋巴结转移相关,具有GT、AA基因型和G等位基因的患者更易发生淋巴结转移。另有研究显示,食管癌患者血清中EGF、VEGF表达明显升高,且二者具有明显相关性[17]。VEGF是重要的血管生成因子,晚期食管鳞癌患者机体多种体液因子和肿瘤基因可通过VEGF促进或抑制肿瘤血管生成,VEGF过度表达则促进食管鳞癌细胞增殖、转移,造成患者预后不良。还有研究表明,EGF可通过刺激血管平滑肌细胞诱导VEGF mRNA表达,升高VEGF表达水平,并以VEGF作为共同途径促进肿瘤的血管生成[18-19]。EGF及VEGF对食管鳞癌细胞增殖具有协同作用,故检测二者表达对预测晚期食管鳞癌患者预后具有临床价值。
本研究还显示,血清白蛋白水平也是影响晚期食管鳞癌患者预后的独立危险因素,与赵若妃等[20]研究结果相似。血清白蛋白水平是评价患者营养状况的重要指标之一,可反映患者蛋白储量及身体功能情况。晚期食管鳞癌伴有严重营养不良患者免疫系统功能低下,黏膜屏障破坏、感染等严重并发症发生风险显著上升,对患者预后不利。
综上,不同预后晚期食管鳞癌患者血清EGF和VEGF水平及基因分布存在较大差异,EGF和VEGF的基因型和血清表达水平对晚期食管鳞癌患者预后具有一定影响。
