微小RNA-499 对脓毒症心功能障碍大鼠肌球蛋白重链的影响
2022-07-29杨永丽刘海珍
杨永丽 刘海珍 钟 准
江汉大学附属湖北省第三人民医院1重症医学科,2心血管内科,3耳鼻喉科湖北 武汉 430033
脓毒症(sepsis)是指因感染引起宿主反应失调而导致的危及生命的器官功能障碍,心脏是脓毒症损害的主要靶器官之一,脓毒症心功能障碍(sepsis myocardial dysfunction,SMD)病 死 率 高 达50%~70%[1]。目前对脓毒症导致心功能障碍的机制尚无确 切 定 论[2,3]。miRNAs(microRNAs)是 一 类 非 编码单链RNA 分子,在心血管生理及病理过程中发挥重要的调节作用[4-10]。在糖尿病心肌病中,miR-499 可导致β-肌球蛋白重链(MHC)表达的上调,引起心肌肥大、心功能障碍[6]。有研究发现,miR-499在脓毒症心肌组织内表达量降低[8],但其确切作用机制尚未明确,因此,在本实验中,我们将重点研究miR-499 与α-MHC、β-MHC 在脓毒症心功能障碍大鼠模型的血浆、心肌中的表达量的变化及其参与发病的可能机制,希望能为临床治疗脓毒症提供有价值的思路。
1 材料与方法
1.1 实验动物及分组清洁级健康雄性Sprague-Dawley 大鼠45 只,体质量200~250 g,均购自武汉大学动物实验中心,许可证号:WQ20210365。采用随机数字表法将大鼠分为假手术(sham 组)、脓毒血症心功能障碍组[脂多糖(LPS)组]和miR-499 模拟物组(LPS+anomir 组),每组15 只,并饲养于可以随意获取食物和水的恒温[(23±2)℃]动物房。本研究经江汉大学附属湖北省第三人民医院伦理委员会批准。
1.2 模型制备及分组处理使用腹腔注射LPS(10 mg/kg)诱发脓毒症心功能不全[11],sham 组腹腔注射同体积磷酸盐缓冲溶液(PBS)。miR-499 和agomir 由吉玛公司合成(中国上海)。miR-499 模拟物组(甲氧化修饰的miR-499 激动剂,吉玛)在大鼠造模前连续3 d 通过尾静脉给予注射,agomir 剂量为30 mg/kg。
1.3 检测指标及方法大鼠腹腔注射LPS 6 h 后,10%水合氯醛麻醉(0.35 mL/100 g)后,开胸取左心房血200 μL、心肌组织100 mg 用于实时聚合酶链反应(Q-PCR)和蛋白质免疫印迹(Western Blot)。
1.3.1Q-PCR 法检测血浆和心肌组织中的miR-499 注射LPS 6 h 后使用核酸纯化试剂盒(AXYGEN)提取血浆及心肌组织中的总RNA,使用Nano-Drop2000 紫外可见分光光度计(Thermo Scientific)评估浓度和质量。按试剂盒说明书的说明,使用试剂盒(Thermo Scientific)对每个样品的总RNA 进行逆转录,以产生20 μL cDNA,用ddH2O 稀释4 倍后加引物并用GoTap®qPCR Master Mix(Promega)进行扩增,测量每个样品的熔解曲线以确保产物的特异性,用U6 作内参。PCR 扩增条件:95 ℃预变性5 min,然后95 ℃15 s,60 ℃60 s,40 个循环。引物序列如下:miR-499 正向引物序列5'-GCGCGTTAAGACTTGCAGTG-3',miR-499 反 向 引 物 序 列5'-GCGCGTTAAGACTTGCAGTG-3'。α-MHC 引物序列为:5'-AGTATGTCACCAAGGGGCAG-3',β-MHC 引 物 序 列:5'-TGGCACCGTGGACTACAATA-3'。特异性引物由Invitrogen 公司设计,用2-ΔΔCT方法计算miR-499 的表达量。
1.3.2超声心动图 注射LPS 5 h 后通过超声心动仪检测心功能(Vivid,Visualsonics,Canada)。全麻成功后剃胸部皮毛,超声探头置于胸前,测量左心室射血分数(left ventricle ejection fractions,LVEF)、短轴缩短率(left ventricle fractional shortening,LVFS)、左室舒张末期内径(LVDd)、左室收缩期内径(LVDs)、左室舒张期末容积(LVVd)、左室收缩期末容积(LVVs)、心率(heart rate,HR)、每分钟搏出量(stroke volume,SV)、心输出量(cardiac output,CO),保留图像用于脱机分析。
1.3.3Western Blot 心肌组织取出后迅速放入液氮中保存。取出心肌组织并放置在冰块上,根据心肌组织重量加入合适比例的RIPA 裂解液、蛋白酶抑制剂(RIPA 与蛋白酶抑制剂比例为1∶100,博士德)后在组织研究仪上进行研磨(武汉塞维尔,中国)。研磨完毕,样品置于4 ℃离心机,1 000g,离心15 min 后收集上清。然后用BCA(Solarbio,中国)法测定蛋白浓度。将样品(30 μg)与loading buffer(Solarbio,中国)混合后99 ℃加热5 min。制备10%十二烷基硫酸钠-聚丙烯酰胺凝胶(晶彩,中国),按顺序上样、电泳,最后在4 ℃、30 V 的条件下将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上(Millipoer,德国)。5%胎牛血清常温封 闭2 h,α-MHC(abcam,ab31762,1∶1 000)、β-MHC(1∶1 000,proteintech)、GAPDH(1∶20 000,proteintech)的一抗4 ℃孵育过夜。使用辣根过氧化物偶联的山羊抗小鼠二抗(1∶5 000,proteintech)或山羊抗兔(1∶5 000,proteintech)二抗检测蛋白质,使用化学发光试剂盒(electrochemiluminescence,ECL)(BeyoECL Plus,p0018S),用超灵敏全自动成像分析系统(FluorChem E,USA)曝光。最后用ImageJ 进行灰度分析。
1.3.4N-端脑利钠肽前体(N-terminal pro-brain natriuretic peptied,NT-proBNP)的测定 处死大鼠前抽取尾静脉血放于干燥抗凝管内,然后常温3 000 r/min 离 心15 min,用 德 国Roche 公 司 产 的Cobase601 电化学发光仪及其专用试剂盒对血浆NT-proBNP 的浓度进行测定。
1.4 数据分析采用SPSS 22.2 统计软件对实验数据进行统计学分析。计量资料用均数±标准差(±s)表示,使用one-way ANOVA 进行组间比较分析,采用Kruskal-WallisH检验对多个独立样本进行差异性比较,使用Studentt检验进行非配对样本比较,P<0.05 认为具有统计学意义。
2 结果
2.1 注射LPS 后大鼠心功能减退,血浆中miR-499、α-MHC 下降,β-MHC 上调腹腔注射LPS 5 h 后,与sham 组相比,模型组大鼠出现了明显的精神萎靡,心率显著下降,LVEF、LVFS、SV、CO、HR等也分别下降了49.1%、59.2%、39.4%、48.8%、15.9%,与sham 组相比,有统计学差异;LPS+agomir 组与LPS 组相比,心功能明显改善,有统计学差异(见表1,图1)。为了进一步客观评估心衰,通过化学发光免疫分析法,我们检测了血浆中NTproBNP 的变化,结果显示:与sham 组相比,脓毒症组大鼠血浆中NT-proBNP 显著升高(P<0.001)(图2)。以上结果说明:脓毒症引起的大鼠心功能障碍模型建立成功。

图2 各组大鼠血浆NT-proBNP 指标变化
表1 各组大鼠心功能指标变化(±s)

表1 各组大鼠心功能指标变化(±s)
与Sham 组比较,*P<0.05,**P<0.01,***P<0.001;与LPS 组比较,#P<0.05,##P<0.01,###P<0.001;n=15
LPS+agomir 组66.15±2.01##36.16±1.43##15.86±1.06##50.98±2.32#39.73±0.68##38.24±1.53###438.3±6.04##指标LVEF(%)LVFS(%)LVVs(μL)LVVd(μL)CO(mL/min)SV(μL)HR(次/min)Sham 组65.94±2.16 35.47±1.48 16.09±2.02 49.43±2.39 44.03±0.70 36.00±1.36 424.0±6.63 LPS 组32.34±2.41**21.20±1.32***26.71±1.39**40.98±2.10*21.94±0.39***14.40±1.34**356.3±5.37**

图1 各组大鼠心功能指标变化
2.2 脓毒症大鼠血浆和心肌组织中miR-499、α-MHC、β-MHC 的表达首先,通过Q-PCR 技术,我们检测了脓毒症大鼠血浆miR-499 的表达变化。结果显示:与sham 组相比,模型组大鼠miR-499 水平显著下降(**P<0.01)(图3)。通过Q-PCR 检测了血浆中α-MHC、β-MHC mRNA 的表达变化,结果显示:与sham 组相比,模型组大鼠血浆中α-MHC mRNA 的表达水平显著下降,而β-MHC mRNA 的表达水平显著升高(P<0.01)(图4)。

图3 各组大鼠血浆中miR-499 的表达变化

图4 各组大鼠血浆中α-MHC、β-MHC mRNA 表达变化
同样,我们检测了造模后6 h 的心肌组织中miR-499、α-MHC、β-MHC 表达量,结果显示:与sham 组相比,模型组miR-499 表达量显著下降(P<0.01)(图5);α-MHC mRNA 及其蛋白表达量下降,β-MHC mRNA 及其蛋白量上调(P<0.01)(图6~8)。
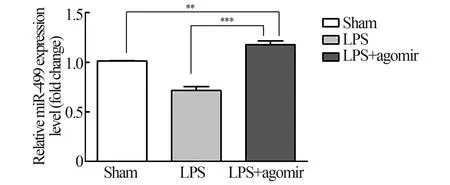
图5 各组大鼠心肌组织miR-499 的水平变化

图6 各组大鼠心肌组织中α-MHC、β-MHC mRNA表达变化
2.3 过表达miR-499 后大鼠心功能改善,血浆及心肌组织中α-MHC 表达增加,β-MHC 水平下调在注射LPS 造模前3 d,通过大鼠尾静脉注射miR-499 的agomir,1 次/d,从而过表达miR-499。通过超声心动图检测,结果显示:与LPS 组相比,LPS+agomir 组大鼠LVEF%,LVFS%显著升高,LVVd显著下降(**P<0.01,***P<0.001;表1,图1)。通过化学发光免疫分析法,检测血浆中的NT-proBNP,结果显示:与LPS 组相比,LPS+agomir 组显著下降(***P<0.001;图2)。通过Q-PCR 检测了血浆及心肌组织中α-MHC、β-MHC mRNA 的表达变化,结果显示:与LPS 组相比,血浆及心肌组织中α-MHC mRNA 表达上调,β-MHC mRNA 表达下调(**P<0.01;图4、6);采用Western Blot 检测了心肌组织中α-MHC、β-MHC 的变化,结果发现:与LPS 组相比,LPS+agomir 组α-MHC 的 下 调 被 逆 转,β-MHC 显著下调(**P<0.01,图7、8)。
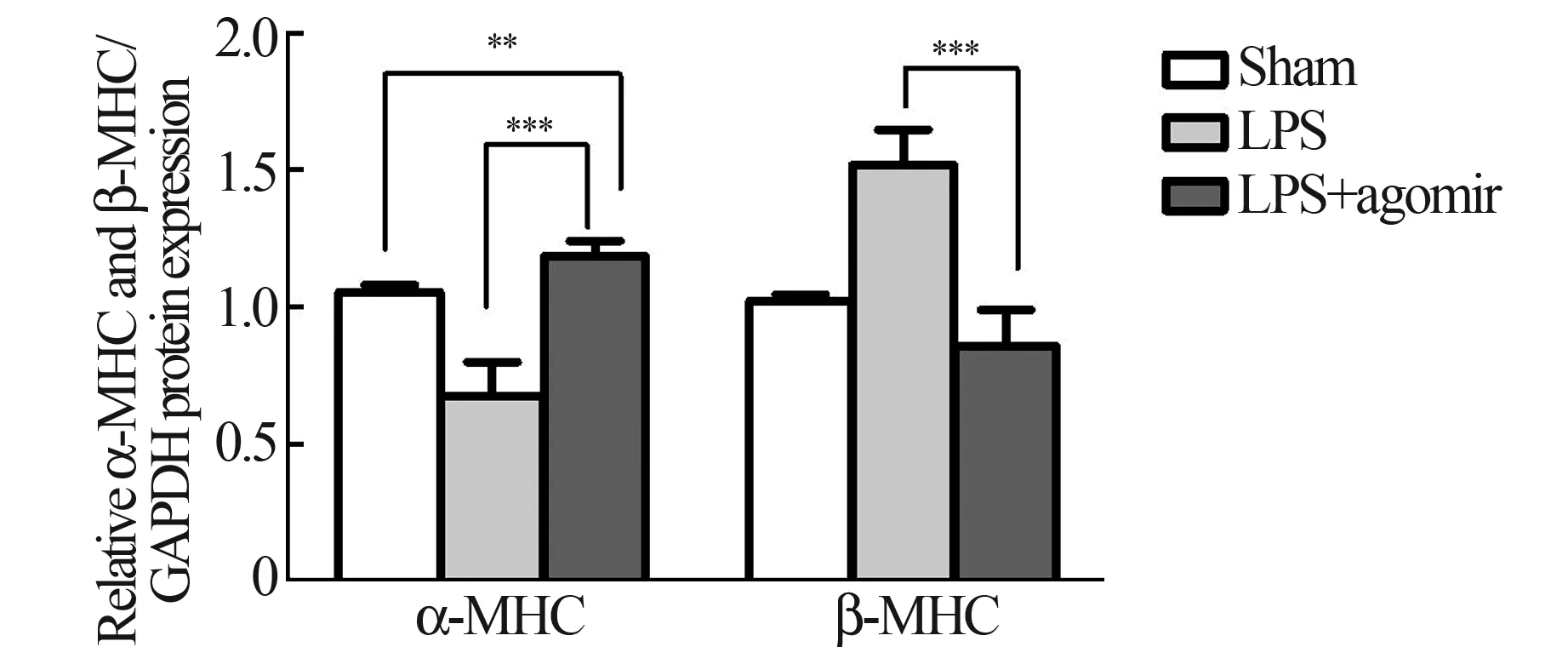
图7 各组大鼠心肌组织α-MHC、β-MHC 蛋白表达分析
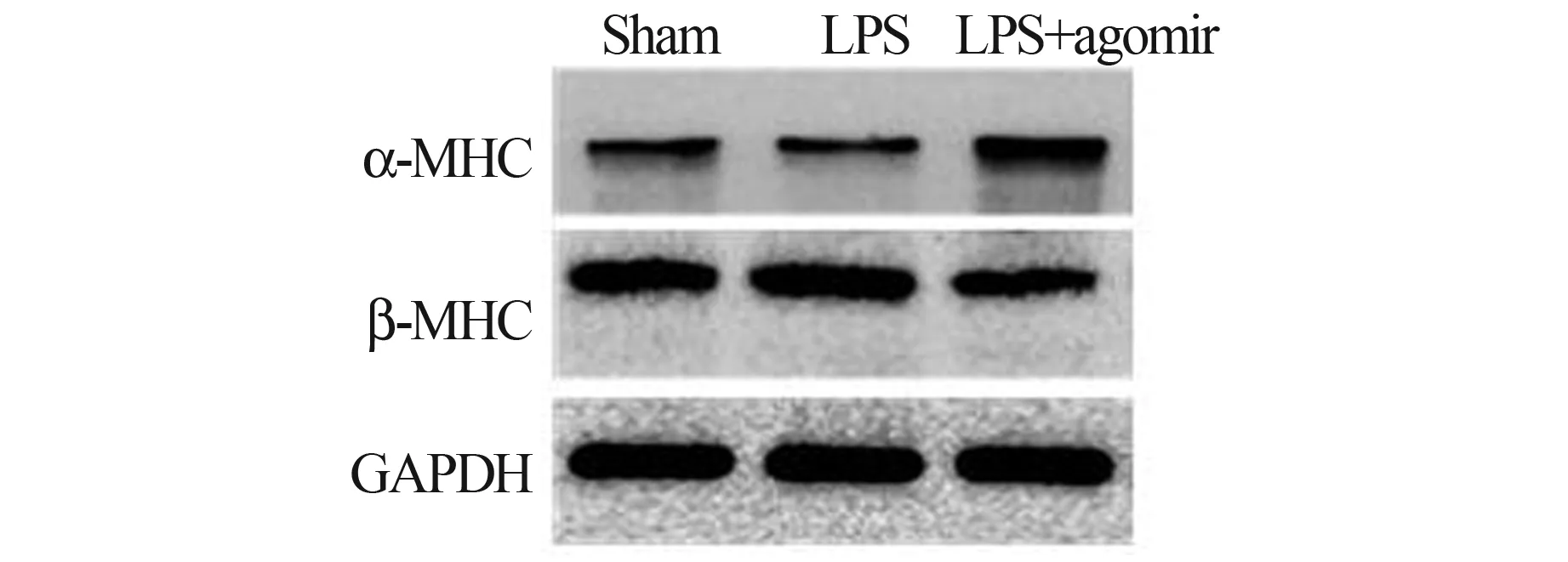
图8 各组大鼠心肌组织α-MHC、β-MHC 蛋白表达结果
3 讨论
脓毒症指因感染引起宿主反应失调而导致的危及生命的器官功能障碍,能导致多器官功能衰竭,是重症加强护理病房(Intensive Care Unit,ICU)常见的死亡原因之一[12]。脓毒血症一般为细菌的内毒素引起,也有人证明是不受控制的免疫和炎症反应、心肌和线粒体能量代谢紊乱及细胞凋亡导致[13]。miRNAs 是一类长约21~25 个核苷酸的非编码单链RNA 分子,通过种子序列与信使RNA 的3'末端非编码区(3'-UTR)上的相应靶点结合,从而调控基因表达[14]。研究发现,miRNA 在心血管生理及病理过程中发挥重要的调节作用[4-10,15-17]。在糖尿病心肌病中,miR-499 可导致β-MHC 表达的上调,引起心肌肥大、心功能障碍[6]。亦有研究发现,miR-499 在脓毒症心肌组织内表达量降低[8],并引导心肌细胞凋亡。
肌球蛋白重链(myosinheavy chain,MHC)由肌球蛋白重链α(α-MHC)和β(β-MHC)亚型构成,是心肌细胞的主要收缩蛋白[18]。其中α-MHC 有很强的ATP 酶活性,能催化ATP 水解为ADP,引起心肌收缩,而β-MHC 的催化能力弱[19],心脏泵衰竭后α-MHC 不能转化为β-MHC,并出现α-MHC 下调、β-MHC 上调,β-MHC/α-MHC 的比值增大,导致的结果是心肌收缩功能下降,是心力衰竭的重要标志[20]。既往的研究表明,在终末期心衰时,α-MHC的基因表达量可显著降低,而以α-MHC 转变为β-MHC 为特征的心肌重构,可降低心肌缩短速率及舒缩功能,促进心力衰竭的病情进展[21]。
在本研究中,我们观察了miR-499 与α-MHC、β-MHC 在脓毒症心功能障碍大鼠模型的血浆、心肌中的表达量的变化及其参与发病的可能机制。腹腔注射LPS 后大鼠出现了明显的精神萎靡,左心室整体收缩功能显著下降,血浆中NT-proBNP 显著升高,以上结果说明:脓毒症引起的大鼠心功能障碍模型建立成功。
通过检测大鼠血浆miR-499 的表达变化,发现模型组大鼠miR-499 水平较对照组显著下降,说明miR-499 可能参与了LPS 诱导的心功能障碍的发病。检测血浆中α-MHC、β-MHC mRNA 的表达变化,发现与对照组相比,模型组大鼠血浆中α-MHC mRNA 的表达水平显著下降,而β-MHC mRNA 的表达水平显著升高。这些结果表明:脓毒症引起的心功能障碍的发病伴随着miR-499、α-MHC、β-MHC 等物质的失调,它们可能共同参与了疾病的发生和发展。
过表达miR-499 后大鼠心功能改善,血浆及心肌组织中α-MHC 表达增加,β-MHC 水平下调,通过过表达miR-499,逆转了α-MHC 的降低,下调了β-MHC 的表达,说明靶向miR-499 的水平可以通过调节α-MHC、β-MHC 的表达改善脓毒症引起的心功能障碍。因此miR-499/MHC 途径可能成为治疗脓毒症心功能障碍的潜在靶标。
该研究也存在一些局限性,虽然miR-499 与临床疾病的发生、发展关系密切的报道很多,但miR-499 在脓毒症心功能障碍中的作用机理尚不明确。本课题在动物体内对miR-499 参与脓毒症心功能障碍的机制进行了一些研究,但缺乏临床大样本数据对动物实验结果进行验证,因此,在后期,我们也会在此基础上继续进行更深入的研究。
综上所述,miR-499 能通过调节大鼠心肌组织中α-MHC、β-MHC 的表达水平,改善脓毒症引起的心功能障碍,这些提示靶向调节miR-499 的表达可以成为治疗SMD 的有效途径。
