2型糖尿病患者周围神经传导速度异常的相关因素分析
2022-07-29梁玲霞李树法张梅姚佳丽赵猛李伟
梁玲霞 李树法 张梅 姚佳丽 赵猛 李伟
2型糖尿病(T2DM)是我国最常见的慢性病之一,T2DM最常见的并发症——周围神经病变(PN)的发病率已超过60%[1-2],其主要表现为肢体溃疡、坏疽感染,且药物治疗效果不佳,多数只能进行手术截肢治疗[3],给社会及家庭带来严重的经济负担。因此,及早发现T2DM患者的PN并进行有效干预成为临床工作中的重要任务之一。本研究主要探讨糖尿病周围神经病变(DNP)患者周围神经传导速度异常的特点及导致神经传导速度减慢的危险因素,旨在对T2DM的高危患者进行针对性的筛查,为早期诊断DNP并干预其进展提供参考依据。
对象与方法
1.对象:选取2018年5月~2019年8于徐州医科大学附属医院内分泌科就诊的T2DM患者198例,根据有无合并PN将其分为DPN组111例(56.1%,合并DPN)和非DPN(NDPN)组87例(43.9%,未合并DPN)。DPN的诊断标准依据2013年版《中国2型糖尿病防治指南》[4]:(1)既往明确诊断为T2DM,且在诊断时或之后出现的神经病变;(2)临床症状和体征与DPN表现相符,包括疼痛、麻木、感觉异常等;(3)以下5项检查中有2项或2项以上异常:①温度觉;②压力觉;③振动觉;④针刺觉;⑤踝反射消失;(4)肌电图检查中有2项或2项以上异常。同时满足上述4项标准可诊断为DPN。排除标准:(1)其他原因引起的周围神经病变,如慢性炎症性脱髓鞘性多发性神经病、脑梗死、格林-巴利综合征、颈椎及腰椎病变(椎管狭窄、神经根压迫、颈腰椎退行性变)、严重动静脉血管性病变(静脉栓塞、淋巴管炎)及化疗药物引起的神经毒性作用、肾功能不全引起的代谢毒物对神经的损伤;(2)资料不全或难以配合治疗;(3)合并严重心脏、肝脏、肾脏功能异常或伴有精神异常、凝血功能障碍。
2.方法
(1)实验室指标检测:所有患者均空腹8 h以上采集静脉血,采用全自动生化分析仪(日本奥林巴斯公司日立7600)检测空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、ALT、AST、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血尿酸(SUA)、Na+、K+、血尿素氮(BUN)、空腹C肽(FCP)、餐后2 h C肽(2h CP)等指标,采用全自动糖化血红蛋白分析仪(瑞士罗氏公司)检测糖化血红蛋白(HbA1c),根据检测结果计算血浆渗透压(POP),POP(mmol/L)=[Na+(mmol/L)+K+(mmol/L)]×2+FPG(mmol/L)+BUN(mmol/L)。所有患者均留取清晨中段尿送检尿微量白蛋白(UMA)。
(2)肌电图检查:采用丹麦Keypoint肌电图诱发电位仪,常温下由专人测量患者正中运动神经传导速度、正中感觉神经传导速度、双侧腓总运动神经传导速度及双侧腓肠感觉神经传导速度。
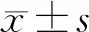
结 果
1.两组患者临床资料比较:DPN组患者年龄、病程、FPG、HbA1c、UMA、Na+、POP明显高于NDPN组,FCP、2h CP、双侧腓总运动神经传导速度、双侧腓肠感觉神经传导速度、正中运动神经传导速度、正中感觉神经传导速度均明显低于NDPN组(P<0.05);而两组患者其余指标比较差异均无统计学意义(P>0.05)。见表1。
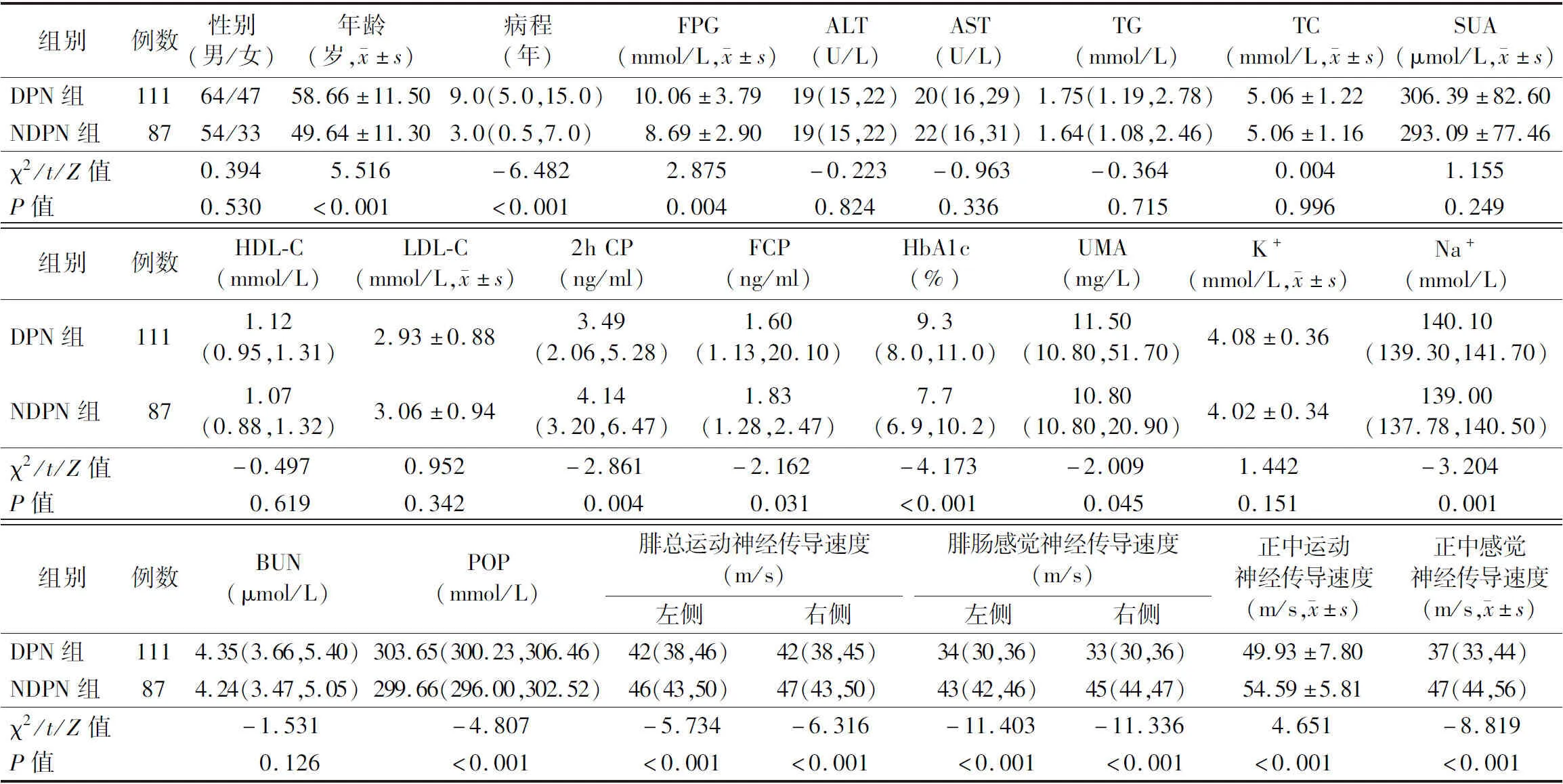
表1 两组患者临床资料比较[M(P25,P75)]
2.T2DM患者并发PN的危险因素分析:logistic回归分析结果显示,年龄、病程、HbA1c、POP均为T2DM患者并发PN的独立危险因素(P<0.05)。见表2。
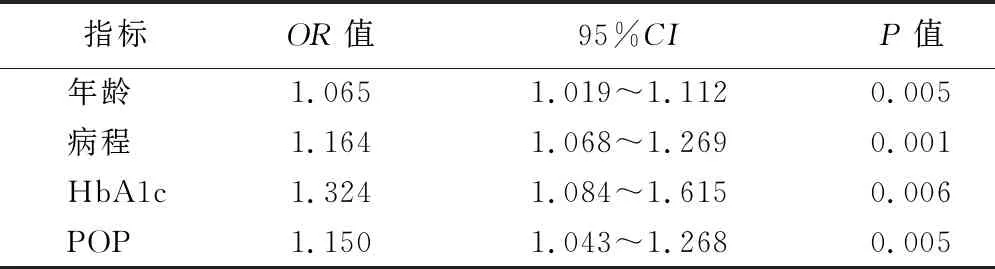
表2 T2DM患者发生DPN危险因素的logistic回归分析结果
3.不同POP水平T2DM患者PN患病率比较:根据POP水平四分位数将所有患者分为4组:Q1组(POP≤301.855 mmol/L)54例、Q2组(301.855 mmol/L
4.神经传导速度对T2DM患者发生PN的诊断价值:ROC曲线分析结果显示,左、右侧腓总运动神经传导速度、左、右侧腓肠感觉神经传导速度、正中运动神经传导速度、正中感觉神经传导速度预测T2DM患者发生PN的ROC曲线下面积(AUC)分别为0.737、0.761、0.972、0.969、0.718、0.865(P<0.001),其中双侧腓肠感觉神经传导速度对诊断T2DM患者发生PN的敏感度和特异度均高于双侧腓总运动神经传导速度、正中运动神经传导速度和正中感觉神经传导速度。见表3。

表3 神经传导速度对T2DM患者发生PN诊断价值的ROC曲线分析结果
讨 论
目前,DNP的发病机制尚不十分明确,致病因素较多且发病机制复杂,除与年龄、病程相关外,相关研究认为还与体内持续高血糖导致的糖脂代谢紊乱、氧化应激、炎症反应、神经营养因子缺失、神经免疫损伤等因素相关[5-6]。由于DPN患者出现相关临床表现时已存在不可逆的损伤,及早发现周围神经传导速度异常成为主要任务。本研究中,DPN组患者下肢各条神经传导速度均明显低于NDPN组,提示肌电图检查可作为临床筛查周围神经病变最准确、有效的手段。
本研究中,56.1%的T2DM患者已出现PN,DPN组除年龄、病程不可控因素可增加发病风险外,FCP、2h CP的减少均是加速其进展的危险因素,这可能与血清C肽降低对周围神经的保护作用减弱有关。血清C肽是一种具有抗氧化应激、抗炎性反应、抗细胞调亡的多肽[7],与周围神经的电流感觉阈值呈负相关[8],表明血清C肽不仅具有保护周围神经,促进C纤维再生的能力,还可保持周围神经对外界电刺激的敏感性。C肽水平还可反映胰岛β细胞分泌胰岛素的功能。在离体实验中发现,胰岛素可保护高糖状态下的周围神经,受血糖影响的神经动作电位(NAP)也能被胰岛素部分逆转[9]。此外,胰岛素还可以增加糖原形成和促进糖酵解的方式抵消甲基乙二醛对Na+通道的影响,维持体内渗透压稳定[10]。因此,当T2DM患者体内胰岛素、C肽分泌减少时,不仅会导致周围神经损伤持续进展,还会影响体内的POP水平。
除上述胰岛素对体内POP水平造成的影响外,患者血液中高浓度的血糖蓄积也会造成Na+水平异常[11],血糖、Na+水平升高直接导致高渗状态。本研究结果显示,DPN组患者POP水平较NDPN组明显升高,分析发现,即使T2DM患者POP水平处于正常范围,PN的发生率也会随着POP的升高而增加。这与高渗状态导致醛糖还原酶(AR)-RNA表达升高有关,AR可通过参与雪旺细胞(SCs)多元醇途径导致DPN的发生[12]。SCs是存在于周围神经系统的胶质细胞,参与髓鞘保护轴突的形成[13],可分泌多种神经营养因子,促进受损神经元的修复,诱导轴突再生[14]。SCs不仅受POP水平的影响,对血糖浓度也极为敏感,长期高糖状态可影响SCs的代谢、增殖、凋亡,使SCs功能结构异常从而加速周围神经损伤。此外,高糖状态还会通过炎性因子释放、代谢产物蓄积和活性氧化应激[15]等一系列反应,引起周围神经缺血、缺氧,从而导致下肢神经传导速度的减慢。因此,T2DM患者POP、血糖水平升高都是导致周围神经病变的危险因素。本研究数据也显示,HbA1c、POP是T2DM患者DPN发病的独立危险因素。POP水平升高不仅可引起大脑脱水,造成高渗昏迷,还可增加DPN的发生,在临床诊疗过程中,要警惕POP异常患者,需及早进行肌电图筛查。同时,控制血糖水平仍是糖尿病长期治疗的首要任务,在进行药物治疗的同时,还可通过调节生活方式改善血糖水平,减少高血糖对血管、神经、细胞的损害。
本研究中,DPN组患者UMA水平明显高于NDPN组,表明UMA水平不仅可反映肾小球的病变情况,也可反映周围神经的损伤程度,这是因为长期高糖状态可使AR活性增强,加速山梨醇的生成,大量堆积的山梨醇会引起神经细胞肿胀、轴突萎缩、神经纤维脱髓鞘,使神经传导速度出现异常[16]。同时,过量的山梨醇不能及时转化成果糖参与细胞代谢,造成糖化产物聚集在细胞内,使肾脏的渗透性异常[17],导致肾脏损伤出现蛋白尿。有实验使用AR抑制剂改善实验性糖尿病动物周围神经的功能和结构异常[18],其作用机制为抑制AR活性;其次改善还原型辅酶Ⅱ(NADPH)/辅酶Ⅱ(NADP)的紊乱状态,NADPH/NADP异常可引起代谢失衡、氧化应激敏感性增加,导致神经传导速度减慢[19]。目前临床上采用的依帕司他联合硫辛酸通过抑制AR活性用于治疗周围神经病变[20],对改善患者周围神经功能、减轻肾脏损害有一定作用。在临床中,当患者出现蛋白尿时应警惕有无周围神经的损伤。
临床研究发现,DPN所累及的神经以周围神经最为常见,感觉神经、运动神经、自主神经都可受到不同程度的损伤,其中对感觉神经的影响最大[21]。本研究中,双侧腓肠感觉神经传导速度预测周围神经损伤的敏感度和特异度更高,这是因为在周围神经受损过程中,神经-组织屏障对位于背根神经节的感觉神经元保护作用较小,更易受到各种因素的干扰,且感觉神经纤维直径小于运动神经纤维[22],导致感觉神经比运动神经更易受损,更早表现出传导速度异常。因此腓肠感觉神经出现异常更具临床诊断意义。
综上所述,DPN的发病机制较复杂,可受多种因素影响,在对T2DM患者进行血糖调控的同时,需要注意监测HbA1c、UMA、FCP、POP,血糖控制欠佳、出现蛋白尿、血清C肽水平降低、POP升高的患者要定期完善肌电图检查,并对此类高危人群进行科学宣教,通过优质的生活方式和适当的体育运动预防周围神经病变的发生;已出现周围神经病变的患者要及时进行专业治疗,延缓病变进展速度,降低患者的伤残率。
