复发性甲状旁腺癌并转移一例
2022-07-28陶璃娜钟雪玉钟晶敏曾天舒袁莉张皎月
陶璃娜 钟雪玉 钟晶敏 曾天舒 袁莉 张皎月
患者,男,41岁,因“甲状旁腺癌术后1年余,双下肢疼痛2月余”于2020年1月7日在华中科技大学同济医学院附属协和医院内分泌科就诊。患者2018年1月因声嘶、偶有呛咳,于当地医院行甲状腺彩超结果示左侧叶下极可见一大小约2.9 cm×2.1 cm低回声团,形态不规则,向包膜外凸出,内见细小强回声光斑。同年2月行左侧甲状腺及肿物+峡部+右侧部分甲状腺+肿瘤周围软组织扩大切除术和淋巴结清扫术,术后病检示甲状旁腺癌(PC),术后监测患者甲状旁腺功能及血钙水平呈一过性下降,对症处理后血钙正常。2019年1月患者再次出现左颈部包块,渐进性增大,质地坚硬,表面不光滑,边界不清,无压痛。同年6月于我院行左侧甲状腺肿物切除和淋巴结清扫术,术后病检结果示侵袭性或转移性PC(图1、2),术后血钙及甲状旁腺激素(PTH)水平逐渐下降(但均未恢复至正常水平),出院后多次查血钙水平波动于3.50~4.00 mmol/L(2.03~2.54 mmol/L,括号内为正常参考值范围,以下相同),期间未予特殊处理。患者前后两次手术后第4~5天血钙水平最低,分别为1.89 mmol/L和2.79 mmol/L,第1次手术后第1天PTH水平最低(<2.5 ng/L),术后1周其水平逐渐上升。2019年11月患者出现双下肢疼痛、乏力,后逐渐出现全身多处关节疼痛,伴反酸、嗳气、呕吐、夜尿增多,偶有心悸、胸闷,多次于当地医院查血钙水平高(具体数值不详),为求进一步治疗,遂来我院就诊。患者既往无特殊病史。体格检查:T 36.5 ℃,P 80次/分,R 20次/分,Bp 110/64 mmHg,颈部左侧原甲状腺区可触及一大小约2 cm×2 cm包块,质硬,无压痛,边界不清,移动度差,左锁骨上区可触及多个肿大淋巴结,四肢骨骼无畸形。实验室检查:血生化:AST 139 U/L(17~59 U/L),碱性磷酸酶767 U/L(38~126 U/L),肌酐133.5 μmol/L(58.0~110.0 μmol/L),肾小球滤过率56.54 ml/min(90.00~120.00 ml/min),尿酸663.8 μmol/L(208.0~506.0 μmol/L),血钙4.12 mmol/L,血钾3.14 mmol/L(3.5~5.1 mmol/L),血磷0.51 mmol/L(0.81~1.45 mmol/L);红细胞沉降率73 mm/h(<15 mm/h);24小时尿电解质示尿钙37.22 mmol/24 h(2.50~7.50 mmol/24 h),尿钾110.0 mmol/24 h(25~100 mmol/24 h),尿镁9.86 mmol/24 h(3.0~5.0 mmo/24 h);PTH 4 737.86 pg/ml(15.00~65.00 pg/ml)。肾脏B超检查结果:双肾实质增强,双肾小结石。全身骨发射单光子计算机断层扫描仪(ECT)显像结果:全身骨骼骨代谢轻度异常升高,考虑代谢性骨病可能。全身甲基异腈类化合物(99mTc-MIBI)显像+CT融合结果:1.左叶甲状腺区域软组织结节MIBI显像阳性,考虑PC复发可能;2.左侧锁骨上区多发肿大淋巴结影,MIBI显像阴性,不除外肿瘤转移可能(图3)。氟代脱氧葡萄糖(18F-FDG)全身正电子发射计算机断层显像(PET-CT)检查结果:1.原左叶甲状腺区软组织密度影,代谢轻度增高,形态明显增大,考虑PC复发可能性大;2.双侧颈部多发淋巴结,代谢不高,部分形态较前次形态稍增大;双肺多发结节(直径约0.3~0.7 cm),代谢不高,部分形态较前增大,部分为新发病灶,以上考虑转移性病变可能性大;3.探测范围内大部分骨骼骨皮质较毛糙,代谢对称性异常增高,考虑为代谢性骨病改变(图4)。诊断为复发性PC并肺部转移,高钙危象。住院期间给予大量补液、利尿、大剂量降钙素(鲑鱼降钙素400 U/d)、西那卡塞、双磷酸盐等治疗效果不佳;透析对血钙水平下降的作用持续时间较短,不足24小时。患者因经济原因未能进一步行手术或其他治疗,要求出院。2020年7月电话随访,患者全身乏力,多次在当地医院输液治疗,血钙维持在3.0~3.5 mmol/L之间。
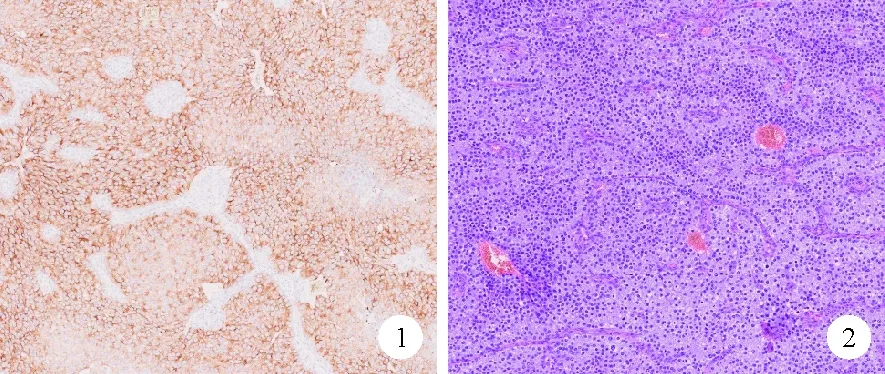
图1 2019年6月患者左侧甲状腺肿物病理染色结果[A:PTH免疫组化染色阳性(×100);B:物苏木素-尹红(HE)染色结果:可见肿瘤细胞呈弥漫性生长,间以纤细的血管分隔,胞浆淡嗜酸性,可见核周空晕(×100)]
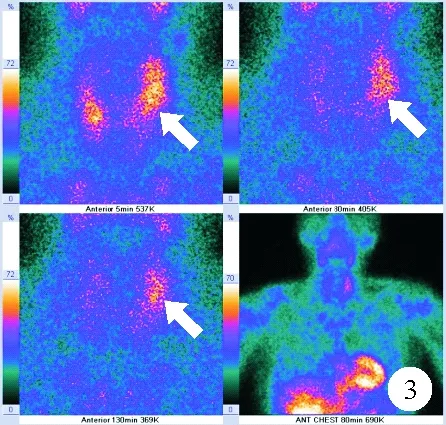
图3 2020年1月患者全身99mTc-MIBI检查结果:左叶甲状腺区域可见显像剂异常浓缩影,如箭头所示
讨 论
PC是一种罕见的内分泌恶性肿瘤,起源于甲状旁腺的实质细胞,发病率占全身肿瘤的0.05%,占原发性甲状旁腺功能亢进症患者的0.5%~5.0%。PC复发率高达50%。大多数复发患者发生在首次术后2~3年内。PC缺乏特异生物学标志物,所以常与甲状旁腺瘤难以鉴别,除非已发生远处转移,PC的诊断通常结合术中表现和术后病理学检查结果确诊。目前PC诊断中最常用的影像学检查为高分辨颈部超声和核素显像。超声下甲状旁腺区较大包块直径>15 mm、不均一低回声、分叶状轮廓、包块深度/宽度≥1常提示PC[1]。组织病理学检查发现转移及侵袭浸润的特点是诊断PC的金标准。非编码RNA包括微小核糖核酸(miRNA)和长链非编码RNA(lncRNA)的异常表达可能参与了PC的发生[2]。lncRNAPVT1和GLIS2-AS1可能成为诊断PC的标志物[3]。
PC首选外科手术治疗,首次手术的完整切除对预后至关重要。PC连带同侧甲状腺叶包括峡部整块切除的根治手术是国际公认的局限性PC手术方式。相对彻底地切除复发和转移病灶可使血钙水平维持正常数月至数年不等。据统计,从1984~2015年国内共有61篇文献报道了234例PC患者,共计手术329例次,平均每例1.41次,91例复发患者中再次手术的有效率为70.77%,术后复发再次手术能延长患者的生存时间[4]。针对患者的内科治疗可分为3个部分:(1)手术前,治疗目标是降低和稳定血钙水平,为手术创造条件,当然也需针对已有的并发症(肾脏、消化系统、骨骼等)进行治疗;(2)手术后,近期治疗目标是处理好术后骨饥饿综合征,预防严重低钙血症及其并发症的发生;远期治疗目标主要是保护骨骼,修复已有的骨骼损伤;(3)针对复发后的高钙血症进行药物治疗等[5]。临床上所用的降血钙药物作用疗效通常持续较短,如膦酸盐、降钙素、糖皮质激素等。钙敏感受体拮抗剂西那卡塞可作用于甲状旁腺细胞表面的钙受体,抑制甲状旁腺素的合成和分泌,从而降低血清PTH浓度。地诺单抗是一种全人单克隆抗体,针对核因子κB受体活化因子配基(RANKL)的破骨细胞中枢刺激器活动,抑制破骨细胞活化和发展,减少骨吸收,可用于双膦酸盐抵抗或禁用的高钙血症,对于因各种原因未能行手术治疗的患者仍有以下方法可尝试。应用PTH肽免疫疗法,阻断B细胞对人PTH的耐受性,产生抗PTH的抗体,促进血清PTH和钙水平持续下降,此疗法可用于多种内分泌肿瘤以控制激素生成过多。超声引导下经皮注射无水酒精或微波消融也是一种姑息治疗方法。PC对放化疗不敏感,但部分研究报道PC首次手术后给予40~70 Gy的剂量放疗,可使术后复发率下降[6]。对于一部分顽固性或肾功能不全的高钙危重患者,可考虑选用低钙或无钙透析液进行腹膜透析或血液透析,可迅速降低血钙水平。有研究证实采用血液灌流(HP)净化方法后PTH水平显著下降[7]。
本例患者因持续高血钙及高PTH水平怀疑PC复发,甲状旁腺99mTc-MIBI扫描后更加明确诊断。PET-CT结果显示患者已出现淋巴结及远处转移。美国国家癌症数据库的资料显示PC的10年生存率为49%,局部复发后的生存期为6年、发生远处转移者的生存期为4.5年。因此,此类患者应注意监测癌症复发可能,尽早行手术治疗,避免出现远处转移而丧失手术机会。
