miR-146a尾静脉注射对阿尔茨海默病大鼠认知能力、Th17/Treg分布及炎症因子水平的影响
2022-07-28谢平安廖辉张艳敏杜从斌
谢平安,廖辉 ,张艳敏,杜从斌
1天津中医药大学第一附属医院老年病科国家中医针灸临床医学研究中心,天津 300192;2天津市第四中心医院中医科;3天津市黄河医院神经内科
我国阿尔茨海默病(AD)发病率较高[1-2]。大部分AD患者初期会出现记忆能力及判断能力减退,随着病情发展,认知功能、精神行为及生活能力逐渐降低[3]。近年研究发现,AD的发生、发展与机体炎症及免疫反应有一定关系[4]。还有研究发现,人大脑中含有一些miRNAs,与神经系统的发育及神经系统相关疾病的发生、发展密切相关,并影响机体免疫过程及炎症反应[5]。有学者发现,上调miR-146a表达可减少癫痫大鼠海马神经元凋亡,降低炎症因子水平[6]。张斌[7]研究发现,AD 患者血miR-146a水平较低,认为miR-146a在AD的发生发展中发挥重要作用。目前对于miR-146a影响AD的相关机制是否涉及免疫反应和炎症因子,尚无明确结论。2021年6月—12月,本研究观察了miR-146a对AD大鼠认知能力、辅助性T细胞(Th17)/调节性T细胞(Treg)分布及炎症因子水平的影响。现报告如下。
1 材料与方法
1.1 实验动物与主要材料 健康雄性SD大鼠60只,鼠龄10~12周,体质量200~250 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(沪)2017-0011。本研究方案经动物伦理委员会批准。Aβ25-35购自上海皓元公司。miR-146a agomir购自上海吉玛公司。肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-1β、IL-6 ELISA试剂盒购自上海酶联生物公司。流式细胞分析仪(FACS Verse)购自美国Becton Dickinson公司。
1.2 动物分组、造模及给药方法 将60只大鼠随机分为假手术组、AD组、miR-146a+AD组,每组20只。给予大鼠自由摄食和饮水,12 h/12 h光暗循环,(21±2)℃下饲养7 d。大鼠适应实验室环境后,AD组、miR-146a+AD组制作AD模型:将Aβ25-35稀释成2µg/µL,用3%戊巴比妥钠30 mg/kg腹膜内注射麻醉大鼠,剔除大鼠头顶部被毛,切开头皮,暴露颅骨,按照前囟进行定位,前囟后0.8 mm、左右旁开1.5 mm处进行标记,注射器针头在标记处钻取直径约1 mm的小孔,挑破大鼠硬脑膜,于海马区域注射Aβ25-35 5µL。假手术组仅开颅窗后注入等量生理盐水,用骨蜡封闭。针孔使用牙托粉填补,使用庆大霉素防止伤口感染,将皮肤缝合并再次消毒。miR-146a+AD组随即通过尾部静脉一次性注射1×108PFU/mL的miR-146a agomir 100µL。
1.3 认知能力评价 采用水迷宫实验。造模第1、2、3、4天进行定位导航测试,将大鼠放入水中,记录每只大鼠从起始点到平台所用时间为逃逸潜伏期时间;若大鼠60 s内无法找到平台,则将其引导至平台并允许其在平台停留15 s,将逃逸潜伏期记录为60 s。造模第5天撤去平台进行空间探索实验,将大鼠由距离平台最远象限放入水中,记录60 s内大鼠在目标象限停留时间及穿越平台次数。
1.4 Th17/Treg分布测算 水迷宫实验结束后,收集大鼠全血250µL,用RPMI1640培养基稀释,在37℃、5% CO2条件下中孵育4 h。离心,除去上清液后,加入红细胞裂解缓冲液,于黑暗中温育10 min。离心,去除上清液,加入FITC标记的抗CD4并充分混合,2~8℃黑暗环境中孵育15 min。加入染色缓冲液重悬细胞,以1 200 r/min离心5 min。除去上清液,加入缓冲液混合,2~8℃黑暗环境中孵育20 min,加入1×渗透/洗涤缓冲液混合。离心,去上清液,留250µL液体,加入1×洗涤缓冲液重悬细胞。以1 200 r/min离心5 min,去上清液,加入染色缓冲液重悬细胞,加入PE标记的抗体,黑暗中孵育30 min。加入1×渗透/洗涤缓冲液以重悬细胞,以1 200 r/min离心5 min,除去上清液。最后,加入染色缓冲液重悬细胞,过滤后上流式细胞仪分析。
1.5 海马组织中TNF-α、IL-1β、IL-6检测 造模8周后,通过腹腔注射3%戊巴比妥钠处死大鼠,断头取脑,冰上小心分离海马组织,于-80℃保存。取海马组织称重,置于均化器中,得到裂解物于4℃下12 000 r/min离心20 min,收集上清液。使用ELISA法检测上清液中的TNF-α、IL-1β、IL-6。设空白孔、标准品孔、待测样品孔。将浓度为0的SO号标准品加入空白孔,标准品孔中加入不同浓度的标准品50µL,样本孔先加入待测样本10µL,再加样本稀释液40µL,空白孔不加。除空白孔外,标准品孔和样本孔加入辣根过氧化物酶标记的抗体,用封板膜封住反应孔,37℃水浴锅温育65 min,弃去液体,吸水纸上拍干,每孔加满洗涤液,静置2 min,甩去洗涤液,吸水纸上拍干,依此重复6次。每孔加入底物A、B各50µL,37℃避光孵育10 min。每孔加入终止液50µL,15 min内,在450 nm波长处测定各孔OD值,代表炎症因子水平。
1.6 统计学方法 采用SPSS21.0统计软件。计量资料以±s表示,采用Kolmogorov-Smirnov进行正态性检验,采用Bartlett法进行方差齐性检验,多组间比较采用单因素方差分析,进一步两两组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠认知能力比较 AD组造模1~4 d逃逸潜伏期均长于假手术组,目标象限停留时间与穿越平台次数少于假手术组;miR-146a+AD组逃逸潜伏期短于AD组,目标象限停留时间与穿越平台次数多于AD组(P均<0.05)。见表1。
表1 各组大鼠认知能力指标比较(±s)
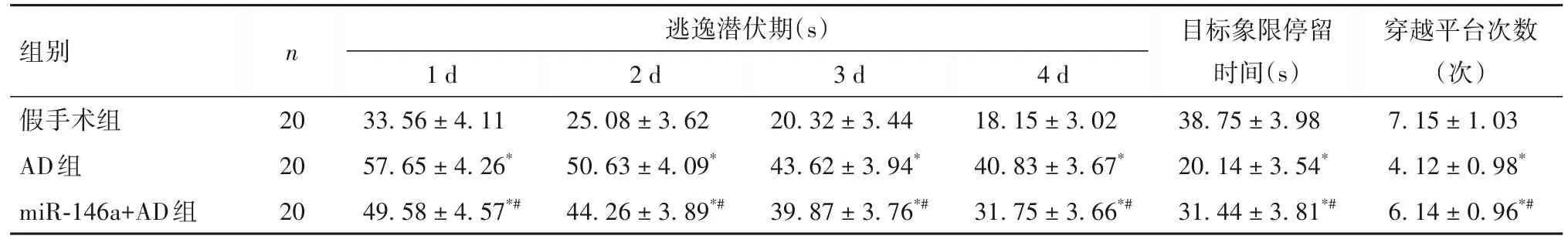
表1 各组大鼠认知能力指标比较(±s)
注:与假手术组相比,*P<0.05;与AD组相比,#P<0.05。
组别n 逃逸潜伏期(s)穿越平台次数(次)7.15±1.03 4.12±0.98*6.14±0.96*#1 d 33.56±4.11 57.65±4.26*49.58±4.57*#2 d 25.08±3.62 50.63±4.09*44.26±3.89*#3 d 20.32±3.44 43.62±3.94*39.87±3.76*#4 d 18.15±3.02 40.83±3.67*31.75±3.66*#目标象限停留时间(s)38.75±3.98 20.14±3.54*31.44±3.81*#假手术组AD组miR-146a+AD组20 20 20
2.2 各组大鼠血清Th17/Treg分布比较 AD组CD4+IL-17A+Th17比例低于假手术组、CD4+CD2 5+Foxp3+Treg比例高于假手术组;miR-146a+AD组CD4+IL-17A+Th17比例高于AD组、CD4+CD25+Foxp 3+Treg比例低于AD组(P均<0.05)。见表2。
表2 各组大鼠血清Th17/Treg分布比较(%,±s)

表2 各组大鼠血清Th17/Treg分布比较(%,±s)
注:与假手术组相比,*P<0.05;与AD组相比,#P<0.05。
组别假手术组AD组miR-146a+AD组CD4+CD25+Foxp3+Treg 5.69±1.11 3.45±0.87*4.87±1.03*#n 20 20 20 CD4+IL-17A+Th17 1.22±0.39 2.16±0.64*1.81±0.58*#
2.3 各组大鼠血清炎症因子水平比较 AD组血清IL-1β、IL-6、TNF-α水平高于假手术组,miR-146a+AD组血清IL-1β、IL-6、TNF-α水平低于AD组(P均<0.05)。见表3。
表3 各组大鼠血清炎症因子水平比较(pg/mL,±s)

表3 各组大鼠血清炎症因子水平比较(pg/mL,±s)
注:与假手术组相比,*P<0.05;与AD组相比,#P<0.05。
组别假手术组AD组miR-146a+AD组TNF-α 30.48±5.91 60.23±8.87*41.37±7.13*#n 20 20 20 IL-1β 21.62±3.98 42.08±6.26*37.62±5.97*#IL-6 23.56±4.41 57.44±7.39*42.50±6.14*#
3 讨论
AD是一种发病原因复杂的神经退行性疾病,中枢神经系统会出现长期的慢性炎症,且小胶质细胞的长期过度激活也能促进炎症介导的认知功能损伤和细胞毒性[8]。AD的发生机制尚未完全明确。近年研究发现,miRNAs在脑组织中表达丰富,能调节神经元内多个靶点,调节神经系统发育、分化,而神经系统内miRNAs相关蛋白表达异常与多种神经退行性疾病的发生密切相关[9]。miR-146a为被认为是首个具有免疫调节作用的miRNAs,在固有炎症、免疫反应等生物学过程中具有重要作用[10]。既往研究发现,miR-146a在一些疾病中具有抑制脑部炎症的功能。刘翀等[11]研究表明,新生缺氧缺血性脑病大鼠miR-146a表达显著低于正常大鼠,上调miR-146a表达可通过抑制神经炎症而减轻症状,认为miR-146a具有一定抗炎效果。但对于miR-146a在AD中的表达和相关调控机制,目前尚不清楚。
本研究观察了miR-146a对AD大鼠认知能力、Th17/Treg分布及炎症因子水平的影响,结果显示,AD组造模1~4 d逃逸潜伏期均长于假手术组,目标象限停留时间与穿越平台次数少于假手术组;miR-146a+AD组逃逸潜伏期短于AD组,目标象限停留时间与穿越平台次数多于AD组。水迷宫实验可反映大鼠的认知能力、记忆力及学习能力[12-13],上述结果表明,通过升高miR-146a表达可明显改善AD大鼠的认知能力,miR-146a表达上调对AD症状具有一定干预作用。
同时,我们也观察到AD大鼠的Th17/Treg平衡出现改变,AD大鼠建模后Th17比例升高,Treg比例降低,这表明AD会导致免疫紊乱。温国辉等[14]通过比较58例AD患者和30例健康受试者的Th17/Treg,发现AD患者外周血Th17比例高于健康受试者,Treg比例低于健康受试者,与本研究结果一致。这是由于AD核心发病机制为β淀粉样蛋白异常聚集,可造成慢性炎症,同时有研究指出AD患者外周血可出现β淀粉样蛋白特异性T细胞比例升高,表现为自体免疫性疾病症状,导致Th17/Treg失衡[15]。薄纯锐等[16]指出,miR-146a对机体免疫有调控作用,从而参与神经系统疾病的发病。本研究结果显示,miR-146a+AD组CD4+IL-17A+Th17比例高于AD组,CD4+CD25+Foxp3+Treg比例低于AD组,提示miR-146a可能通过调节Th17/Treg发挥治疗作用。
Th17细胞可通过产生多种促炎因子(如IL-6、IL-17、IL-21等)参与各种炎症性疾病的发展,而AD的发生多与脑组织内神经元持续炎症反应有关[17]。因此,我们对各组大鼠海马组织炎症因子(TNF-α、IL-1β、IL-6)进行了检测,结果发现,AD组大鼠TNF-α、IL-1β、IL-6水平显著高于对照组,这表明AD大鼠合并脑部炎症,与既往研究类似[18]。TNF-α可通过触发各种信号通路,激活炎症反应,刺激IL-6、IL-1β表达[19]。GUAN等[20]研究认为,AD等神经退行性疾病会因先天免疫介导的神经炎症促进疾病的发生及进展,通过激活小神经胶质细胞,诱导炎症因子释放,激活核苷酸结合寡聚化结构域样受体3通路,导致神经变性。本研究发现,上调miR-146a表达后,大鼠海马组织TNF-α、IL-1β、IL-6水平显著降低,提示上调miR-146a表达可减轻AD大鼠的脑部炎症。研究表明,miR-146a作为NF-κB依赖性基因,能通过抑制IL-1受体相关激酶1、人类单核细胞肿瘤坏死因子受体相关因子6从而下调NF-κB表达,减轻脑组织内神经元持续炎症;同时,miR-146a可靶向作用于补体因子H、β-APP相关蛋白,减轻AD大脑炎症[21]。
综上所述,miR-146a可改善AD大鼠的认知能力,调节Th17/Treg平衡,减轻AD脑部炎症。然而,miR-146a对AD的治疗作用影响到哪些信号通路目前尚不明确,既往研究发现PI3K/Akt/Gsk3β信号通路、p38 MAPK信号通路均为影响AD的信号通路[22-23],我们今后的研究将会对这些信号通路进行探索。此外,一些治疗AD的药物是否会对miR-146a产生影响或通过miR-146a发挥作用,也有望在之后的研究中进一步明确。
