黏液性脂肪肉瘤1例
2022-07-28李逍山何效娥贺震胡建明
李逍山 何效娥 贺震 胡建明
脂肪肉瘤是一种比较少见的软组织肉瘤,主要表现为无痛性肿块,生长缓慢,病程可长达数年,它们约占所有恶性软组织肿瘤的16%~18%。脂肪肉瘤通常见于成人,儿童很少发生。大约90%~95%的肿瘤发生在躯干、四肢或腹膜后,6%发生在头部和颈部区域,胸内起源的脂肪肉瘤很少见,占2.7%[1]。当胸腔内发生时,最常发生在纵隔,起源于肺部的病例极为罕见,文献中报道约20例,通常为转移瘤。黏液性脂肪肉瘤(Myxoid liposarcoma,MLPS)是脂肪肉瘤的一种亚型,肺部黏液性脂肪肉瘤极为罕见,目前国内外报道甚少。因其具有临床表现缺乏特异性、起病隐匿、进展缓慢、不易诊断、易复发等特点,易误诊,治疗尚不理想。为进一步提高对黏液性脂肪肉瘤的认识,避免临床漏诊及误诊,现结合相关文献,就我院呼吸与危重症医学科新诊断的1例肺部转移性黏液性脂肪肉瘤的临床病理学特征、诊断及治疗予以报道。
临床资料
患者女性,70岁,农民。因间断咳嗽、咳痰、气短1年余,加重伴胸痛1月,于2021年2月19日到兰州大学第一医院就诊。并以“肺部阴影”收住入院。入院后胸部CT平扫提示下后纵隔及腹膜后巨大软组织肿块影,密度不均,其内可见絮状脂肪密度影,病灶包绕主动脉,胃部分受包绕,肝脏及下腔静脉明显受推挤前移,下腔静脉形态失常,纵隔及右侧心隔角多发淋巴结肿大,考虑恶性肿瘤。双侧胸廓对称,气管纵隔居中;双肺支气管血管束清晰,走行分布自然,右肺多发索条及斑片状实变影,考虑转移;右侧胸膜弥漫性软组织密度结节、肿块影,右侧胸腔大量积液并右肺膨胀不全,考虑转移;左侧胸腔少量积液,双侧主支气管及叶、段支气管通畅,未见明显狭窄或扩张;心脏未见明显异常,主动脉及冠脉硬化;肝脏多发类圆形低密度影,考虑囊肿。左侧锁骨下囊状低密度影,淋巴管囊肿可能(图1~3)。
电子胸腔镜检查见大量深黄色胸水,术中共吸出胸水约900mL,脏、壁层胸膜及隔胸膜表面多发大小不一结节样肿物,尤以下壁层胸膜为著,肺组织膨胀可(图4)。
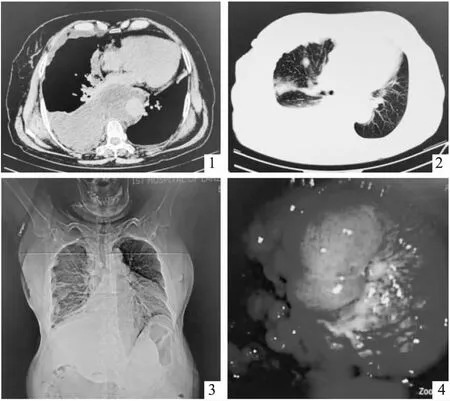
图1、2 胸部CT示下后纵隔及腹膜后巨大软组织肿块影,纵隔及右侧心隔角多发淋巴结肿大;右肺多发索条及斑片状实变影;右侧胸膜弥漫性软组织密度结节、肿块影;双侧胸腔积液 图3 胸部平片示右肺多发大小不等块状影;双侧胸腔积液,右侧为著;肝脏多发类圆形低密度影,左侧锁骨下囊状低密度影 图4电子胸腔镜检查示脏、壁层胸膜及膈胸膜表面多发大小不一结节样肿物
胸水涂片可在红细胞背景中见少许组织细胞、间皮细胞,细胞核增大,轻度不规则。经内镜病理组织活检,见组织表面部分被覆间皮细胞,瘤细胞多形性、梭形、卵圆形、上皮样,可见部分细胞胞浆丰富、粉染、透亮,部分胞浆多泡状,呈脂肪母细胞样。可见部分巨核、奇异核及多核瘤细胞,呈弥漫排列,间质黏液丰富,小血管较丰富,部分血管透明变性,部分区域可见大小不等的腔隙,腔内可见较多粉染液,瘤组织浸润性生长(图5、6)。免疫组化结果显示CR(少量+),WT1(-),ckp(-),vimentin(3+),S-100(部分+),p53(60%),CEA(-),ki67(10%,局部20%),sox10(-),MDM2(-),CDK4(-),P16(2+),CD34(少许+),SMA(极少许+),Desmin(-)。提示恶性间叶源性肿瘤。
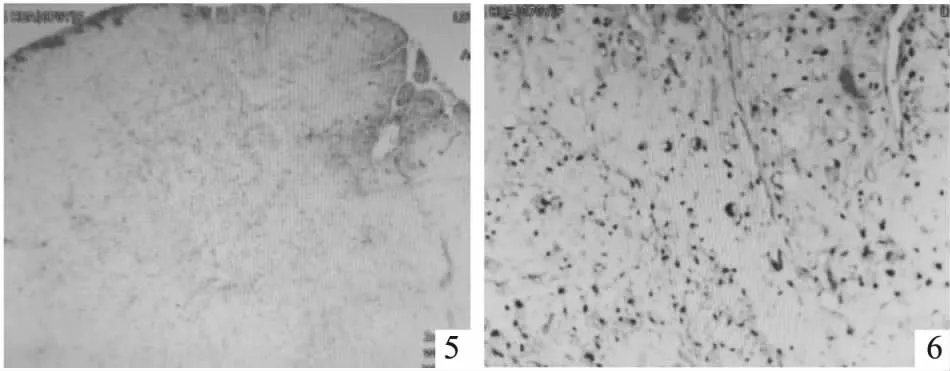
图5、6 病理组织活检示组织表面部分被覆间皮细胞,瘤细胞多形性,可见部分细胞胞浆丰富、粉染、透亮,部分胞浆多泡状,呈脂肪母细胞样。可见部分巨核、奇异核及多核瘤细胞,部分区域可见大小不等的腔隙,瘤组织浸润性生长(HE染色,图4×100,图5×400)。
根据症状体征、影像学特征、组织活检、胸腔镜检及免疫组化证据确诊为黏液性脂肪肉瘤。由于患者高龄、一般状况较差,应家属要求予以院外观察治疗。
讨 论
MLPS发病高峰年龄为30~50岁,好发于下肢深部的软组织内,特别是大腿内侧和腘窝,非常罕见于后腹膜,肺部黏液性脂肪肉瘤极其罕见,占所有脂肪肉瘤的30%~35%,占成人肉瘤的5%~10%,是儿童和青少年最常见的肿瘤,本病例为纵隔及腹膜后黏液性脂肪肉瘤转移至肺部。肿物多呈灰黄色,表面光滑, 大部分有包膜,质软,切面分叶状富有黏液,肿瘤中有分布较均匀的枝芽状毛细血管,或鸡爪样薄壁丛状毛细血管网,具有诊断意义[2-3],此特征在本病例中表现较明显。
在细胞层面,瘤细胞弥漫片状排列, 分布于黏液样基质中,瘤细胞呈圆形、 卵圆形, 星芒状, 胞浆丰富, 淡染, 核圆形、卵圆形、梭形, 大而深染, 分裂像可见, 细胞核小,多为卵圆形, 核仁不明显, 有大小不等的黏液囊腔[4]。影像学检查,由于黏液性脂肪肉瘤含较多的水分,脂肪含量通常低于肿瘤体积的10%~25%,CT和MRI可能无法显示出脂肪肉瘤的典型特征,常表现为低密度的不明确肿块,易诊断为良性肿瘤,与普通液性囊肿不易区分[5]。另外有研究表明在基因层面几乎所有黏液样/圆形细胞脂肪肉瘤的特征是染色体12和16(12;16)(q13;p11)之间的相互易位,这种易位导致DDIT3/FUS杂交蛋白的产生,该蛋白能够导致其他靶基因的失调,干扰各种细胞的终末分化,下调程序性细胞死亡。它似乎在黏液样脂肪肉瘤的肿瘤发生中起直接作用。然而,DDIT3/FUS融合类型与分级或疾病特异性生存无相关性。最近有研究发现人白细胞抗原I在黏液样脂肪肉瘤患者中显著下调[6-7]。瘤细胞主要表达S100,本例病人S-100部分阳性,为确诊提供部分依据。另有研究[8]报道,由CTAGB1基因编码的NY-ESO-1在MLPS中阳性率约95%,而在其他一些软组织黏液性肉瘤中不表达,可作为MLPS与其他黏液性肿瘤的特异性鉴别诊断标志物。联合应用NY-ESO-1与S-100进行免疫组化染色,可以提高MLPS诊断准确率。鉴于NY-ESO-1的强免疫原性,可以将其作为MLPS的治疗靶点进行研究[9]。另外运用RT-PCR方法检测石蜡包埋组织中TLS/FUS-CHOP融合基因mRNA的表达,有助于黏液样脂肪肉瘤的诊断和鉴别诊断[10]。
MLPS是一种恶性程度比较低的肉瘤,五年生存率也可以达到80%以上,一般很少出现转移但容易复发,纯的低级别的肿瘤侵袭性相对较弱,可局部复发,转移率约为5%~10%。手术切除肿瘤是MLPS的主要治疗方法,必要时还需切除被肿瘤侵犯的器官,因为肿瘤完整的切除是良好的预后和无病生存的基础。肿瘤生长部位相对比较浅,而且与周围组织联系不紧密、周围没有重要脏器组织治疗效果比较好,通过手术可以将肿瘤完整切除,将肿瘤边缘完整切除以后一般不易复发。肺部黏液性脂肪肉瘤其肿瘤周围有重要脏器组织,很难完全切除,所以患肺部黏液性脂肪肉瘤的患者容易出现复发,少数患者容易出现侵袭性生长或者肿瘤出现转移,引起患者死亡。
已知有几个因素与肿瘤复发或患者生存相关,如年龄超过50岁、肿瘤切除不完全、手术导致种植和转移灶的存在、肿瘤分化较差和淋巴结浸润以及肿瘤体积、核分裂指数高等[11]。因此,有必要通过手术前的成像检查尽可能地确定肿瘤的大小及与周围器官、血管之间的位置关系,以便在手术过程中尽可能切除所有肿瘤和转移灶,以减少或延缓术后的复发。另有研究表明MLPS患者行根治术前的炎症标志物也能预测患者预后,术前淋巴细胞/单核细胞比率与术后患者的预后呈负相关[12]。
总之,对于黏液性脂肪肉瘤肿瘤应早期识别,早期诊断,早期治疗,防止误诊、漏诊,影像学检查有一定指导意义,但最终确诊需结合病理学检查和免疫学检查,术后应定期随访以防复发和转移。
