生物炭对杧果根系生长、土壤养分和微生物群落的影响*
2022-07-28范声浓王烁衡于良君林一凡
范声浓,王烁衡,于良君,林一凡,王 瑞,吴 昊,林 电
(1.海南大学 热带作物学院,海南 海口 570228;2.云南农业大学 学报编辑部,云南 昆明 650201)
海南省是中国唯一全部位于热带地区的省份,拥有得天独厚的热区资源,是 “热带水果之王”杧果最适宜的产区之一。据统计,截至2020年,海南省杧果种植面积达5.8万hm2,产量达76万t,主要分布在三亚市、东方市、乐东县、陵水县和昌江县[1]。海南省杧果种植土壤类型多为砖红壤和燥红土,土层较厚,其中燥红土质地多为轻壤土[2],保水保肥能力差,有机质含量低,养分含量变异大[3-4]。果实养分和果实品质受土壤养分的制约[3,5],目前杧果园主要施肥方式为沟施和水肥一体化施肥,肥料的大量投入造成了潜在的环境风险[6],提高土壤养分有效性和杧果根系对养分吸收的生物学潜力已成为研究重点。
生物炭是生物质在厌氧条件下热解制得的颗粒状有机物质,具有高pH、高碳含量、疏松多孔、官能团丰富且吸附能力强等特点[7-8]。关于生物炭提高土壤肥力效应及微生物群落对生物炭响应机制的研究备受关注。大量研究表明:添加生物炭可以提高土壤中速效养分、有机质含量和酸性土壤pH[9-12]。田孝志等[13]在紧实土壤中添加稻壳炭可增加苹果幼树根系密度和生物量,改善根系构型。前人关于生物炭对土壤微生物群落的变化研究结果存在差异。何秀峰等[9]研究表明:施用5%的生物炭可以提高葡萄幼苗根际细菌丰度,对细菌多样性影响较小;高文慧等[14]研究认为:添加秸秆生物炭对大豆根际细菌多样性和丰度无影响,可提高真菌的丰度和多样性;YAO等[11]对黑土连续施用3年生物炭改良发现:土壤细菌多样性和丰度增加,细菌群落结构改变,尤其可影响慢生根瘤菌属(Bradyrhizobium)、芽孢杆菌属(Bacillus)和土微菌属(Pedomicrobium)等。
生物炭具有优良的物理化学特性,前人研究多集中于生物炭对土壤理化性质和土壤微生物的作用,缺乏土壤理化性质、土壤微生物和根系生长三者间相互作用关系的研究。本研究结合海南省杧果实际生产情况,通过原位研究施肥沟添加生物炭对根层土壤养分、杧果树根系生长和微生物群落变化的影响及其关系,探寻生物炭对水肥一体化施肥和沟施的影响异同,以期为生物炭在杧果园的施用提供科学参考。
1 材料与方法
1.1 试验地概况
于2019年6月—2021年5月在海南省乐东黎族自治区海南省热带作物标准化示范园(乐东佛罗杧果标准化生产基地)开展田间试验,果园位于N18°24′、E108°39′,气候类型为热带季风气候,雨旱季分明,雨季集中在4—8月,年平均气温24.5 ℃,年降水量约1 500 mm,年日照时间约2 000 h。供试植株为20年树龄的台农一号杧果树,果园土壤为海相沉积燥红土,土壤pH为5.59,有机质含量15.59 g/kg,全氮含量0.78 g/kg,碱解氮含量26.39 mg/kg,全磷含量1.02 g/kg,有效磷含量68.00 mg/kg,全钾含量19.12 g/kg,速效钾含量66.85 mg/kg。供试生物炭为椰壳生物炭,由椰壳于500 ℃条件下厌氧炭化3 h制得,pH为10.06,有机碳含量64.44%,全氮含量 0.10%,全磷含量 0.28%,全钾含量 1.09%。
1.2 试验设计
试验共设置3个处理:未添加生物炭的常规化肥沟施为对照组(CK)、常规施肥配施生物炭(BC)和水肥一体化滴灌施肥配施生物炭(FBC),每个处理设置3个重复,每个重复6株果树,试验小区采取随机区组排列。田间施肥量为N 108 kg/hm2,P2O530 kg/hm2,K2O 130 kg/hm2,于每年6月(攻梢期)、10月(催花期)和次年3月(壮果期) 3个时期按照3∶4∶3比例施入。参考肖茜等[15]的研究,本试验BC和FBC处理的生物炭按照施肥沟土壤质量的3% (4.5 t/hm2)于攻梢期与化肥一同施入施肥沟,与土壤混匀掩埋。试验田其他田间管理措施保持一致。施肥沟为杧果树滴水线处规格为长100 cm、宽30 cm、深20 cm的2条对称沟。
1.3 土壤样品的采集与测定
分别于2020年12月5日(催花肥后1个月)和2021年4月12日(壮果肥后1个月)采用土钻采集施肥沟土壤,沟内采用5点取样法,1个重复取5个样品,去除杂物后作为1个根层土壤混合样品,带回实验室经自然风干、磨细和过筛后进行土壤养分测定。土壤pH采用pH计测定;有机质含量采用重铬酸钾容量法测定;碱解氮含量采用碱解扩散法测定;有效磷含量采用NH4F-HCl浸提—钼锑抗比色法测定;速效钾含量采用乙酸铵溶液浸提—火焰光度法测定。
将采集的土壤用干冰保存送往北京奥维森基因科技有限公司进行样本DNA提取、PCR扩增和Illumina Miseq测序。使用德国QIAGEN公司的DNeasy PowerSoil Kit试剂盒提取样品基因组DNA后进行1%琼脂糖凝胶电泳检测。采用含有Barcode的特异引物对细菌16S rRNA V3~V4区(引物为5′-ACTCCTACGGGAGGCAGCAG-3′和5′-GGACTACHVGGGTWTCTAAT-3′)以及真菌ITS1区(引物为5′-CTTGGTCATTTAGAGGAAGTAA-3′和5′-GCTGCGTTCTTCATCGATGC-3′)进行扩增,PCR 产物使用1%琼脂糖凝胶电泳检测扩增目的条带大小,并用Agencourt AMPure XP核酸纯化试剂盒纯化,扩增完成后构建文库,检测合格后使用Illumina MiSeq平台上机测序。
1.4 根系样品的采集与测定
分别于2020年12月5日(花期)和2021年4月12日(果期)采用根钻法钻取施肥沟内土壤和根系,根钻直径为10 cm,深20 cm,底部为锯齿状,可以切割土壤和根系;每个施肥沟钻取3次,去除多余土壤后将根系带回实验室洗净,使用EPSON EXPRESSION 10000XL 根系扫描仪扫描根系,输出的根系图片使用WinRHIZO软件分析得到根长和根平均直径等数据。扫描后的根系样品于75 ℃烘箱烘干后称量,获得根系干质量。根质量密度为单位体积内的根系干质量,根长密度为单位体积内的总根长。
根系的分形维数可以直观地反映根系的发育程度和分支复杂程度,根系分支越复杂,发育程度越高,其分形维数越高。根系的分形维数采用广泛应用的盒维数(巧可夫斯基维数)表示,其计算方法为:将根系投影或平展在边长为L的正方形平面上,再将平面分成(L/r)2个边长为r的小正方形,计算根系所截的小正方形数量(Nr)。逐渐减小小正方形的边长r,Nr将不断增大,正方形所截的根系会随之更加精细,反映根系分支情况越来越多。以logr和logNr分别作为横、纵坐标,得到回归方程:logNr=-Dlogr+logK。方程中,K为定值,回归直线的负斜率D即为盒维数[16]。
1.5 数据分析
将土壤微生物测序下机数据使用Trimmomatic和Pear软件进行质控,使用 FLASH 软件拼接,使用Vsearch 软件去除嵌合体和短序列从而获取有效序列,在97%的相似水平下用uparse[17]法聚类生成OTUs,利用RDP Classifier分别比对Silva[18]和Unite[19]数据库,并对细菌和真菌进行物种注释,置信度阈值设为0.7。使用SPSS 20.0进行单因素方差分析,用Duncan’s法进行显著性检验,使用OriginPro 9.8进行数据可视化作图,运用LEfSe分析比较具有显著组间差异的菌群及其进化关系,将各组中LDA值大于3.8且P<0.5的差异物种用LDA柱状图展示;使用Canoco 5对土壤环境因子、根和微生物群落进行冗余分析。借助MATLAB 9.5将根系RGB图像转化为二值矩阵[20],使用FracLab工具箱计算根系盒维数。
2 结果与分析
2.1 生物炭对根层土壤pH及速效养分的影响
由图1可知:与常规施肥(CK)相比,添加生物炭(BC)在花期和果期均可显著提高土壤pH(P<0.05),水肥一体化配施添加生物炭(FBC)对土壤pH的提高没有达到显著水平(P>0.05);BC和FBC处理的土壤有机质含量在花期和果期较CK均有显著提高;花期BC和FBC处理的土壤速效钾含量显著高于CK (P<0.05),但土壤碱解氮和有效磷含量与CK无显著差异(P>0.05);果期BC处理的碱解氮和有效磷含量均显著高于CK (P<0.05),BC和FBC处理的土壤速效钾含量较CK分别提高23.74%和28.21%,但差异未达到显著水平(P>0.05)。说明添加生物炭可提高土壤pH、有机质和速效钾含量,在果期还可提高土壤碱解氮和有效磷含量。
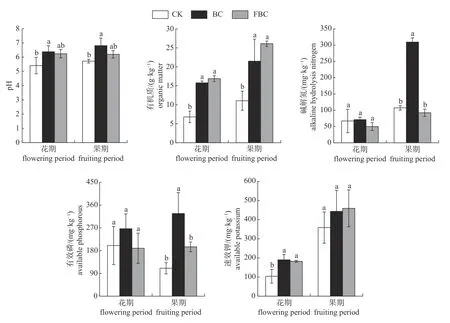
图1 花期和果期土壤pH和养分含量Fig.1 Soil pH and nutrient content in flowering and fruiting period
2.2 生物炭对杧果根系生长的影响
由图2可知:花期3个处理间的根质量密度和根长密度均无显著差异(P>0.05);果期BC处理的根质量密度和根长密度显著大于CK (P<0.05),FBC处理的根长密度显著大于CK (P<0.05)。花期FBC处理的根平均直径显著高于BC处理(P<0.05),而与CK处理无显著差异(P>0.05),果期3个处理的根平均直径无显著差异(P>0.05)。花期3个处理根系盒维数无显著差异(P>0.05),果期BC和FBC处理的根盒维数分别比CK提高8.44%和7.14%,且BC显著高于CK (P<0.05)。可见,添加生物炭可通过增加杧果树根长、根质量和细根数量提高根系的分形维数,促进杧果树根系生长。
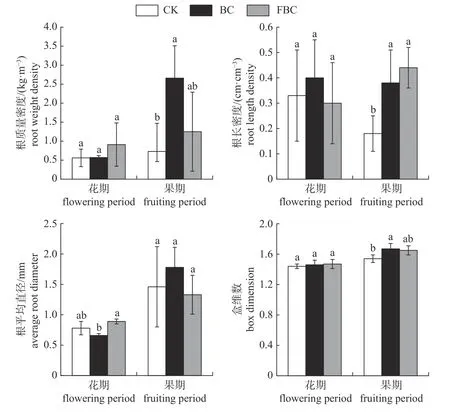
图2 花期和果期根系参数Fig.2 Root parameters in flowering and fruiting period
2.3 生物炭对根层土壤微生物群落多样性的影响
2.3.1 土壤微生物群落Alpha多样性
由图3可知:土壤细菌检测到的OTU总数为4 480,3个处理共有的OTU数为1 514,BC处理特有的OTU数为831,CK和FBC处理分别只有360和448个特有OTU;土壤真菌检测到的OTU总数为2 385,3个处理共有的OTU数为313,CK、BC和FBC特有的OTU分别为514、475和493。说明添加生物炭可以增加土壤细菌物种数,但对真菌物种数没有明显影响,而水肥一体化加生物炭对土壤细菌和真菌数量没有明显影响。
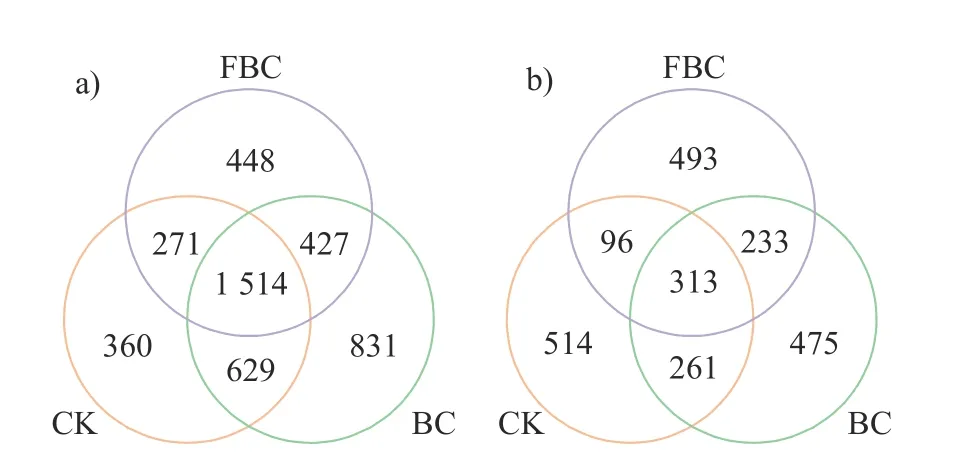
图3 细菌(a)和真菌(b) OTU韦恩图Fig.3 OTU Venn diagrams of bacteria (a) and fungi (b)
由表1可知:每个处理细菌和真菌的样本文库覆盖率都超过0.97,说明测序结果可以代表样本中微生物的真实情况。BC处理细菌的Chao 1指数、观测物种数和Shannon指数均显著大于CK(P<0.05),FBC处理则均显著小于CK (P<0.05),3个处理的谱系多样性指数无显著差异;3个处理真菌的Chao 1指数、观测物种数和谱系多样性指数均无显著差异 (P>0.05),BC处理的真菌Shannon指数显著低于CK (P<0.05)。说明添加生物炭可提高细菌群落的丰富度和多样性、降低土壤真菌的多样性,而水肥一体化施肥可降低细菌群落丰富度和多样性。
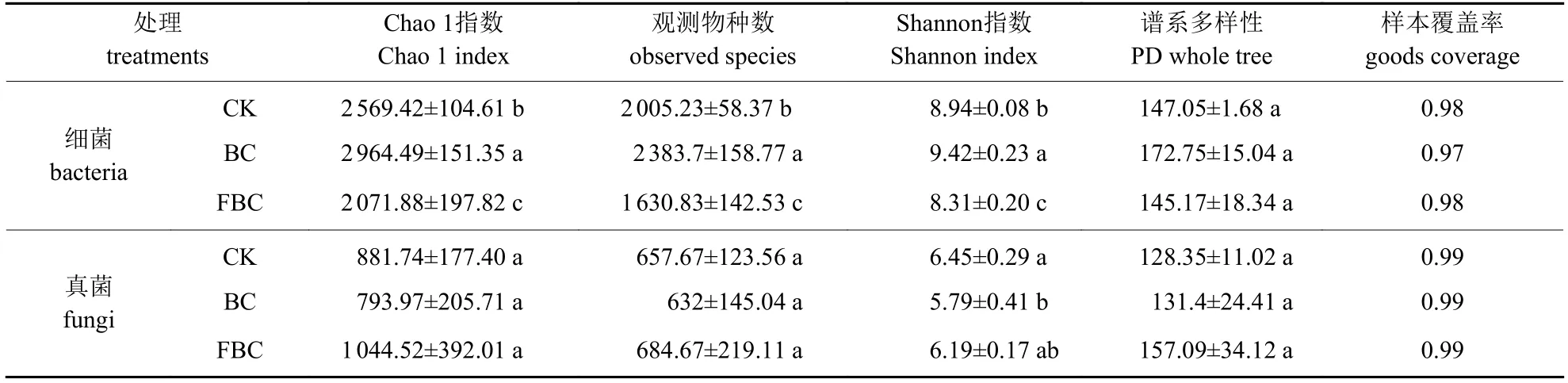
表1 土壤细菌和真菌Alpha多样性指数Tab.1 Alpha diversity index of soil bacteria and fungi
2.3.2 土壤微生物群落Beta多样性
unifrac距离是将物种间进化关系考虑在内的群落差异距离指数,unifrac距离为0表示两群落间进化分类完全一致,数值越大,进化距离越远,群落差异越大。由图4可知:处理组内细菌和真菌距离小于组间距离,说明3个处理的细菌和真菌群落均向不同方向进化,且FBC1样本与BC和CK处理的样本之间unifrac距离大,群落相似度小。总体来看,BC、CK和FBC的细菌和真菌群落间均表现出差异。
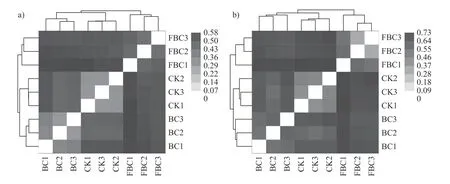
图4 细菌(a)和真菌(b)基于未加权unifrac距离矩阵热图Fig.4 Based on the unweighted unifrac distance matrix heatmap of bacteria (a) and fungi (b)
2.4 生物炭对根层土壤微生物门水平群落结构的影响
由图5可知:细菌门水平上,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)和浮霉菌门(Planctomycetes)为每个处理相对丰度大于1%的菌门;施入生物炭之后,BC和FBC处理的变形菌门、厚壁菌门、拟杆菌门和芽单胞菌门丰度较CK上升,绿弯菌门丰度降低,BC处理的酸杆菌门丰度低于CK和FBC处理,FBC处理的浮霉菌门丰度高于BC和CK。在真菌门水平上,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和未分类的菌门在每个处理中累计丰度均达到97%以上,为土壤样品真菌的优势菌门;添加生物炭后,BC和FBC处理的子囊菌门丰度降低,担子菌门丰度升高。说明添加生物炭可影响土壤细菌和真菌在门水平上的组成。
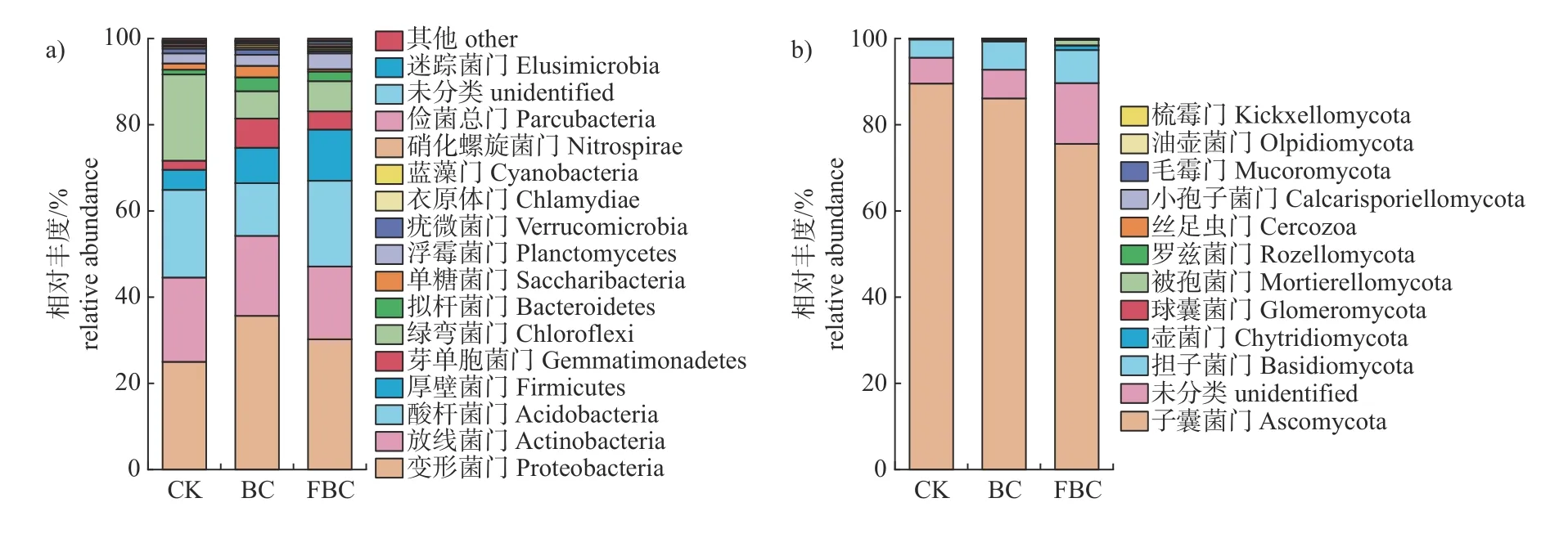
图5 细菌(a)和真菌(b)门水平上群落组成Fig.5 Community composition in phylum level of bacteria (a) and fungi (b)
2.5 细菌和真菌的物种差异分析
由图6a可知:细菌群落共有 37个分类单元有显著差异,其中CK、BC和FBC各有9、14和14个;CK中具有差异的细菌物种有5个属于绿弯菌门(Chloroflexi),另外4个分别为黄色杆菌科(Xanthobacteraceae)、Subgroup 2纲、DA111科和弗兰克氏菌目(Frankiales);BC处理的差异细菌为链孢囊菌目(Streptosporangiales)、链孢囊菌科(Streptosporangiaceae)、芽单胞菌门到属(Gemmatimonadetes~Gemmatimonas)、鞘脂单胞菌目到属(Sphingomonadales~Sphingomonas)、亚硝化单胞菌目(Nitrosomonadales)、亚硝化单胞菌科(Nitrosomonadaceae)、水恒杆菌属(Mizugakiibacter)和TM7门(Saccharibacteria);FBC处理的差异细菌为酸杆菌门到科(Acidobacteria~Acidobacteriaceae Subgroup 1)、细链孢菌目(Catenulisporales)、土壤红杆菌目(Solirubrobacterales)、厚壁菌门(Firmicutes)、芽孢杆菌纲到属(Bacilli~Bacillus)、γ-变形菌纲(Gammaproteobacteria)、黄单胞菌目(Xanthomonadales)、黄单胞菌目下的科(Xanthomonadales Incertae Sedis)和其下Acidibacter属。
由图6b可知:真菌共有14个差异显著的分类单元,其中CK、BC和FBC各有6、1和7个;CK的差异真菌物种为格孢腔菌目(Pleosporales)和其下的Latorua属、座囊菌纲(Dothideomycetes)、Latorua caligans属和光茸菌科(Omphalotaceae);BC处理的差异物种只有小囊菌目(Microascales);FBC处理的差异物种为被孢霉门到目(Mortierellomycota~Mortierellales)、曲霉科(Aspergillaceae)、链格孢属(Alternaria)、青霉属(Penicillium)和隐窝青霉菌(Penicillium cryptum)。

图6 各处理细菌(a)和真菌(b) LEfSe分析差异物种Fig.6 Different species of bacteria (a) and fungi (b) in LEfSe analysis of each treatment
2.6 土壤环境因子、根系构型和微生物群落的关系
由图7可知:CK、BC和FBC的细菌和真菌群落集中在不同区域,细菌和真菌群落组间差异显著(P<0.05),其中土壤有机质、碱解氮和有效磷含量对细菌和真菌的群落组成均有显著影响(P<0.05),pH对真菌群落组成有显著影响(P=0.03)。根长密度、根质量密度和真菌群落具有显著的相关关系(P<0.05)。图中根平均直径和碱解氮含量向量夹角最小,表示土壤碱解氮含量与根平均直径呈正相关,依此类推,根质量密度与土壤pH和有效磷含量呈正相关,根长密度与土壤有机质和速效钾含量呈正相关,根盒维数与土壤pH、有机质、有效磷和速效钾含量均有一定的相关性。
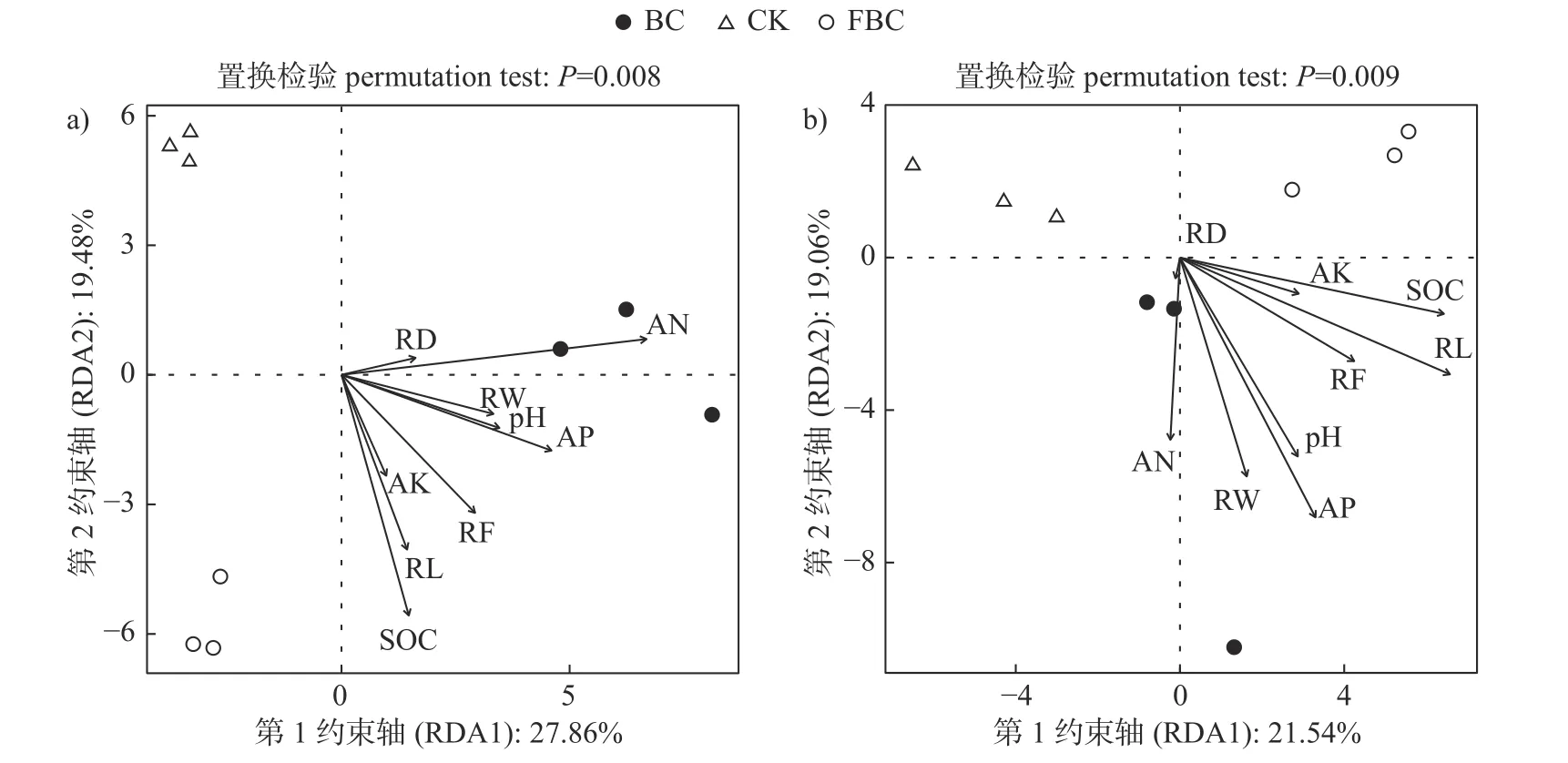
图7 细菌(a)和真菌(b)与土壤养分和根系参数的冗余分析Fig.7 Redundancy analysis of bacteria (a) and fungi (b) with soil nutrients and root parameters
3 讨论
生物炭孔隙结构复杂、比表面积大,具有很强的吸附性能[21-22]和较高的阳离子交换量[23],能吸附土壤中的K+、Ca2+和NH4+等盐基阳离子[24-25],施入土壤后,土壤pH和有机质含量显著提高。水肥一体化配施生物炭对土壤pH的提高未达到显著水平,是由于滴灌施肥在水肥耦合效应下有助于肥料养分在土壤中充分释放,铵态氮肥在土壤中硝化和被植物吸收会释放H+[26-27],所以FBC处理的土壤pH小于BC处理。施入生物炭短期内可显著提高土壤有机质含量是由于其本身碳含量高,而其长期影响机制和对实际生产的意义仍有待进一步深入研究。
氮、磷和钾作为“植物生长三要素”,对植物生长发育有重要作用。本研究表明:添加生物炭可以提高土壤碱解氮、有效磷和速效钾含量,这与LIU等[28]的研究结果一致;而FBC处理的土壤碱解氮和有效磷含量较BC处理有不同程度的降低,其原因可能是水肥一体化施肥时,硝态氮和有效无机磷源(Ca2-P、Ca8-P和A1-P)比较容易向根层下方土壤淋溶[29]。生物炭可以增加土壤阳离子交换量和对钾离子的固持能力,降低钾素淋失量[30],故BC和FBC处理均可增加土壤速效钾含量。
根系生长和土壤养分环境息息相关,生物炭改变了土壤环境,促进根系生长发育,间接影响根系对土壤养分的吸收能力[31]。本研究表明:BC和FBC处理均可增加杧果树果期根质量密度、根长密度和根盒维数。SONG等[32]研究发现:施用生物炭可使玉米根长密度显著提高,细根数量增长2倍,根长和可溶性有机碳、有效磷和土壤容重密切相关,与本研究结果基本一致。根据冗余分析可知:影响杧果树根质量密度的主要因子是土壤pH和有效磷含量,影响根长密度的主要因子是有机质和速效钾含量。添加生物炭可提高土壤pH和有机质含量,从而提高土壤养分的有效性,有机质同时可以促进土壤结构的形成,改善土壤物理性质[33-34],有利于根系的伸长生长。根系盒维数可以用来表示根系发育程度和分支复杂程度,与细根数量也呈正相关[35];本研究也表明根系盒维数与各土壤因子均表现出一定的正相关;刘秀[36]研究表明:细根生产力受土壤养分限制,与土壤氮、磷元素和有机质含量呈显著正相关。研究结果说明添加生物炭有利于杧果树根系伸长和细根生长。
随作物类型、土壤类型、施肥方式和生物炭种类等的不同,生物炭对微生物群落的影响也存在差异[9-12,14]。本研究中,添加生物炭可提高细菌丰富度和多样性,却降低了真菌多样性,这与YAO等[11]在东北黑土上施加生物炭的研究结果一致。变形菌门、放线菌门和酸杆菌门为细菌中的优势门,BC和FBC处理的变形门菌丰度增加,这与YAO等[11]和XU等[37]的研究结果一致。变形菌门趋向于养分丰富的环境,添加生物炭提高了土壤有效氮、磷、钾养分含量,有利于变形菌门富集。绿弯菌门属于能适应土壤恶劣环境的贫营养型微生物[38],本研究发现绿弯菌门为CK处理显著富集的差异物种,BC和FBC处理的土壤有机质和速效氮、磷、钾养分高,绿弯菌门丰度则显著降低,这可能是由于施入生物炭提高了土壤肥力,绿弯菌门在群落竞争中不占优势。厚壁菌门和隶属于厚壁菌门的芽孢菌纲到属均属于FBC处理富集的差异物种,芽孢杆菌能与变形菌纲、放线菌纲和浮酶状菌纲等稳定共存[39],它们在土壤中均具有良好的反硝化作用,容易造成土壤氮素损失,这可能是果期FBC处理的碱解氮含量显著低于BC处理的原因。本研究表明:土壤真菌门水平以子囊菌门占绝对优势,3个处理的相对丰度均在75%以上,施用生物炭后子囊菌门丰度降低,FBC处理下降尤为明显。子囊菌多为腐生菌[40],可以分解动植物残体,也会引起根腐、叶斑和茎腐等病症[41];担子菌门可以分解土壤中难以分解的有机质[42],施入的生物炭自身含有难分解的生物质组织、纤维素和木质素等,提高了土壤难分解有机质含量,使土壤担子菌门增加,这与张燕林等[10]的研究结果一致。
本研究表明:土壤有机质、碱解氮和有效磷为细菌和真菌群落变异共同的环境驱动因子,原因可能是添加生物炭可以改变土壤微生物赖以生存的碳源和氮源。根据LEfSe分析可知:BC处理在属水平上显著富集的差异物种为芽单胞菌属、鞘脂单胞菌属和水恒杆菌属;FBC处理显著富集的差异物种为芽孢杆菌属、链格孢属和青霉属(均属于解磷菌)[43],果期FBC处理的土壤有效磷含量显著低于BC处理,表明水肥一体化施肥引起施肥沟处土壤有效磷向周围土壤扩散,导致施肥沟处土壤解磷菌活跃。芽孢杆菌属是一种根际促生菌,有益于促进植物生长[44]。施入生物炭提高了土壤有机质和碱解氮含量,改变土壤碳氮比和相关酶活性[14],影响微生物代谢活动,从而影响微生物群落构成。本研究中,土壤pH与真菌的群落构成具有显著相关性,土壤酸碱度的变化提高了土壤养分有效性和有机质的矿化速率,促进杧果树和林下生草细根生长代谢,真菌可加快枯枝落叶等腐解转化为土壤有机质和矿质养分,加速形成果园生物小循环。
4 结论
施用椰壳生物炭可以提高土壤pH、有机质和速效钾含量,改善土壤微生物群落结构,从而促进杧果树根系伸长和细根生长。有机质、碱解氮和有效磷含量是土壤细菌和真菌群落结构变化的共同驱动因子,水肥一体化和添加生物炭有利于土壤微生物的优势菌门和具有促生作用的有益菌属富集。
