一株深色有隔内生真菌的Cd吸附特征研究*
2022-07-28杨仁媛梁新然李祖然湛方栋赵之伟
杨仁媛,梁新然,李祖然,湛方栋 ,李 涛,赵之伟
(1.云南农业大学 资源与环境学院,云南 昆明 650201;2.云南农业大学 园林园艺学院,云南 昆明 650201;3.云南大学省部共建云南生物资源保护与利用国家重点实验室,云南 昆明 650091)
随着全球工业化的不断发展,重金属年排放量惊人。据统计,中国土壤总超标率为16.1%,无机污染物中镉(Cd)污染最为严重,其点位超标率高达7%,位居无机污染物之首[1]。Cd在自然界中含量小,分布广泛,主要存在于土壤中,造成Cd污染最主要的因素是人为污染,包括矿山开采、金属冶炼、合金制造、水泥生产以及农药和化肥使用等[2]。目前治理镉污染的方法包括物理法、化学法、生物法和联合修复法,其中,生物吸附法对治理重金属污染和放射性元素非常有效,它是通过生物的细胞壁或代谢产物进行吸附[3-5]。真菌具有分布广泛、种类多样、菌丝体粗大、易大规模培养、生物活性强、抗逆性强、生物量大和对营养条件要求简单等优势,受到了广泛关注[6]。
深色有隔内生真菌(dark septate endophytes,DSE)泛指子囊菌或半知菌,它能在活的植物根内定殖,却不会使植物产生明显病理学特征,能产无性孢子或不产孢,具有典型横隔膜和微菌核结构,广泛分布于各种生境[7-9],即使在严重Cd污染生境中,植物根系仍普遍存在DSE。DSE具有重要的生态功能,能够促进植物生长,增强植物抵抗胁迫的能力,影响植物对重金属的吸收累积[10]。已有研究表明:DSE菌丝能够耐受高剂量重金属胁迫,具有较强的吸附能力,如DSE菌株Phialocephala fortiii和Phaeoacremonium mortoniae对铅(Pb)有较强的富集能力和耐受性[11];DSE菌株枝状枝孢菌(Cladosporium cladosporioides)B142的非活性菌丝能够吸附Pb[12];DSE菌株棘壳孢属(Pyrenochaetasp.) SR35、根盘菌属(Rhizopycnis vagum) SR37和SR44以及Paraphaeosphaeriasp.SR46 的Cd吸附能力不同,最大Cd吸附量可达3.01~7.89 mg/g[13]。DSE对重金属的吸附能力及耐受性因细胞壁结构的不同而存在差异,除此之外,pH值、菌丝用量、吸附温度、吸附时间和初始Cd质量浓度等因素都会影响真菌对Cd的吸附[14],目前,关于DSE菌丝Cd吸附特征尚不清楚。
在吸附过程中,吸附物与被吸附物之间存在相互作用,采用吸附平衡等温线对其进行描述并确定吸附机理,其中Langmuir吸附模式和Freundlich吸附模式应用最为广泛[15]。描述吸附剂吸附溶质速率的是吸附动力学,它被用来验证吸附过程中的试验数据,有助于探讨吸附机理,目前常用的是准一级速率方程和准二级速率方程[16]。本研究以1株DSE-嗜鱼外瓶霉(Exophiala pisciphila)为对象,探讨DSE活体菌丝对Cd的等温吸附、吸附动力学及其影响因素,采用红外光谱分析DSE菌丝Cd吸附的化学基团,研究不同解吸剂对DSE菌丝解吸Cd的影响,探讨DSE对Cd的吸附特征,为利用DSE吸附去除Cd提供参考和科学依据,也为利用真菌吸附去除重金属污染提供材料。
1 材料与方法
1.1 供试菌株
从云南会泽铅锌矿区野生密序野古草根[Arundinella bengalensis(Spreng.) Druce]分离出1株DSE-嗜鱼外瓶霉(E.pisciphilaACCC32496),现保存于中国农业微生物菌种保藏管理中心,编号:ACCC32496。用马铃薯葡萄糖琼脂培养基(PDA)培养菌种,4 ℃保存,每2个月转接菌种。
1.2 Cd处理与培养条件
在250 mL三角瓶中加入MMN液体培养基100 mL,再分别添加0、0.25、0.50、1.00、2.00和4.00 mL 10 mg/mL的Cd2+母 液(CdCl2·2.5H2O),使Cd2+质量浓度分别为0、25、50、100、200和400 mg/L。MMN液体培养基由CaCl2·2H2O 0.05 g/L、麦芽糖3.0 g/L、氯化钠 0.025 g/L、葡萄糖10.0 g/L、磷酸二氢钾 0.5 g/L、VB1 (硫胺素) 0.1 mg/L、MgSO4·7H2O 0.15 g/L、FeCl3(1%)1.2 mL/L和NaNO33.0 g/L配制而成[17]。灭菌处理后,接种1片直径为6 mm的菌株菌块,在28 ℃、120 r/min的恒温培养箱中振荡培养7 d。
1.3 不同因子对菌丝Cd吸附量的影响
1.3.1 Cd吸附量的计算
无Cd培养基培养7 d后,过滤收集菌丝球,无菌水冲洗3次,抽滤去除水分得到菌丝鲜样,称量得菌丝体鲜质量;将菌丝鲜样于 75 ℃烘干至恒质量,称量得菌丝体干质量;计算菌丝鲜样含水率,并通过干湿比换算得到干菌体质量,用于计算Cd吸附量。吸附完成后,取1 mL过滤溶液用于测定Cd质量浓度,并根据公式计算Cd吸附量:

式中:q为Cd吸附量,mg/g;C0为Cd2+初始质量浓度,mg/L;Ce为反应后剩余Cd质量浓度,mg/L;m为干菌体质量,g;V为反应液体积,L。
1.3.2 菌丝Cd吸附量的影响因子
(1) pH值:在100 mg/L Cd2+溶液中加入0.5 g菌丝鲜样,调节溶液pH值为3、4、5、6、7、8,在30 ℃、120 r/min恒温培养箱中振荡吸附2 h,测定滤液中Cd质量浓度,确定菌丝吸附Cd的最佳pH值。
(2) Cd初始质量浓度:在 25、50、100、200、300和400 mg/L Cd2+溶液中分别加入0.5 g菌丝鲜样,调节到最佳pH值,在30 ℃、120 r/min恒温培养箱中振荡吸附2 h,测定滤液Cd质量浓度。
(3) 吸附时间:在50 mL 300 mg/L Cd2+溶液中加入0.5 g菌丝鲜样,调节pH值,在30 ℃、120 r/min恒温培养箱中振荡吸附,分别在5、10、20、30、40和50 min以及1、2、4、6、8、10、12、24、36、48、60和72 h取样。每次取样体积为0.5 mL,测定Cd质量浓度。
1.4 嗜鱼外瓶霉菌丝吸附Cd的等温吸附模型与动力学模型
利用吸附等温模型描述吸附达到平衡时的吸附量(qe)与溶液中吸附质质量浓度(Ce)间的定量关系,可为吸附机理的研究提供依据。采用Langmuir方程和Freunndlich方程2种等温吸附模型对嗜鱼外瓶霉菌丝吸附Cd的过程进行拟合,Langmuir方程和Freunndlich方程表达式见式(1)和式(2):

式中:qe为吸附平衡后Cd在单位质量吸附剂上的平衡吸附容量,mg/g;qm为理论最大吸附量,mg/g;KL为Langmuir吸附常数,L/mg;Ce为吸附平衡时溶液中Cd质量浓度,mg/L;KF为Freunndlich吸附常数,mg1-1/n·L1/n·g-1;n为经验参数,与吸附体系性质有关。吸附过程随时间变化的关系是吸附动力学的研究内容,其对更好地了解吸附剂对吸附质的吸附过程具有重要意义。吸附动力学常用准一级速率方程和准二级速率方程对试验数据进行拟合。准一级速率方程和准二级速率方程表达式分别为式(3)和式(4):

式中:t为吸附时间,min;qe为吸附平衡时的吸附容量,mg/g;qt为吸附时间为t时的吸附容量,mg/g;K1和K2为吸附速率常数。
1.5 菌丝傅立叶红外光谱测定
采用压片法测定菌丝的红外光谱。取75 ℃烘干并粉碎成粉末状的菌丝体2 mg,与烘干的溴化钾200 mg充分研磨,压片,采用FTIR红外光谱仪测绘其光谱,并进行分析,探讨嗜鱼外瓶霉菌丝吸附Cd涉及的基团。
1.6 菌丝Cd解吸试验
按1.3节的方法获得不同质量浓度Cd的菌丝鲜样及鲜样含水量。分别以0.1 mol/L的HNO3、Na2EDTA、CaCl2和NaOH为解吸剂,向50 mL解吸剂中加0.5 g菌丝鲜样,在30 ℃、120 r/min恒温培养箱中振荡吸附2 h,过滤,用火焰原子吸收法测定滤液中Cd质量浓度,计算解吸剂从菌丝体上解吸的Cd含量,计算公式为:
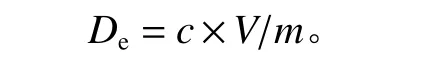
式中:De为菌丝对Cd的解吸量;c为解吸完成时滤液中Cd的质量浓度;V为解吸体系体积;m为称取的菌丝质量。
1.7 数据处理与分析
用Microsoft Excel进行数据整理;用IBM SPSS Statistics 24进行单因素方差分析(ANOVA),用最小显著差数法(LSD)和新复极差法(Duncan’s)进行多重比较;采用Origin 9.5进行绘图。
2 结果与分析
2.1 pH值与初始质量浓度对嗜鱼外瓶霉菌丝Cd吸附量的影响
由图1可知:不同pH值条件下,嗜鱼外瓶霉菌丝对Cd的吸附量不同。随着pH值的增大,Cd吸附量先增加后下降,当pH值为5时,吸附量达到最大值,为9.09 mg/g。由图1还可知:随着Cd初始质量浓度的增加,嗜鱼外瓶霉菌丝对Cd吸附量也增加。Cd初始质量浓度为400 mg/L时,达到吸附饱和状态,吸附量基本稳定,即嗜鱼外瓶霉菌丝对Cd的最大吸附量为14.14 mg/g。

图1 pH值与初始质量浓度对嗜鱼外瓶霉菌丝Cd吸附量的影响Fig.1 Effects of pH value and initial mass concentration on the Cd adsorption amount by Exophiala pisciphila mycelium
2.2 吸附时间对嗜鱼外瓶霉菌丝Cd吸附量的影响
由图2可知:嗜鱼外瓶霉菌丝Cd吸附过程大致分为2个阶段:第1阶段为快速吸附,第2阶段为缓慢吸附,60 min内Cd吸附量为11.37 mg/g,占总吸附量的79.3%,在 24 h基本达到吸附平衡。

图2 吸附时间对嗜鱼外瓶霉菌丝Cd吸附量的影响Fig.2 Effect of adsorption time on the Cd adsorption amount by E.pisciphila mycelium
2.3 嗜鱼外瓶霉菌丝吸附Cd的等温吸附模型与动力学模型
由图3可知:嗜鱼外瓶霉菌丝吸附Cd的Langmuir等温吸附方程拟合的相关系数为0.991 7,该方程得出Cd理论最大吸附量(qm)为16.31 mg/g;Fleundlich等温吸附方程拟合的相关系数为0.959 8,该方程得到的qm为15.24 mg/g。可见,Langmuir吸附等温模型相关系数更高,其qm与Cd吸附试验值更接近。因此,嗜鱼外瓶霉菌丝吸附Cd更符合Langmuir吸附等温模型。

图3 嗜鱼外瓶霉菌丝吸附Cd的Langmuir吸附等温线(a) 和Freundlich吸附等温线(b)Fig.3 Langmuir adsorption isotherm (a) and Freundlich adsorption isotherm (b) of Cd by E.pisciphila mycelium
由图4可知:准一级速率方程的相对系数为0.921 2,较准二级速率方程的相对系数(0.999 0)小,即准一级速率方程获得的理论平衡吸附量与试验结果相差较大。准一级速率和准二级速率方程获得的理论平衡吸附量分别为16.67 和14.25 mg/g,准二级速率方程所得结果与试验结果更接近。因此,嗜鱼外瓶霉菌丝吸附Cd更符合准二级速率方程。

图4 嗜鱼外瓶霉菌丝吸附Cd的准一级速率方程(a)和准二级速率方程(b)Fig.4 Linearized pseudo-first order kinetic plots (a) and linearized pseudo-second order kinetic plots (b) of Cd by E.pisciphila mycelium
2.4 嗜鱼外瓶霉菌丝Cd吸附的基团
由图5可知:嗜鱼外瓶霉菌丝在3 401.82 cm-1处的宽吸收峰为聚合体中的-NH基团的伸缩振动和-OH基团的吸收,2 925.48和2 856.06 cm-1处的强吸收峰为脂肪族-CH2和-CH3基团的伸缩振动,1 743.33和1 641.13 cm-1处的强吸收峰为酸、酯和酮中-C=O基团的对称和非对称伸缩振动,1 153.22、1 078.53和1 035.59 cm-1处的吸收峰为P-O基团的伸缩振动,P=O在1 153.22和1 078.53 cm-1处有非对称和对称伸缩振动,P-O-C基团在1 035.59 cm-1处有对称伸缩振动。可见,嗜鱼外瓶霉菌丝吸附Cd涉及氨基、酰胺基、羧基、羟基和磷酰基等基团。

图5 嗜鱼外瓶霉菌丝的红外光谱Fig.5 FT-infrared spectrum of E.pisciphila mycelium
2.5 解吸剂对嗜鱼外瓶霉菌丝Cd的解吸作用
由表1可知:HNO3和Na2EDTA的解吸能力基本相同,Cd质量浓度为25、50、100、200、300和400 mg/L时,HNO3分别从菌丝上解吸出3.55、6.94、20.94、49.84和72.61 mg/g Cd,分别占菌丝Cd富集量的63.0%、66.4%、70.4%、75.6%和81.6%;Na2EDTA分别解吸出3.81、7.11、21.73、51.24和74.36 mg/g Cd,分别占菌丝Cd富集量的67.7%、68.1%、73.1%、77.7%和83.5%。Cd质量浓度增加时,HNO3和Na2EDTA从嗜鱼外瓶霉菌丝解吸出的Cd含量也显著增加,占菌丝Cd富集量的比例也增加。对于CaCl2和NaOH而言,Cd质量浓度增加时,菌丝解吸出的Cd含量增加,但占菌丝Cd富集量的比例下降。可见,4种解吸剂中HNO3和Na2EDTA的解吸能力最强。
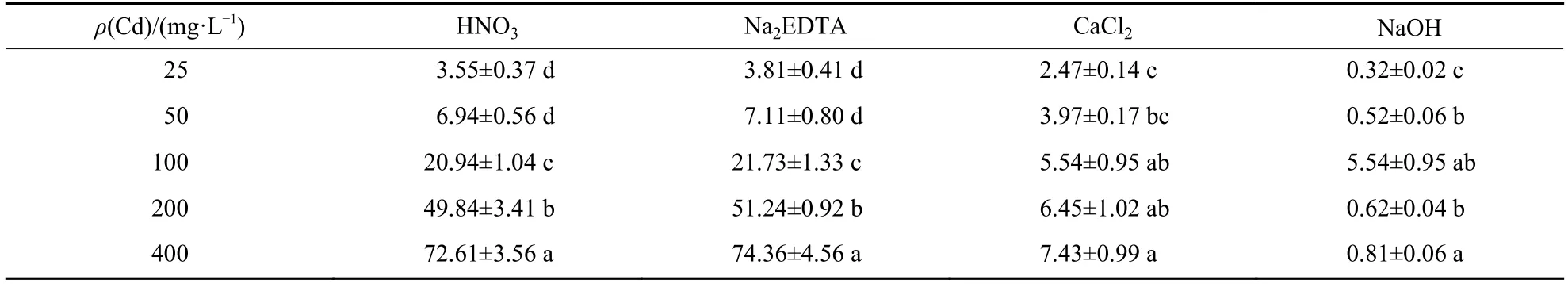
表1 不同解吸剂从嗜鱼外瓶霉菌丝解吸的Cd含量Tab.1 Content of cadmium desorption from Exophiala pisciphila mycelium using various eluants mg/g
3 讨论
3.1 不同因子对真菌吸附Cd影响
在真菌吸附Cd2+的过程中,重金属初始质量浓度、pH值、吸附温度和吸附时间以及真菌自身特性、吸附剂投加量和对菌体的不同预处理方法等因素都会对吸附能力产生影响[18-20]。pH使真菌的吸附位点发生变化,改变细胞膜通透性,对酶促反应速率造成影响,使胞内物质的溶解性和电离性发生改变,转变金属溶液的化学特性,影响细胞壁表面的官能团活性[21]。在不同pH值的溶液中,Cd的状态会发生变化,如酸性条件下易呈离子状态,碱性条件下易形成沉淀。pH值升高导致溶液中H+浓度下降,弱化H+对吸附位的竞争能力,使吸附剂上负电荷的官能团增多,可更好地与Cd2+结合;同时,负电荷的增加使基团与Cd2+的电荷排斥力减弱,促进吸附剂对 Cd2+吸附,继续增加pH值,溶液中Cd2+发生水解反应,形成Cd(OH)2,降低去除率[22]。在本研究中,嗜鱼外瓶霉菌丝对Cd吸附的最佳pH值为5,与目前已报道的产絮酵母菌废菌体、烟曲霉和棘孢曲霉吸附Cd的最佳pH[23-25]一致。
此外,初始Cd2+质量浓度和吸附时间也是决定真菌吸附能力的重要因素。控制时间和初始Cd质量浓度能提高真菌对Cd的吸附率。吸附剂相同时,增加离子初始质量浓度和吸附时间会导致吸附量增加,最终达到饱和吸附量。这是因为吸附剂相同时,结合位点没有达到饱和,初始Cd2+质量浓度越大,吸附的Cd2+越多,吸附容量越高,当位点趋于饱和时,吸附容量将达到稳定状态。研究显示:生物对重金属离子的吸附过程可分为快速过程和慢速过程[26]。吸附前期,吸附剂表面有大量的活性吸附位点,Cd被快速去除,随着吸附位点不断被Cd2+占据,反应速度逐渐减缓,直到吸附平衡[27-28]。层迭灵芝子实体和球孢白僵菌株 JB15吸附Cd2+的过程分为快速吸附和慢速吸附[28-29],与本研究结果一致。
3.2 真菌吸附Cd的等温平衡与动力学
等温吸附模型表示的是恒温条件下物质浓度对吸附到表面上的物质数量产生的影响,其前提是存在一定数量的吸附位点,金属离子被化学吸附在该位点,每一位点能吸附一分子金属离子,位点是能量均衡的,且被吸附离子间不存在相互作用力[30-32]。Langmuir模型和Freundlich模型是描述丝状真菌吸附Cd体系中最常用的平衡吸附模型。Langmuir模型适用于吸附剂表面含有限均一性吸附位点的单分子层吸附过程,符合该模型说明吸附剂表面均匀,吸附质之间没有相互作用,吸附是单层吸附,只发生在吸附剂的外表面[33-35];Freundlich模型则是吸附位点非均一地分布在异质表面,属于多分子层吸附过程,适用于吸附剂表面异质的吸附过程[30,35]。目前已报道的产絮酵母菌废菌体[23]、球孢白僵菌株 JB15[29]、白腐菌[34]、简青霉[35]、粗柄侧耳、双孢蘑菇、Calocybe indica[27]、Microsphaeropsissp.LSE10[36]、微紫青霉菌菌株GXCR[37]等Cd吸附的等温式均符合Langmuir等温吸附模型,与本研究嗜鱼外瓶霉菌丝吸附Cd的吸附等温式一致。
生物吸附是一个动态过程,目前已有许多描述吸附反应速率的动力学方程。吸附动力学可以描述吸附剂对吸附质的吸附速率以及受速率控制的吸附平衡时间[38-39]。目前,常用准一级速率方程和准二级速率方程描述生物吸附过程[40]。本研究表明:嗜鱼外瓶霉菌丝Cd吸附过程符合准二级速率方程,它预测的平衡吸附量与试验结果更接近,还能更好地表达生物吸附过程,这与目前报道的酱油曲霉[19]、产絮酵母菌废菌体[23]、棘孢曲霉[25]、层迭灵芝子实体[28]、简青霉[35]、双孢蘑菇、Calocybe indica[27]和Microsphaeropsissp.LSE10[36]等不同种类真菌菌丝吸附Cd的过程一致。
3.3 真菌吸附Cd机理
生物吸附分为主动吸附和被动吸附。被动吸附是物理性吸附,其过程不消耗能量,细胞壁上的官能团如-SH、-COOH、-NH2、-OH和-PO43-等可与金属离子进行络合、螯合和离子交换等反应,靠官能团与离子之间的物理作用力将重金属吸附[41];主动吸附是化学性吸附,其过程需要消耗能量,通过细胞壁官能团与重金属形成化学键,或者进行细胞内酶促作用,将重金属生物转运、生物沉淀或生物积累[42-43],通过真菌表面吸附的金属离子与特定酶相结合,将其转移至胞内。本研究的嗜鱼外瓶霉菌丝对Cd的吸附作用是细胞表面吸附Cd的物理过程,该过程包括配位络合、离子交换、静电交感、氧化还原和无机微沉淀等[44]。真菌细胞壁上的活性基团如巯基、羧基和羟基等与重金属离子发生络合反应而达到吸收重金属的目的,不同真菌的细胞壁不同,吸附重金属的能力也不同。研究表明:Penicilliumsp.PC1吸附去除Pb2+与 Cd2+的过程涉及O-H、C=O、C-N、N-H和C-H 等官能团[45];在吸附过程中,酱油曲霉依靠菌体表面的酰胺基、羧基、羟基、磷酸基和氨基进行吸附[19];在利用农林废弃物—耐性真菌复合吸附剂吸附Pb的过程中,起主要作用的是羟基、羧基、氨基和羰基等官能团[46];羧基、酰胺、羟基和吡啶等官能团主要参与功能化的黄孢原毛平革菌对重金属的吸附[47];Microsphaeropsissp.LSE10通过羧基、氨基、磺酸基和羟基等基团对Cd进行吸附[36];产菌核真菌Aspergillus oryzaeG15表面的羧基和氨基等基团在吸附Pb和Cu的过程中发挥了主要作用[48]。本研究表明:嗜鱼外瓶霉菌丝吸附Cd的化学基团涉及氨基、酰胺基、羧基、羟基和磷酰基等。
4 结论
深色有隔内生真菌嗜鱼外瓶霉吸附Cd的最佳pH值为5,随着Cd初始质量浓度的增加,其对Cd吸附量也增加,直至吸附饱和。吸附过程分为快速吸附和慢速吸附,吸附24 h基本达到吸附平衡,吸附过程符合Langmuir吸附等温模型,吸附动力学符合准二级速率方程。嗜鱼外瓶霉吸附Cd涉及氨基、酰胺基、羧基、羟基和磷酰基等基团。0.1 mol/L HNO3、Na2EDTA、CaCl2和NaOH均能从嗜鱼外瓶霉菌丝上解吸出一定量的Cd,其中,HNO3和Na2EDTA的解吸能力最强。
