抗肿瘤药物所致肝损伤的临床病理诊断
2022-07-28魏丽红黑梦莹薛天晨钟雅婷廖冰
魏丽红 黑梦莹 薛天晨 钟雅婷 廖冰
药物性肝损伤(DILI)是指由各类处方或非处方的化学药物、生物制剂、传统中药、保健品、膳食补充剂及其代谢产物等引起的肝损伤[1]。据报道,抗肿瘤药物引起的DILI约占15%[2]。抗肿瘤药物种类较多,所导致的DILI是最常见且最严重的药物不良反应之一,是肿瘤治疗中不可忽视的问题。在临床诊断过程中,必要时应进行肝脏组织病理检查,通过细胞损伤类型和病理形态模式的分析为DILI提供诊断线索和依据。
一、DILI的临床分型
根据发病机制,DILI可分为固有型和特异质型。其中固有型相对少见,具有可预测性,与药物剂量密切相关;特异质型DILI临床上较为复杂,个体差异显著,临床表现多样[3],又可分为免疫特异质性DILI和遗传特异质性DILI。
根据病程的长短,DILI可分为急性DILI和慢性DILI。我国慢性DILI定义为DILI发生6个月后,血清ALT、AST、碱性磷酸酶(ALP)及总胆红素仍持续异常,或存在门静脉高压、慢性肝损伤的影像学和组织学证据[4]。临床上,急性DILI占绝大多数[5]。
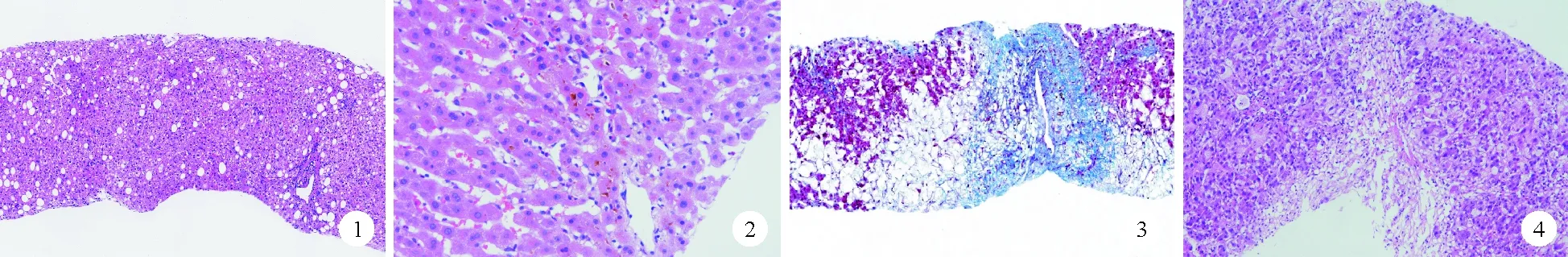
根据受损靶细胞的类型,DILI可分为肝细胞损伤型、胆汁淤积型、混合型和肝血管损伤型。(1)肝细胞损伤型:ALT≥3倍正常值上限(ULN),且R≥5[R=(ALT实测值/ALT ULN)/(ALP实测值/ALP ULN)];(2)胆汁淤积型:ALP≥2 ULN,且R≤2;(3)混合型:ALT≥3 ULN,ALP≥2 ULN,且2 多数固有型DILI为肝细胞损伤型,特异质型DILI可为胆汁淤积型或肝细胞损伤型,也有部分DILI为混合型。DILI包括抗肿瘤药物所致者可表现为以下病理形态模式[7]。 1.炎症坏死 (1)带状坏死:多见于固有型DILI。肝腺泡3带坏死最常见,坏死灶内淋巴细胞通常不明显,可进展为桥接坏死、大块坏死。(2)急性肝炎:为常见类型。其特征为以肝实质炎症为主(又称急性小叶性肝炎),淋巴细胞浸润伴散在肝细胞凋亡。嗜酸性粒细胞数量的增多提示DILI可能。可表现为肝细胞水肿、脂肪变性、肝细胞再生、点状坏死、小叶结构紊乱、伴或不伴融合性或桥接坏死。汇管区炎症、界面性炎和胆管损伤均可出现,但非主要改变;还可表现为单核细胞增多症样肝炎(即肝窦淋巴细胞串珠样排列)和肉芽肿性肝炎(即肉芽肿位于汇管区或小叶内,通常无肝实质坏死)。(3)慢性肝炎:主要以分布于汇管区及其周围(界面性炎)的坏死性炎症为特征,汇管区混合炎症细胞浸润,以CD8+淋巴细胞为主;小叶炎症表现为点状坏死,伴散在肝细胞凋亡,伴或不伴纤维化,可有胆管损伤。病理形态需与慢性病毒性肝炎、自身免疫性肝炎(AIH)等相鉴别。DILI与AIH均可出现富含浆细胞的汇管区炎症和界面性炎、桥接坏死。虽然DILI更常见肝细胞淤胆或毛细胆管淤胆,特发性AIH更常见肝细胞形成玫瑰花环和淋巴细胞穿入现象,但两者并不绝对,临床通过激素治疗的随访观察有助于二者的鉴别诊断。 2.胆汁淤积 (1)急性肝内胆汁淤积:表现为胆汁在肝细胞中积聚(肝细胞淤胆)和在毛细胆管中积聚(毛细胆管淤胆)。不伴汇管区或小叶炎症的急性肝内胆汁淤积为“单纯性”淤胆,通常以肝腺泡3带最为突出,应与其他可能导致3带淤胆的疾病相鉴别。(2)淤胆性肝炎:急性肝内胆汁淤积与急性或慢性肝细胞损伤的坏死性炎症模式混合存在,提示肝细胞/胆汁淤积损伤,称淤胆性肝炎,是DILI的常见表现。部分患者临床表现为高水平的血清转氨酶和黄疸,急性肝炎型炎症严重,伴轻度胆汁淤积,此时组织学需与急性病毒性肝炎和AIH相鉴别。部分患者转氨酶和ALP水平轻度升高、黄疸,轻中度炎症,胆汁淤积明显。(3)慢性胆汁淤积:上述两种类型胆汁淤积可能发展为慢性胆汁淤积。主要特点是肝内胆管的慢性损伤,可导致胆管数量减少,表现为汇管区周围肝细胞胆盐淤积、铜沉积、细胆管反应及汇管区慢性炎症、纤维化、胆管损伤,类似原发性胆汁性胆管炎(PBC)或原发性硬化性胆管炎(PSC)样改变。(4)胆管消失综合征:表现为肝活检组织中超过半数的汇管区固有胆管缺失,可见于上述各型胆汁淤积的肝损伤。 3.肝细胞脂肪变性 可表现为微泡性脂肪变性、大泡性脂肪变性、脂肪性肝炎,后者可见气球样肝细胞、Mallory小体、不同程度的炎症改变和窦周纤维化。组织学需与代谢相关脂肪性肝病肝病(MAFLD)/非酒精性脂肪性肝病(NAFLD)等相鉴别。 4.肝血管损伤 有些化疗药物可引发肝静脉阻塞性疾病,如大剂量药物联合化疗或肝动脉灌注化疗。(1)肝窦阻塞综合征(SOS)/静脉闭塞病(VOD):表现为肝窦内皮细胞损伤,中央静脉管壁增厚、管腔狭窄或闭塞,血栓形成,常伴小叶中央充血。(2)布加综合征:主要为较大的肝静脉受累。(3)肝紫癜(紫癜性肝病):肝窦扩张充血。(4)非硬化性门脉高压:门静脉分支减少、分支疝入肝实质,汇管区纤维化,伴或不伴肝细胞结节性再生性增生(NRH)。 5.肿瘤 有些药物可促进肿瘤的发生,如肝细胞腺瘤、肝细胞癌、胆管癌、血管肉瘤,但临床相对少见。 部分抗肿瘤药物所致肝损伤的病理特征概况见表1[7]。 表1 抗肿瘤药物所致肝损伤的病理特征概况 1.细胞毒类抗肿瘤药物所致肝损伤病理 (1)甲氨蝶呤:甲氨蝶呤的肝毒性可能与其间接干扰同型半胱氨酸生成甲硫氨酸有关,过量同型半胱氨酸可能造成氧化应激或增加细胞对其细胞毒性作用的敏感性[8]。肝损伤病理形态可表现为肝细胞脂肪变性(图1)、气球样变性、肝细胞凋亡/坏死,汇管区出现淋巴细胞、单核细胞和中性粒细胞浸润以及肝纤维化。 图1 肝细胞脂肪变性的肝脏组织苏木素-伊红(HE)染色结果(×40) 图2 胆汁淤积的肝脏组织HE染色结果(×200) 图3 SOS的肝脏组织Masson染色结果(×40) 图4 肝细胞融合坏死的肝脏组织HE染色结果(×100) (2)巯嘌呤类药物:巯嘌呤类药物引发肝毒性主要是通过肝脏巯嘌呤S-甲基转移酶引导的首关消除机制,转化为6-甲硫基嘌呤核苷导致。巯嘌呤类药物引起的肝损伤组织学病变特征较广泛,包括急性肝炎型、胆汁淤积型、混合型、肝紫癜、SOS及胆管消失综合征等[9]。其中6-巯基嘌呤引起的肝损伤通常表现为黄疸伴或不伴瘙痒,显微镜下主要表现为胆汁淤积[10],见图2,也可为肝细胞坏死型。另外可见不同形态的肝血管损伤。 (3)烷化剂:①环磷酰胺:标准剂量的环磷酰胺很少引起肝功能异常,大剂量或与白消安等药物联用时可导致SOS。由于肝细胞通过代谢环磷酰胺产生具有直接毒性的丙烯醛,后者对肝窦内皮细胞有毒性,进而造成肝损伤[11]。有报道显示,环磷酰胺治疗乳腺癌引起肝细胞大片坏死[12]。②白消安:大剂量单独使用白消安导致的肝损伤多为胆汁淤积型[13]。白消安作为弱烷化剂,其产生毒性的机制可能与谷胱甘肽S-转移酶介导的氧化应激有关[14]。 (4)放线菌素D:大剂量使用放线菌素D可引起严重的肝损伤,包括SOS(图3)。放线菌素D引起的肝损伤可能与NLRP7和KHDC3L的基因突变有关,该突变会影响药物在肝脏中的代谢[15]。 2.非细胞毒类抗肿瘤药物所致肝损伤病理 (1)调节体内激素平衡的药物:目前已有一些报道发现他莫昔芬导致的肝损伤,包括脂肪性肝炎、肝紫癜病、急性肝炎和肝细胞癌[16]。 (2)分子靶向药物:①吉妥珠单抗:可引发SOS,目前机制尚未完全明确,可能与肝窦内皮细胞表达CD33有关[17]。②曲妥珠单抗:可导致急性肝炎的病理改变,还可能引起NRH。 (3)肿瘤免疫治疗药物:免疫检查点抑制剂引起的DILI(即免疫相关性肝炎)绝大部分为肝细胞损伤型,少部分为胆汁淤积型[18]。程序性死亡受体1(PD-1)抑制剂导致的肝损伤主要表现为炎症坏死,肝细胞点状或融合性坏死[19-20](图4)及轻中度界面性炎,可出现汇管区纤维化,少数可出现组织细胞构成的肉芽肿,或中央静脉内皮炎,也可出现胆管损伤[21]、肝细胞脂肪变性或脂肪性肝炎。小叶内浸润的淋巴细胞以CD8+淋巴细胞为主,而汇管区CD4+和CD8+淋巴细胞数量相近[20,22]。 细胞毒性T淋巴细胞相关抗原4(CTLA-4)抑制剂导致的免疫相关性肝炎显示出与严重小叶坏死和炎症活动相关的肉芽肿性肝炎的模式特征[20]:肉芽肿界限不清,由上皮样细胞组成,无多核巨细胞,可形成纤维素性环状肉芽肿,中央见脂质空泡;肝细胞点灶状或融合性坏死主要见于小叶中央区域;中央静脉静脉内皮炎常见。肝组织浸润淋巴细胞以CD8+淋巴细胞为主。 综上所述,DILI中抗肿瘤药物所致肝损伤的病理形态多样,因此增加了诊断的难度。另一方面,尚需与其他原因所致的肝损伤相鉴别,因以上各种形态学改变均可由非药物因素导致,如病毒性肝炎、自身免疫性肝病、遗传或代谢相关肝病等。所以,在临床诊断过程中,密切结合临床病史尤其用药史,同时排查其他引发肝损伤的因素尤为重要,此时Roussel Uclaf因果关系评估法(RUCAM)是常用评估工具。RUCAM量表通过用药与发病的时间前后关系、停药后或继续用药时ALT或ALP的变化情况、有无饮酒或妊娠或年龄相关DILI的危险因素、有无伴随用药情况、除外其他肝损伤原因、药物既往肝损伤信息、再用药反应几个方面进行评分,根据总分评估为极可能、很可能、可能、不太可能、可排除。诊断时还需注意多因素导致肝损伤的可能性,如多种药物导致的DILI,或DILI叠加其他非DILI。此外,虽然DILI几乎涵盖非DILI的病理形态,但具体药物导致的肝损伤通常有相应的形态模式。因此,在密切结合临床的基础上,必要时进行肝脏组织病理检查可为DILI提供诊断线索和依据。二、DILI的病理形态模式
三、抗肿瘤药物所致肝损伤的病理特征示例

四、总结
