利用HRM 功能标记检测黑龙江省水稻种质资源抗稻瘟病基因Pi2 的基因型分布
2022-07-28郭震华
郭震华
(1 黑龙江省农业科学院水稻研究所,黑龙江 佳木斯 154026;2 国家植物航天育种工程技术研究中心,广东 广州 510642)
稻瘟病作为影响最为严重的一种世界性稻作病害,每年可造成水稻减产11%~30%[1],严重制约着水稻的安全生产。黑龙江省作为北方稻区的第一水稻大省,水稻的面积和总产均超过全国水稻面积和总产的10%,是全国粮食安全的“压舱石”和“稳压器”。而黑龙江地区稻瘟病时有发生,危害严重,严重时可造成减产15%~20%。稻瘟病在水稻整个生育期内及各个部位均可发生,其中尤以叶瘟影响最为严重。因为稻瘟病复杂的遗传背景,快速变异的生理小种,一个新品种在推广3~5 年左右就可能失去抗性[2]。将生物技术(分子标记辅助选择及转基因技术等)应用于抗稻瘟病育种中,可以将优势基因聚合到一起,缩短育种年限,加快育种进程。
日本于20 世纪60 年代最先开始水稻抗稻瘟病基因的分析工作。截至2013 年5 月,共有64 个抗稻瘟病位点,78 个主效基因被报道。其中,Pi2,Piz-t,Pi9,Pia,Pib,Pita,Pid2,pi21,Pi36,Pi37,Pish,Pik,Pikm,Pi5,Pid3,Pb1,Pit,Pikp 等基因均被克隆,并且这些基因成簇的分布在除3 号染色体以外的其它染色体上。
Pi2 最初被定位在6 号染色体的标记RG64与RZ612 间[3,4],继续精细定位,通过RG64 和AP22 将遗传距离定位在0.9 cM 和1.2 cM[5]。由于Pi2 的广谱抗性,在792 个从中国收集的稻瘟小种中,接近92.45%的小种不能侵染含有Pi2 的资源材料C101A51[6]。同时,C101A51 还抗13 个国家中的36 个稻瘟小种[7]。作为NBS-LRR 一类基因,Pi2 包含3839 bp 和116 bp 两个内含子,cDNA 全长为3332 bp,编码1032 个氨基酸。在3个LRRs 区域中,Pi2 与Pi-zt 的编码氨基酸中存在8 个位点的差异,并且其中仅存在1 个位于xxLxLxx 基序中[8]。
高分辨率熔解曲线(HRM,high-resolution melting curve)技术是新兴的一种基因分型技术,通过配套的软硬件系统,可以快速自动监测DNA熔解曲线的变化,实现基因分型,分辨率可达单碱基差异,对SSR、SNP 及Indel 等不同类型变异有很好的区分效果[8]。由于不需要凝胶电泳等步骤,从而真正实现了闭管操作[9],避免污染的可能。该方法目前已在玉米[10]、大麦[11]及水稻[12]等农作物中得到很好的应用。笔者拟利用与抗稻瘟病基因Pi2 紧密连锁的HRM 分子标记[13],对黑龙江水稻种质资源进行基因分型,以期明确Pi2 基因在黑龙江水稻中的分布情况,为抗稻瘟病品种的合理利用及选育提供参考,为寒地水稻分子标记辅助选择育种(MAS)提供技术支持。
1 材料与方法
1.1 材料
选取67 份黑龙江省水稻主栽品种及优异种质资源为本研究供试水稻材料(表1),由黑龙江省农业科学院水稻研究所提供,于2014 年种植于黑龙江省农业科学院佳木斯水稻研究所试验地中。

表1 实验所需品种(系)及其来源
1.2 方法
1.2.1 水稻基因组DNA 提取 苗期分别取各试验材料的新鲜叶片,等量混合,按照McCouch[14]提供的方法进行DNA 的提取。
1.2.2 用于HRM 分析的多重巢式PCR 扩增多重巢式PCR 共包括以下两轮扩增反应:
第一轮PCR:2×Power Taq PCR Master Mix母液5 μl,外引物F/R(10 μmoL-1)各0.3 μl,基因组DNA0.5 μl,总体积10 μl,ddH2O 补足。PCR 程序:95 ℃预变性5 min,35 个循环,20sec 95 ℃变性,20sec 57 ℃退火,10sec 72 ℃延伸;5 min 72 ℃延伸。扩增程序在Gene-Amp9700 型PCR 仪(Applied Biosystems, USA)上进行。
反应结束后PCR 管加200 μl 双蒸水,稀释第一轮产物。
第二轮PCR:2×Power Taq PCR Master Mix母液4 μl,内引物F/R(10 μmoL-1)各0.3 μl,第一轮稀释PCR 产物0.5 μl,20×EvaGreen 染料(Biotium, USA)0.5 μl,内外标样各1 μl,最后ddH2O 补足10 μl。扩增程序在Gene-Amp9700 型PCR 仪(Applied Biosystems, USA)上进行。PCR程序:95 ℃预变性2 min,22 个循环95 ℃变性20 s,59 ℃退火20 s,72 ℃延伸10 s;最后95 ℃延伸2 min。
1.2.3 利用LightScanner96 系统HRM 分析第二轮PCR 产物中加入20 μL 矿物油(SIGMA公司),将PCR 产物离心转移至HRM检测板中,2000 rpm 离心2 min,检查无气泡,放入LightScanner96 高分辨率熔解曲线分析系统(Idaho Technology Inc, USA)进行HRM检测,起点温度为60 ℃,终点温度为95 ℃,平均15 min 一板PCR 反应。反应完成后,通过配套的LightScanner Call-IT、Small Amplicon 及LightScanner 分析系统分别进行基因型分析、自动化分析及HRM检测。
用于PCR 扩增反应的引物名称、序列、位置及片段大小等详细信息见表2。

表2 检测Pi2 基因的HRM 标记
2 结果与分析
对黑龙江水稻种质资源进行基因分型。通过两轮的PCR 反应,扩增终产物由于DNA 双链上突变位点的退火温度(Tm 值)不同,产生不同的峰值,从而区分不同基因型。
基于Pi2 基因对应的HRM 标记检测可以看出,灰色曲线为碱基为G 的稻瘟病感性基因Pi2,而红色曲线为碱基为T 的稻瘟病抗性基因pi2。可以看出,pi2 因T 碱基氢键多于pi2 的G 碱基,其溶解温度(Tm 值)为79~79.5 ℃,而Pi2 的溶解温度(Tm 值)为78.5 ℃,明显低于pi2 的,从而产生不同的峰值,可以清晰的区分不同基因型(图1)。由图2 可以看出,67 份材料的基因型通过不同颜色表示出,其中红色的为抗性基因pi2 的种质资源材料,灰色的为感性基因Pi2 的种质资源材料。通过分析比对,67 份种质资源中,共有9 份含资源抗性基因pi2,分别为,龙粳12、哈99774、龙粳31、龙粳39、龙粳54、龙交10-989、龙粳53、彩及zlm55-1,仅占参试种质资源的13.43%,其余58份为含感性基因Pi2 资源。可见,pi2 抗稻瘟病基因在黑龙江省分布相对较少,需要加强该基因在黑龙江省抗稻瘟病育种的应用。
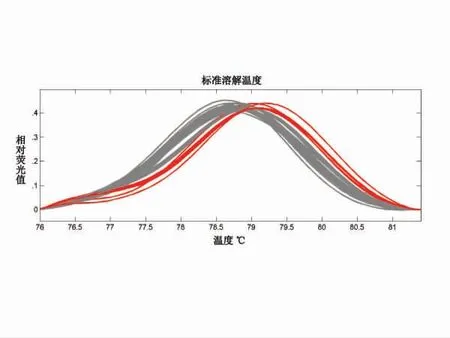
图1 Pi2 基因的HRM 溶解曲线峰值
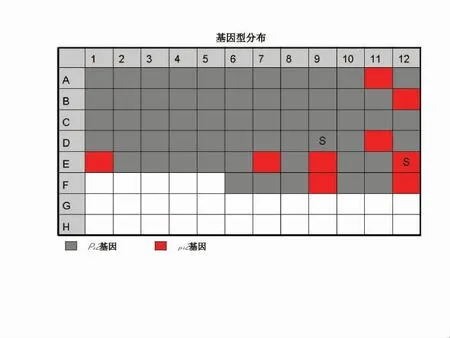
图2 Pi2 基因的HRM 标记分型
3 结论与讨论
随着分子标记辅助选择在育种中的广泛应用,各类分子标记不断出现,而最为准确的是基于抗性基因本身的序列差异开发的分子标记,称为功能标记(FMs),此类标记可以对目标性状表型进行直接反映,对通过重组可能引起遗传信息的丢失实现有效减少,实现FMs 与目标性状直接关联[15-17]。HRM技术与常规PCR 技术区别主要在于不再需要凝胶电泳步骤,直接对PCR 产物在管中进行分析,减少实验步骤,大大缩短实验时间,提高实验效率,同时降低了实验可能存在的污染率。利用该技术开发的功能标记已在玉米[10]、小麦[18]、大麦[11]及水稻[12]等农作物中成功应用。本研究所用到的HRM 标记是针对基因本身内部SNP 位点,利用HRM技术开发得到的,一方面作为功能基因标记,可以准确的发现种质间存在的基因差异,同时,基于HRM技术,又实现了高效快速的优点,可以进行大规模的基因分型及筛查,大大提高了基因检测及标记辅助选择的效率。
目前已定位的主效抗稻瘟病基因中,一半以上是以基因簇的形式存在于水稻各染色体上。Pi2,Pi9,Pi50,Pigm,Pizh,Piz,Piz-t 与Piz 都是复等位基因。小粒野生稻含有Pi9,Fukunishiki 含有Pi2/Piz5,二八占含有Pi50。在抗稻瘟病植株中,Pi9 表达不受稻瘟病侵染诱导,并且作为一个广谱抗稻瘟病基因,已报道Pi9 抗21 个生理小种。据推测,Pi9 的广谱抗瘟病性的分子机制的原因是,Pi9 能识别各生理小种的保守分子或不同分子。作为一个广谱抗稻瘟病基因,Pi2 的亲本为C101A51,该品种对来自13 个国家的43 个稻瘟病菌株中的36 个表现高抗[7]。同时,当Pi2 基因与Pi1 及Pi4 等其他抗稻瘟病基因聚合时,在不改变后代材料的农艺性状前提下,可以显著地提高水稻抗稻瘟病频率,不但可以提高叶瘟的抗性,还可以提高抗穗颈瘟的能力[18-20]。
针对水稻品种稻瘟病抗性而言,单个基因的抗性可能会随着病原菌生理小种的变化在几年内逐渐丧失,因此通过聚合育种的方法将多个稻瘟病抗性基因导入同一品种中,即可抵抗多种生理小种的侵害,从而达到广谱抗性的目的。本研究中龙粳12、哈99774、龙粳31、龙粳39、龙粳54、龙交10-989、龙粳53、彩及zlm55-1 共9 份种质含有pi2 抗性基因,对稻瘟病各生理小种有着较为广泛的抗性,为抗稻瘟病育种研究提供了有利的种质资源。
黑龙江省作为北方稻区水稻第一大省,稻瘟病一直以来是严重影响水稻产量的第一大病害。对部分黑龙江主栽品种及优异种质资源的pi2 基因的分型鉴定,结果表明,67 份种质中,仅有龙粳12、哈99774、龙粳31 等9 份种质资源含有纯合pi2 基因,占参试种质的13.43%。可见,pi2 抗稻瘟病基因虽然是一个广谱抗性基因,对稻瘟病抗性广,但在黑龙江分布相对较少,应当加大pi2 抗稻瘟病基因的导入,通过分子标记辅助手段,提高该基因在黑龙江种质资源中的分布,对黑龙江的抗稻瘟病品种的选育及提高抗病基因的合理利用有着重要的参考价值。
