志贺氏菌噬菌体ΦDS8对患病肉鸡的治疗及其肠道菌群的影响
2022-07-28陈诗雨徐美余邓征宇张麒麟邓先余林连兵
陈诗雨,徐美余,邓征宇,王 峰,张麒麟,邓先余,林连兵,*
(1.昆明理工大学 生命科学与技术学院,云南 昆明 650500;2.云南省高校饲用抗生素替代技术工程研究中心,云南 昆明 650500)
志贺氏菌属于革兰氏阴性菌,是常见的肠道致病菌,其引起的细菌病是危害公共卫生的人畜共患病之一。志贺氏菌病的流行是全球性的,尤其在发展中国家,每年出现的志贺氏菌病例大约有2.5亿,工业国家主要集中在住宅比较拥挤的地区,且发病人群大多数为幼儿。抗生素的开发,解决了大多数细菌感染导致的各种问题,长久以来抗生素都是作为处理志贺氏菌感染的首选。但随着抗生素的常年滥用,志贺氏菌逐渐出现了高频率抗药性突变,同时细菌之间的遗传信息交换更导致抗药性志贺氏菌大量蔓延。细菌抗药性的出现给临床治疗带来极大的挑战,而且由于耐药菌的快速传播,往往会带来大规模的抗药性细菌感染,不仅危害人类公共健康,也影响到养殖业,因此,对多重抗药性志贺氏菌疾病的防控显得更为困难。
随着大量耐药菌出现,噬菌体及其相关产品在预防和控制细菌病方面与抗生素相比拥有显著优势。细菌噬菌体是一类感染细菌的病毒,以细菌为宿主,个体微小且不具备完整的细胞结构。噬菌体可在敏感宿主菌中胞内增殖,最后裂解宿主菌释放子代噬菌体,从而达到破坏宿主菌的作用。使用噬菌体治疗细菌感染病的历史可以追溯到上个世纪。1919年,加拿大科学家用噬菌体制剂对4例细菌性痢疾患者治疗,取得成功。有研究发现,当5种志贺氏菌噬菌体进入小鼠体内时能够有效减少志贺氏菌在小鼠肠道中定殖,且与抗生素相比对肠道无明显有害副作用。因此,利用噬菌体疗法治疗畜禽疾病及减缓耐药性的发生显示出了独特的优势。
肠道不仅是消化吸收的重要场所,同时也是最大的免疫器官,为微生物提供了良好的栖息环境,在维持正常免疫防御功能中发挥着极其重要的作用。肠道微生物在维持肠上皮完整性方面会有一定作用,并且肠道微生物代谢产物能够影响免疫反应,阻止炎性疾病的发展。动物肠道中存在数量庞大的微生物,这群微生物依靠动物的肠道生活,同时帮助寄主完成多种生理生化功能,反映宿主的身体健康状态。噬菌体是一种很有前途的抗生素替代品,通过消除致病菌来调节肠道微生物群。已有临床研究得出结论,对胃肠道患中度病症的患者,口服噬菌体治疗是安全可耐受的。Cepko等发现肠道健康人群的无菌粪便中分离的7株噬菌体,可裂解12种流行致病菌。此外,获得有关肠道噬菌体的宏基因组信息,对于未来开发针对肠道病原体的特异性噬菌体至关重要。Fujimoto等发现噬菌体宏基因组信息和宿主细菌的关联,可以用于分离新的特异性噬菌体抗菌化合物,从而控制病原体。本研究基于前期噬菌体ΦDS8的良好抑菌效果,借助动物肠道菌群,研究噬菌体对于患志贺氏菌病肉鸡的治疗效果。
1 材料与方法
1.1 实验材料
90只30日龄的云南本地黄羽肉鸡(后文简称肉鸡)购于昆明织布营孵化场,于昆明理工大学生命科学与技术学院动物实验基地养殖。志贺氏菌株BDS8及其对应噬菌体ΦDS8于昆明理工大学生命科学与技术学院保存。
1.2 宿主细菌制备
将BDS8菌株斜面在SS琼脂培养基划线过夜培养,挑取单个菌落于5 mL LB液体试管培养3 h后,接种到500 mL LB液体培养基中,在37 ℃,150 r·min摇床中培养12 h。将培养后的宿主菌梯度稀释,在SS琼脂培养基中进行涂布计数,获得宿主菌BDS8。
1.3 噬菌体液的制备
用300 mL LB液体培养基培养志贺氏菌BDS13菌株(该菌株为噬菌体ΦDS8宿主菌,但其致病性很弱,适合用于扩增噬菌体)在37 ℃、150 r·min摇床中培养12 h至对数期后,加入5 mL噬菌体ΦDS8培养8 h,培养液于8 000×离心,取上清液通过0.45 μm滤膜过滤,获得噬菌体液,利用双层平板法进行噬菌体滴度检测。
1.4 噬菌菌体对感染志贺氏菌肉鸡的治疗能力
在志贺氏菌感染前灌喂噬菌体,评价噬菌体对志贺氏菌感染的预防效果;在志贺氏菌感染后灌喂噬菌体,评价噬菌体对志贺氏菌感染的治疗效果。
1.4.1 噬菌体治疗感病肉鸡实验分组
实验分组如表1所示。选取90只30日龄的健康肉鸡,在动物实验房中正常饲喂一周后进行实验。共分6组,每组15只。每只肉鸡灌喂1×10CFU的志贺氏菌BDS8造成感染,感染成功的肉鸡出现腹泻症状,粪便呈水样。ΦDS8噬菌体液分别在志贺氏菌感染前2 h和志贺氏菌感染后2 h进行灌喂,设感染前2 h的治疗时间点为0 h,感染后2 h的治疗时间点为4 h,每只灌喂1×10PFU,以评价噬菌体的预防与治疗效果,对肉鸡性状观察以及粪便样品采集至实验处理后48 h。

表1 动物实验分组表
1.4.2 噬菌体治疗感病肉鸡效果评估
从以下几个方面评估噬菌体ΦDS8对感染志贺氏菌株BDS8肉鸡的治疗效果。实验过程中48 h内各实验组肉鸡粪便性状的变化情况。实验过程中48 h内各实验组肉鸡每克粪便中志贺氏菌含量变化:取各组0、2、4、6、12、24、48 h肉鸡的粪便样品0.1 g,溶于10 mL 1% NaCl溶液中均匀混合,静置20 min后取上清液进行梯度稀释,于SS琼脂培养基涂布,恒温培养箱37 ℃培养12 h后进行菌落计数。实验过程中48 h内各实验组肉鸡每克粪便中噬菌体含量变化:取各组0、2、4、6、12、24、48 h肉鸡的粪便样品0.1 g,溶于10 mL 1% NaCl溶液中,混匀后离心取上清液用0.45 μm滤膜过滤,BDS8为宿主,用双层平板法对噬菌体进行计数。实验处理后正常饲喂15 d记录各组肉鸡存活率,并对各组肉鸡进行解剖观察,从器官病变情况,是否出现炎症等各方面进行观察记录。
1.5 治疗组肉鸡粪便样品细菌多样性测序
为了探究志贺氏菌噬菌体ΦDS8治疗感染肉鸡对肠道菌群的影响,取治疗组0、2、12、48 h粪便各2份,命名为治疗组0-A/治疗组0-B、治疗组2-A/治疗组2-B、治疗组12-A/治疗组12-B、治疗组48-A/治疗组48-B,通过测序技术分析治疗过程中肉鸡肠道菌群细菌多样性的变化规律。
1.5.1 样品DNA提取及高通量测序
按照DNA提取试剂盒(DP328)说明书进行粪便DNA提取。根据16S全长引物27F和1492R合成带有Barcode的特异引物,对样品DNA进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库(SMRT Bell)。进行文库质检,选取质检合格的文库用PacBio Sequel进行测序。PacBio Sequel下机数据为bam格式,通过smrtlink分析软件导出CCS文件,根据Barcode序列识别不同样品的数据并转化为fastq格式数据。
1.5.2 信息分析流程及统计分析
将PacBio下机数据导出为CCS文件(CCS序列使用Pacbio提供的smrtlink工具获取)后,使用lima v1.7.0软件,通过barcode对CCS进行识别,得到Barcode-CCS序列数据。使用百迈客公司自主研发的软件对Barcode-CCS进行过滤,得到有效序列。使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到Optimization-CCS序列。使用Usearch软件对Tags在97%的相似度水平下进行聚类、获得分类操作单元(OTU),并基于Silva(细菌)和 UNITE(真菌)分类学数据库对OTU进行分类学注释。基于OTU分析结果,对样品菌群相对丰度变化分析,并对样品在各个分类水平上进行分类学分析,获得肠道菌群相对丰度变化图,及各样品在门、纲、目、科、属、种分类学水平上的群落结构图。
2 结果与分析
2.1 噬菌体治疗感病肉鸡
2.1.1 肉鸡粪便性状变化
如表2中所示,3组灌喂志贺氏菌株BDS8菌液的肉鸡在感染2 h后均出现腹泻,症状轻微,拉白色水样粪便。其中阳性对照组腹泻情况随时间推移持续加剧,在12 h时已十分严重,出现血便,肉鸡精神萎靡,活动量减少,持续至48 h也未恢复正常。噬菌体治疗组在12 h时基本停止腹泻,精神状态良好,活动量正常。噬菌体预防组在12 h时有轻微腹泻症状,24 h时停止。阴性对照组、噬菌体治疗对照组、噬菌体预防对照组在实验48 h内均未出现过腹泻症状,精神状态良好,进食量和活动量正常。

表2 肉鸡粪便性状变化表
2.1.2 肉鸡粪便中志贺氏菌含量变化
感染BDS8之前,正常肉鸡粪便中志贺氏菌含量约为5.6×10CFU·g。3组灌喂了致病菌的肉鸡,被感染后粪便中志贺氏菌含量都呈上升趋势,感染4 h后达到最高值,约1×10CFU·g。不同的是,阳性对照组在感染4 h后,粪便中志贺氏菌含量缓慢减少,且48 h内并未恢复正常水平,2组灌喂了噬菌体的肉鸡分别在感染6 h和12 h后接近治疗前水平。没有感染志贺氏菌的噬菌体治疗的噬菌体预防组和噬菌体治疗组粪便中志贺氏菌含量达到最高值后又急剧下降,对照组、噬菌体预防对照组及阴性对照组志贺氏菌含量均无明显变化。
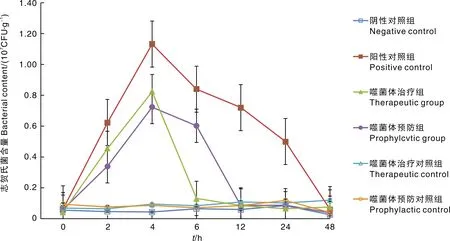
图1 各组肉鸡每克粪便中志贺氏菌的含量变化
2.1.3 肉鸡粪便中噬菌体含量变化
对各实验组肉鸡粪便中以BDS8为宿主的噬菌体含量检测,实验结果如图2所示。实验处理之前肉鸡体内不存在以BDS8为宿主的噬菌体。噬菌体治疗对照组与噬菌体预防对照组,噬菌体的含量在灌喂2 h后有一个小幅度的上升下降,后处于一个较低的水平位。噬菌体治疗组肉鸡粪便中噬菌体含量在灌喂后2 h左右开始增长,快速增长至12 h,达到最高值后开始回落,而噬菌体预防组肉鸡粪便中噬菌体含量在灌喂后缓慢增长,至24 h后开始回落。这两种治疗方案中,噬菌体肉鸡体内存活时间持续至48 h,而没有宿主的对照组,噬菌体在体内存活时间不超过12 h。

图2 各组肉鸡每克粪便中噬菌体ΦDS8的含量变化
2.1.4 肉鸡正常饲喂15日后存活率变化
如表3所示。在保证水料充足的情况下正常饲养15 d后,细菌感染组共计有6只肉鸡死亡,存活率为60%,预防组有1只死亡,存活率为93%。其余各组肉鸡生长正常,存活率均为100%。
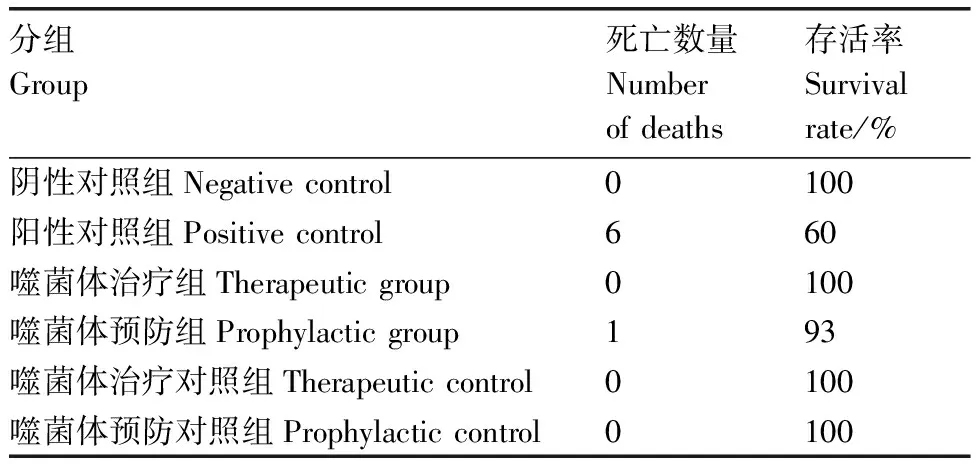
表3 肉鸡正常饲养15 d存活率
2.2 肉鸡解剖观察
从解剖学方面评估噬菌体治疗志贺氏菌感染肉鸡的效果。观察发现,细菌感染组肉鸡体内出现了大量黄色结节,肠道明显出血,同时心脏有大量包膜,肿大,但是肉鸡肌胃、腺胃未见明显斑点,说明体内病变并非病毒导致。阴性对照组的肉鸡体内未见病变,各器官正常,肠道无出血,同样胃部未见明显斑点。噬菌体治疗组,治疗对照组及噬菌体治疗组的解剖结果,与阴性对照组十分相似,未见明显器官病变,同样也未出现肠道出血等症状,心脏没有包膜,大小正常。但噬菌体预防组出现了一只轻微病变的肉鸡,肠道出现轻度出血。
2.3 治疗组肉鸡粪便细菌多样性分析
2.3.1 测序结果
如图3所示。对治疗组的4个时间点共计8个肉鸡粪便微生物样品进行测序,测序后通过Barcode识别共获得55 530条CCS(circular consensus sequencing)序列,每个样品至少产生2 387条CCS序列,平均产生6 941条CCS序列。稀释曲线可以作为对各样本测序量是否充分的判断。随着样本数量增加,OTU曲线趋于平缓,说明样品测序量充足,序列充分,可以进行数据分析。

图3 粪便样品稀释曲线图
2.3.2 治疗组各时间点肠道菌群的组成
Alpha多样性(Alpha diversity)反映的是单个样品物种丰度(richness)及物种多样性(diversity)。Chao1指数和Ace指数衡量物种丰度即物种数量的多少。Shannon指数和Simpson指数用于衡量物种多样性,相同物种丰度的情况下,群落中各物种均匀度越大,则认为群落具有越高的多样性,Shannon指数值越大,Simpson指数值越小,说明样品的物种多样性越高。OTU覆盖率Coverage指数反映本次测序结果是否代表了样本中微生物的真实情况,Coverage指数越高,样本中物种被测出来的概率越大。各样品Alpha多样性指数值统计如表4所示。

表4 治疗组肉鸡不同感染时间测序结果
2.3.3 治疗组各时间点肠道菌群相对丰度变化
如图4所示。样品的Bray-Curtis距离的主坐标分析(PCoA)表明,各小时的样品中,2 h与12 h分别与其他时间段明显分开,且各自生物学重复间具有更近的距离,而0 h和48 h相距较近,表明噬菌体治疗48 h后的肉鸡粪便已恢复灌喂志贺氏菌前的状态。
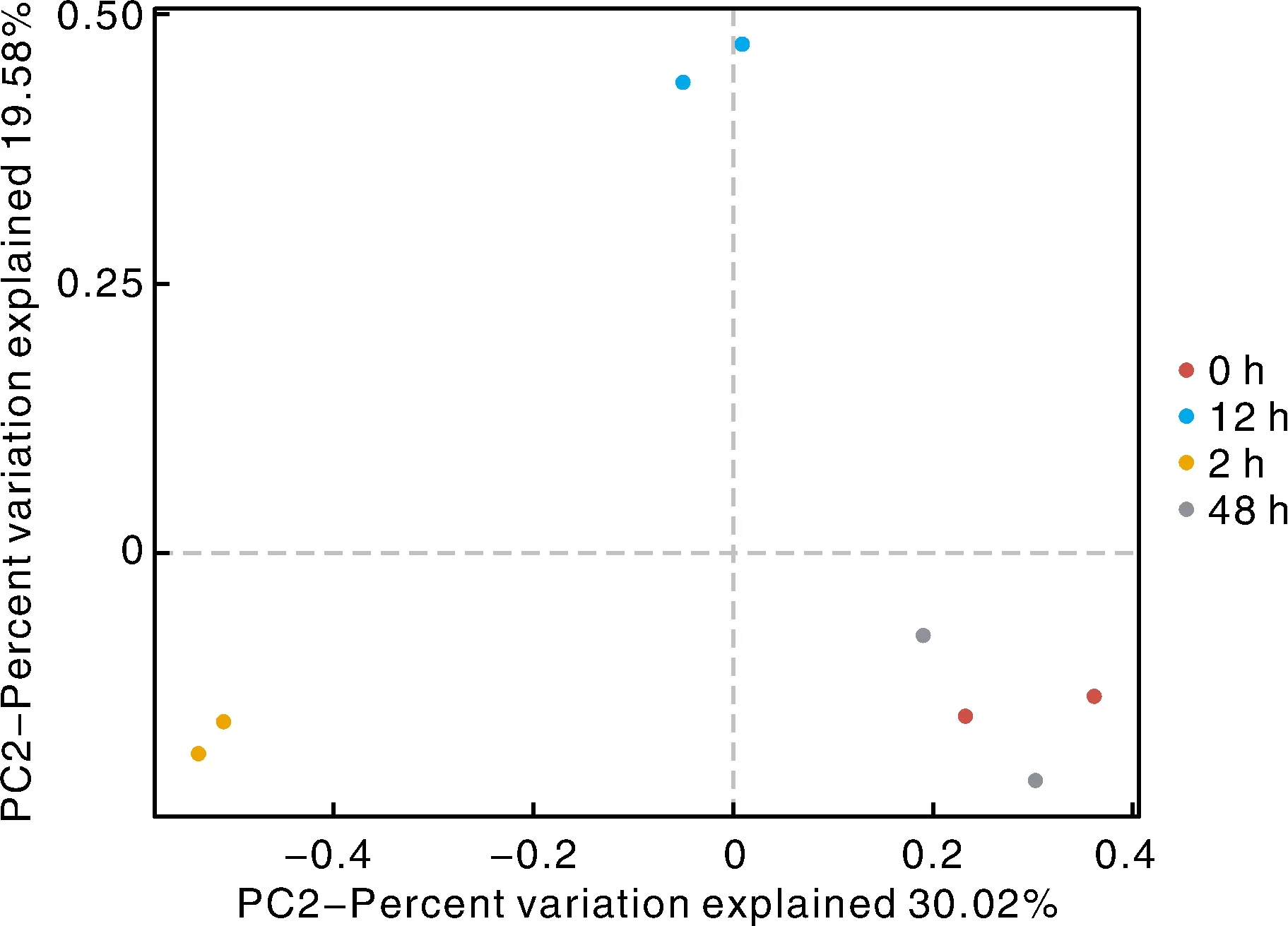
图4 治疗组肉鸡粪便肠道菌群PCoA图
治疗组肉鸡0、2、12、48 h肠道肠道菌群在门分类水平的组成如图5所示。主要门类为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)、梭杆菌门(Fusobacteria)、髌骨细菌门(Patescibacteria)、厚壁菌门(Tenericutes)、Epsilonbacteraeota。其中厚壁菌门在0 h感染之前相对丰度就分别占到了治疗组0 h样品A、B的98.6%与86.3%,而在感染后的2 h迅速下降,分别跌落至21.3%与12.5%,通过噬菌体的治疗后在12 h又分别逐渐回升至42.2%与71.0%。在治疗后48 h时最终回升至94.2%。与此形成鲜明对比的变形菌门在未被细菌感染的0 h,相对丰度为1.2%与2.1%,而在被细菌感染后,变形菌门的相对丰度上升至70.6%与85.3%,有着显著性差异的是,在噬菌体治疗后的12 h,变形菌门的相对丰度下降至56.1%与20.2%,后在48 h回落至0.4%与32.4%。

图5 治疗组肉鸡粪便样品门水平柱状图
如图6所示。从属水平上,排名前十的属为巨单胞菌属()、沙雷氏菌属()、冷杆菌属()、拟杆菌属()、、志贺氏菌属()、、肠球菌属()、假单胞菌属()、乳杆菌属()。相对丰度>1%的细菌属定义为优势属。发现在肉鸡感染志贺氏菌前,肉鸡肠道中的乳杆菌属()作为优势菌群,相对丰度均达到了76.1%,而在志贺氏菌株BDS8感染后的2 h,乳杆菌的相对丰度迅速下降至6.6%,尽管噬菌体治疗后,肉鸡肠道中乳杆菌属的相对丰度仍然不见明显回升,只占据了2.7%,最终噬菌体治疗后的48 h,乳杆菌属()的相对丰度恢复正常水平,达到76%。在有害菌的相对丰度变化中,较为明显变化的有假单胞菌属(),在未被志贺氏菌BDS8感染前的0 h,体内相对丰度低0.1%。在细菌感染后,假单胞菌属()的相对丰度急剧升高,达到62.8%,而在噬菌体治疗后的12 h,下落至15.85%,虽然相较于2 h已经有了大幅度的回落,但是相较于感染前仍处于较高的相对丰度。在噬菌体治疗后的48 h,假单胞菌属()的相对丰度回归正常水平,为0.01%。在感染前,正常肉鸡体内的志贺氏菌属()相对丰度为0.06%,在感染细菌后的2 h,上升至3%,相较于正常水平相对丰度提升了接近5倍。而在噬菌体治疗后,相对丰度与假单胞菌属保持相似规律,下降至0.38%。最终在噬菌体治疗后的48 h,志贺氏菌属()在肠道中的相对丰度为0.03%,甚至相较于初始相对丰度更低。埃希氏菌属与志贺氏菌属保持相似的变化规律。在感染前体内相对丰度为0.03%,而在被志贺氏菌感染后迅速上升至0.41%,但是在噬菌体治疗后的12、48 h分别下降至0.08%、0.02%。
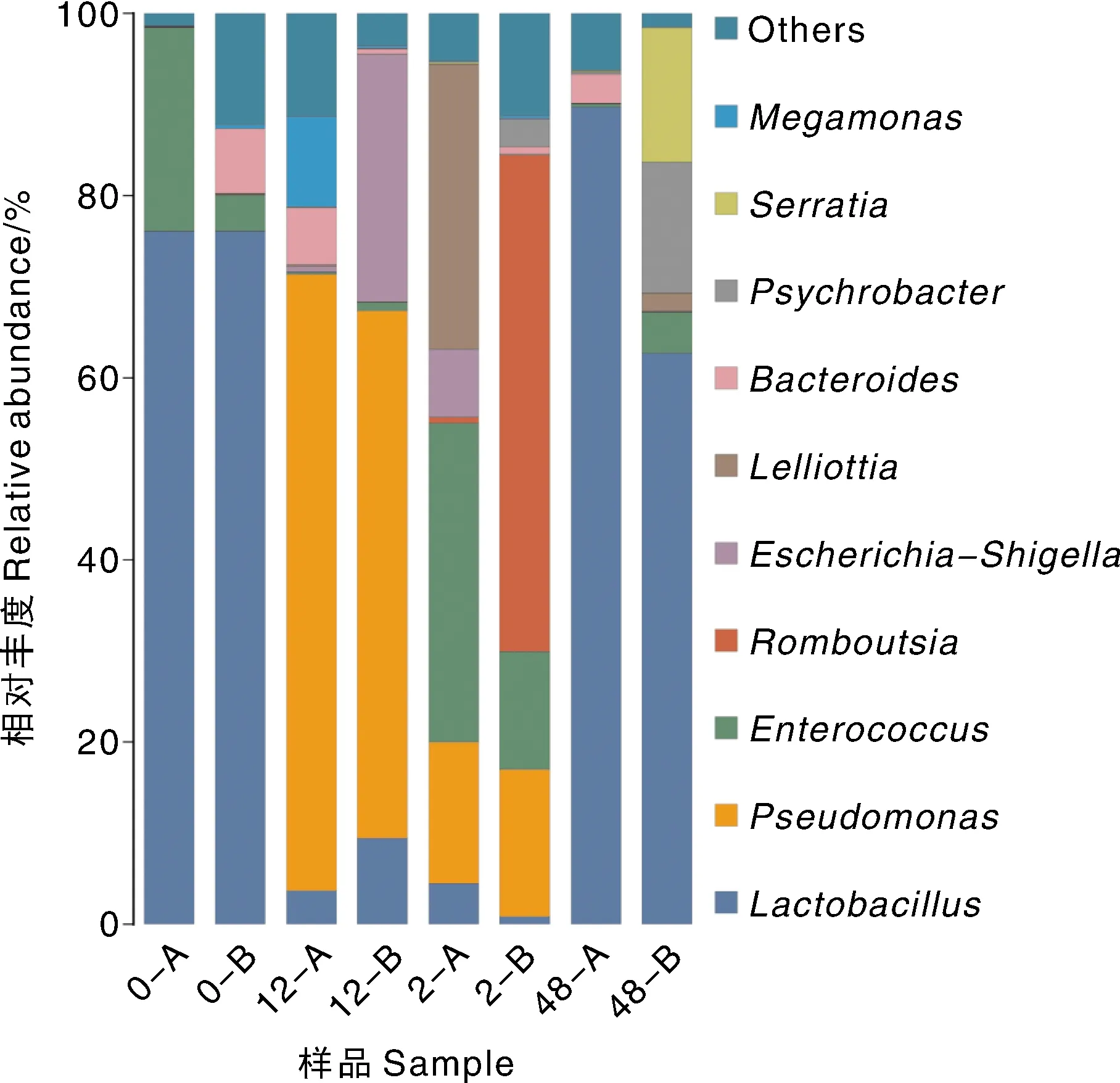
图6 治疗组肉鸡属水平肠道菌群柱状图
3 结论与讨论
噬菌体自发现以来到如今已经一百多年了,目前,关于噬菌体应用的相关研究,涵盖了医学、养殖业、种植业等各个领域。现如今耐药性细菌横行,噬菌体成为抗生素替代产品是很有必要的。本实验通过细菌培养技术及高通量测序技术,从细菌数量及核酸相对丰度2个方面揭示了灌服噬菌体对患病肉鸡肠道菌群的影响。使用噬菌体ΦDS8治疗被志贺氏菌感染的云南肉鸡,采用感染前灌喂噬菌体和感染后灌喂噬菌体两种治疗方法。观察发现灌喂志贺氏菌后肉鸡均出现腹泻,各组肉鸡粪便中志贺氏菌含量上升迅速,感染后灌喂噬菌体的肉鸡24 h后腹泻已有好转,48 h时已完全恢复健康,而只灌喂噬菌体的肉鸡完全没有出现腹泻,验证了志贺氏菌有损害肉鸡肠道健康的能力,也证明单灌喂噬菌体对肉鸡粪便性状并无明显直接的负面影响。对比葛龙等实验结果,其实验中治疗结束后鸡仍有腹泻情况存在,说明ΦDS8对感染志贺氏菌肉鸡响应迅速、疗效显著。噬菌体含量在有宿主感染的肉鸡体内出现了上升趋势,而在没有宿主感染的肉鸡体内含量较少,预推测是由于噬菌体在肉鸡体内无宿主的情况下,在体内无法长时间存活,随着时间推移在体内死亡或被排出体外,导致感染后能有效治疗细菌的噬菌体数量较少从而影响治疗效果,这也可能是治疗组初始噬菌体含量高于预防组的原因。这些情况都充分说明了ΦDS8在体内表现出了活性。从实验结果发现,高滴度的噬菌体在治疗细菌感染方面有十分迅速的响应及优异的效果,感染后及时治疗相较于提前预防更为有效,且噬菌体在治疗期间并没有对肉鸡本身造成负面影响。
本研究基于PacBio测序平台对样品进行第三代高通量测序,测序样品平均序列读长均在1 400 bp以上,故本研究的reads数量相对较少,相应地,相比于二代测序,OTU数量相对较少,但由于测序读长较长,可以在种属水平上深入揭示样品的物种构成,进一步进行α多样性分析(Alpha diversity)、β多样性分析(Beta diversity)和显著物种差异分析等。通过对治疗组肉鸡粪便菌群的多样性分析发现,在灌喂志贺氏菌和噬菌体后,肉鸡肠道菌群发生了较大变化。门水平上厚壁菌门与变形菌门变化明显,属水平上乳杆菌属、假单胞菌属、志贺氏菌属、埃希氏菌属变化较为明显。这与张灿、Wei等的实验结果相似。厚壁菌门是肉鸡肠道菌群中最大的细菌组成部分,在肉鸡新陈代谢的过程中进行淀粉的消化和发酵,有生产能量的作用。变形菌门包括很多致病性细菌,其相对丰度增加会加剧肠道微生物失衡,也是机体疾病的征兆。实验结果显示,肉鸡感染志贺氏菌后,厚壁菌门的丰度降低,变形菌门的丰度升高,由此可见,感染志贺氏菌可能会增加肉鸡肠道菌群失衡和机体患病的概率。尽管治疗后变形菌门含量占16%左右,但厚壁菌门的含量超过94%,说明ΦDS8对肉鸡肠道恢复健康及减少患病概率有促进作用。
乳杆菌属是肉鸡健康肠道中的优势菌属,相对丰度70%左右,这可能由淀粉分解和乳酸发酵引起的,乳杆菌属有助于消化饲料,促进营养物质吸收。已有实验证明,乳杆菌属能通过调节肠道菌群,改善免疫系统功能,有效缓解小鼠腹泻。志贺氏菌感染后,肉鸡肠道中的乳杆菌属含量大幅降低,说明志贺氏菌可能对肉鸡肠道消化饲料和吸收营养物质产生负面影响,长久下来甚至减缓肉鸡的生长发育。在有害菌的相对丰度变化中,较为明显变化的有假单胞菌属、志贺氏菌属及埃希氏菌属。大肠埃希菌属于条件性致病菌,鸡大肠杆菌病是由鸡源致病性埃希菌引起的细菌性感染病。已有实验结果表明,多药耐药性假单胞菌会加重小鼠慢性结肠炎炎症反应。这些有害菌属丰度的上升,增加了肉鸡患肠道感染病的风险,并加重炎症反应。灌喂ΦDS8后这几种有害菌属和乳杆菌属的相对丰度回到正常水平,肉鸡腹泻症状得到缓解,肠道消化吸收恢复正常,降低了肉鸡患病的风险。
肠道菌群分析结果表明,噬菌体治疗肉鸡细菌感染病有着十分快速有效的响应,且不会改变肠道菌群结构。对比葛龙等的实验结果发现,本实验肉鸡肠道中的益生菌属,在遭受细菌感染后相对丰度均呈下降趋势,但在噬菌体治疗后最终恢复至正常水平。这说明相比抗生素的广谱杀菌性,噬菌体不仅可以治愈染病肉鸡,更有益于肉鸡肠道健康,保证治疗后肉鸡健康生长。这为生产实际使用噬菌体治疗和噬菌体的大规模使用提供了坚实的理论基础。
综上所述,噬菌体ΦDS8治疗感染志贺氏菌的肉鸡具有高效性和专一性,且对肉鸡机体自身没有伤害,在使肠道菌群恢复正常状态的同时,保护了肉鸡肠道中有益菌群,可见噬菌体作为抗生素替代产品有潜在应用价值和较好的前景。
