背根神经节解剖及其参与神经病理性疼痛机制的研究进展*
2022-07-28李丽梅郑宝森张志利喻文立杜洪印
神经病理性疼痛 (neuropathic pain, NP) 是由躯体感觉神经系统损伤或疾病引起,包括外周神经系统重塑(外周敏化)和中枢神经系统重塑(中枢敏化)
。尽管近年来对NP 的认识、诊断、病理生理机制和治疗取得了进展,但有效、可靠和持久的治疗目标仍然难以实现,临床上仍有不少难治性NP 的发生,对病人的躯体功能和生活质量产生极大负面影响。
众所周知,背根神经节 (dorsal root ganglion,DRG) 是初级感觉神经元胞体汇聚之地,具有传输和调节机体感觉、接受和传导伤害性感受的功能。近年来研究表明,急性或慢性神经损伤可触发DRG神经元的兴奋性发生变化,DRG 神经元胞体和纤维上广泛表达的多种与疼痛机制密切相关的分子和通路被激活,使DRG 与脊髓背角神经元之间的突触联系重塑,且脊髓背角胶质细胞功能发生变化,这些改变在NP 的发病过程中具有十分关键的作用,因此DRG 靶向镇痛成为NP 治疗研究的热点
。目前国内尚无建立在DRG 解剖基础上关于NP 发病机制的研究。本文就DRG 解剖细节及其参与神经病理性疼痛的主要分子和通路研究进展进行综述。
一、背根神经节解剖基础
1. 位置解剖
按照经典的解剖学描述,脊神经分别由1 根前根(运动根)和1 根后根(感觉根)混合组成,DRG 是位于脊髓后根上近椎间孔处的膨大,是感觉传导的初级神经元。矢状位DRG 位于椎间孔上三分之一的内或外,通常呈梭形或卵圆形,长径为5~10 mm,短径为3~6 mm。当长、短径相近时,DRG 的形态则接近于球形。通常认为,颈段和腰段DRG 体积较大,胸段DRG 体积较小,体现了“两头大、中间小”的分布趋势,这与该区域紧邻众多上、下肢脊神经(臂丛神经和腰丛神经)的发源节段-颈膨大 (C
-T
) 和腰膨大 (T
-L
) 有关
。DRG 敏感的神经根和坚固的椎骨结构紧密相邻,当椎体损伤、椎间盘突出或椎间孔狭窄后,容易造成DRG 或邻近神经根的慢性压迫,诱导合成和释放大量的炎症介质,增加痛觉感受器神经元兴奋性,产生异位放电,从而增加DRG 伤害性信号传入。DRG 还通过灰白交通支与椎体附近的交感神经链紧密相连,白交通支可作为椎间盘源传入神经的通道,将脊髓固有疼痛信号传递给DRG
。由此可见,DRG 这一解剖位置可能是其容易受损伤引起临床疼痛症状的主要原因,也为DRG 神经元的局部治疗提供了可能(见图1)。最近,Hong 等
发现脊髓电刺激(spinal cord stimulation, SCS) 治疗胸段 (T
-T
) 带状疱疹后神经痛 (postherpetic neuralgia, PHN) 难以获得理想的刺激覆盖,联合DRG 局部电刺激后刺激引发的异常感觉可覆盖全部疼痛区域。DRG 局部电刺激将在未来神经调控和顽固性NP 治疗中具有一定的应用前景,但需大样本临床研究进一步验证。
除了正常的学业考试,学生还面临着一些资格或证书考试,如英语四六级考试,这是最令大学生头痛的事。有的学生屡次不过,就采用高科技手段作弊。但是随着对考试纪律的加强和严查,高校采取“电子狗”和手机信号屏蔽等应对措施,一部分学生自然落入“法网”,受到了处分。这些处分对大学生的心理和家人都带来一定的影响。另外,随着就业形势的日益严峻,大学生在校期间疯狂盲目考证,参加考证补习班,企图增加就业“砝码”。还有的学生选择考研或考公务员,也需要参加辅导班。这些都给大学生带来了一定的学业上的压力。
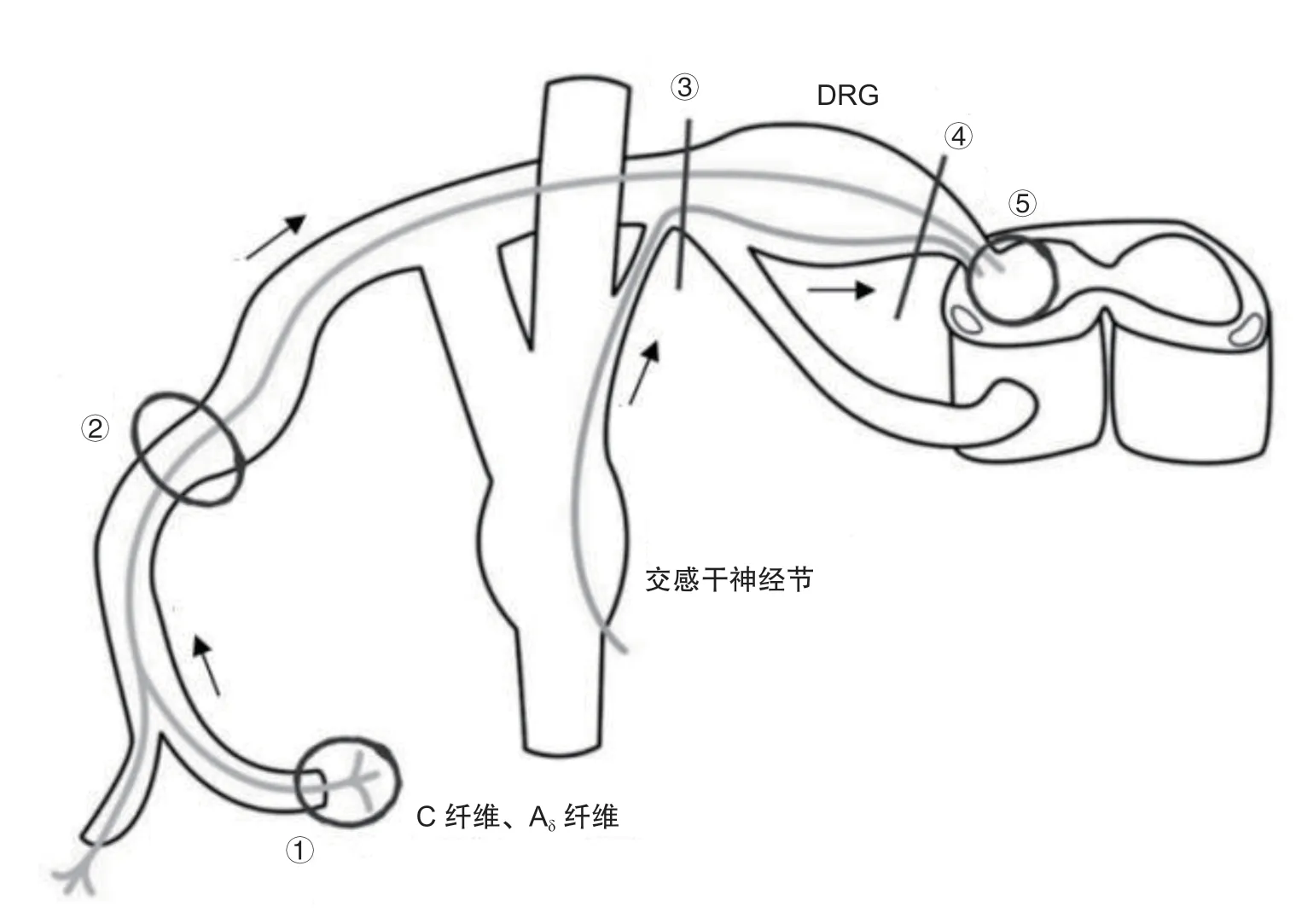
与中枢神经系统中的血脑屏障不同,DRG 和外周轴突缺乏有效的神经血管屏障,这使得神经毒素可轻易穿透神经血管屏障进入DRG 内,刺激神经元产生动作电位。DRG 这种高渗透性的血管存在,对维持受体、离子通道、细胞骨架、转运蛋白的生产和运输至关重要,具有非常重要的临床价值,它使药物容易扩散,为化学性细胞靶向治疗提供天然的治疗条件。利用DRG 的解剖位置和渗透特性,最近有学者在椎间孔DRG 区注射小剂量重组人干扰素α-2b 联合脉冲射频治疗带状疱疹神经痛
,术后疼痛评分及加巴喷丁和吗啡口服剂量均明显降低,炎性指标半乳糖凝集素3 (galectin-3, Gal)和白介素6 (interleukin 6, IL-6) 降低,PHN 发生率明显减少,表明针对DRG 进行的神经调控和药物注射联合治疗可明显提高疗效,且不良反应少。未来能否有更多的治疗药物DRG注射以实现NP的有效治疗,值得研究。
随着临床应用解剖的不断深入和影像技术的进步,DRG 的解剖变异也得以进一步认识。Shen 等
采用磁共振三维选择性水激发序列 (three dimensional water-selective excitation, 3D-WATS),通过对115 名健康志愿者腰段DRG 的位置、信号强度及形态分析后发现,DRG 多为椎间孔型,只有5.7%的第5腰椎 (L
) DRG 位于椎管内;DRG 直径从L
至L
逐渐增大,且男性L
、L
和L
DRG 直径大于女性;双节常见于L
和L
DRG,在L
和L
多为单一神经节,且越靠近尾侧椎管内型DRG 越多,也越容易受压。对DRG 正常解剖和变异影像学的认识,将有助于根据DRG 的具体解剖位置选择个体化的治疗靶点,并进行临床效果的评估。
2.显微解剖
DRG 包含假单级神经元 (pseudounipolar neuron),单个轴突从细胞体伸出并在独特的T形连接处分叉,轴突的外周部分延伸到外周的受体末端,负责传入信号;中心部分延伸到中枢神经系统,终止于同侧或对侧广动力范围神经元、抑制性神经元和脊髓背角的其他靶点(Huygen 等. 2018)。在肢体神经节段水平上,每个DRG 中存在多达15,000 个神经元,细胞体直径从20~150 μm 不等,根据纤维直径、髓鞘形成情况和传导速度的不同,将神经纤维分为无髓鞘C 纤维或薄髓鞘A
纤维的小直径神经元,以及厚髓鞘A
和A
纤维的大直径神经元。研究发现,周围神经病理性疼痛综合征主要累及小直径A
纤维和C 纤维。A
和C 纤维除了可将伤害性信息(温度、机械和化学诱导信号)由外周神经末梢传送到DRG,自身在受伤后也会向DRG 传递伤害性信息,导致更弥漫性和更深层次的继发性疼痛
。
最近有研究将DRG 小直径神经元细分为两个亚群
:一种表达神经肽、P 物质和降钙素基因相关肽(calcitonin gene related peptide, CGRP);另一种不表达神经肽,但结合同工凝集素B4 (isolectin B4,IB4),而大直径神经元表达神经丝蛋白-200 (neurofilament 200, NF200)。DRG 神经元也可以根据神经营养因子受体的表达进行分类:肽能小直径神经元表达神经胶质源性神经营养因子家族受体a3 (glial cell line-derived neurotrophic factor family receptors a3,Gfra3) 和红肌球蛋白受体激酶a (tropomyosin receptor kinase A, TrkA),非肽能性小直径神经元含有Ret 受体和Gfra2,大直径神经元表达TrkB 或TrkC。另外,为进一步揭示DRG 的分子特征,Chiu 等
采用细胞型特异性转录谱分析,对DRG 感觉神经元进行详细的分子分型,识别出三类主要、不重叠的、几乎包括所有C 纤维和大部分A 纤维的DRG 神经元群体:IB4
SNS-Cre/TdTomato
、IB4
SNS-Cre/TdTomato
以及Parv-Cre/TdTomato
,它们包括大多数伤害感受、瘙痒感受和本体感受神经元,通过对选择的334 个单神经元进行高度平行的实时荧光定量PCR (quantitative real-time PCR, qRT-PCR) 技术分析,进一步证明了DRG 的分子特征,这些数据显著增加了我们对已知DRG 群体分子身份的了解,并揭示了潜在的新亚群和躯体化相关神经元的复杂性和多样性。
二、DRG 参与NP 的可能机制
许多分子和通路被认为是NP 的潜在生物标志物或调节剂。迄今为止,在DRG 中得以确认且典型的分子及通路包括电压门控钠通道 (VGSCs)、电压门控钙通道(VGCCs)、瞬时受体电位(transient receptor potential, TRP)通道、嘌呤P2X 受体家族及卫星胶质细胞等,它们在NP 的形成过程中起十分重要的作用。
DRG 中包含大量的胶质细胞。在每个DRG中,胶质细胞的数量大约是神经元的8 倍,这些胶质细胞携带许多神经活性物质的受体,可以接收来自其他细胞的信号,并对环境变化作出反应。卫星胶质细胞 (satellite glial cells, SGCs) 是一种特殊形式的胶质细胞,广泛分布于DRG 和TG。和中枢神经系统中的星型胶质细胞一样,DRG 中的SGCs 也表达胶质纤维酸性蛋白 (glial fibrillary acidic protein,GFAP),GFAP 是SGCs 活化程度的标志分子,其免疫活性与痛觉敏化呈正相关。SGCs 包裹着每一个初级感觉神经元 (primary sensory neuron, PSN),创造一个功能单元,从物理上与其他PSN 体细胞分离。另一方面,这些细胞之间仅有20 nm 的间隙,SGCs通过缝隙连接蛋白相互连接,尤其缝隙连接蛋白43(connexin protein 43, Cx43),Cx43 表达的多少直接决定细胞间信息交换的效率与程度。通过相邻神经元的交叉兴奋或交叉敏感放大信号,SGCs 在DRG中的双向细胞通信中发挥积极作用,并参与调节炎症和NP
。
1.离子通道
(1)电压门控钠通道:电压门控钠通道(voltage-gated sodium channels, VGSCs) 是一种大型跨膜蛋白复合物,由9 种α 亚基(分别命名为Na
1.1-1.9)和4 个附属的β 亚基 (β1-β4) 组成,它们对于感觉刺激的初始转导、动作电位的生成和感觉神经元末梢神经递质释放必不可少,是调节神经元兴奋性的基础。VGSCs 表达的改变以及翻译后修饰有助于感觉神经元在慢性疼痛状态的敏化,可以产生异常的自发放电模式。通过分子克隆技术揭示出的9 个具有不同物理性质的VGSCs,至少6种存在于DRG 神经元,它们是Na
1.1、Na
1.2、Na
1.6、Na
1.7、Na
1.8、Na
1.9,其中Na
1.7,Na
1.8和Na
1.9 主要表达于DRG 小直径伤害性神经元,作为疼痛信号事件的关键组成部分而受到特别关注
。
LI Xuanqiong, LIANG Yanlong. Study on the temporal and spatial evolution mechanism of environmental response to mineral resources development[J]. Conservation and utilization of mineral resources, 2018(6):114-120.
其次是构筑新平台,建设南京和平交流中心。积极参与国际和平事务,充分发挥南京在“国际和平城市”协会中的应有作用。与联合国教科文组织合作,举办和平学国际学术研讨会、国际和平城市市长论坛、国际青年和平论坛、国际和平大会等,积极参与国际和平活动。每年参加、组织国内外和平交流或学术研讨活动3-5次。加入国际和平城市联盟。积极申请联合国教科文组织和平城市奖。探索设立南京和平奖项目。每年策划重大纪念日纪念活动,组织和参与国际性纪念活动等。大力开展民间和平交流活动。成立南京民间和平组织,举办和平使者选拔活动,组建一批国际和平志愿者队伍,为南京国际和平城市建设奠定坚实的基础。
Na
1.7 通道:根据VGSCs 对河豚毒素 (tetrodotoxin, TTX) 的敏感性分为河豚毒素敏感性 (TTX-S) 和河豚毒素不敏感性 (TTX-R) 钠通道。Na
l.7 是河豚毒素敏感 (TTX-S) 的快电流钠离子通道,几乎特异性地在DRG 表达。编码人类Na
1.7 的SCN9A 基因的功能缺失或突变,可导致先天性痛觉缺失 (congenital insensitivity to pain, CIP) 和嗅觉丧失,而不会影响(如触觉和温度觉等)其他感觉
。另一方面,Na
l.7 功能获得性突变可导致阵发性疼痛,如原发性红斑性肢痛 (primary erythermalgia, PE) 和阵发性极端疼痛障碍 (paroxysmal extreme pain disorder,PEPD)
。目前已发现在小纤维神经病 (small fiber neuropathy, SFN )中,Na
1.7 功能突变可增加DRG神经元兴奋性
。在表达SFN 相关Na
1.7 功能突变培养的DRG 神经元中,稳态ATP 水平降低,去极化诱发的ATP 衰减加快,线粒体密度和大小减少。由此可见,Na
1.7 功能获得性突变可能会损害生物能量学,针对生物能量负荷和线粒体损伤的治疗策略,值得在SFN 中进行研究。
Na
1.8 通道:Na
1.8 通道是TTX-R 钠通道,它是感觉神经元所特有的,其分布仅限于小直径DRG 伤害感受性神经元。在幼鼠中,50%的C 纤维和10%的Aδ 纤维表达Na
1.8 通道。神经损伤后,C 纤维和Aδ 纤维Na
1.8 通道表达增加,Na
1.8 从DRG 细胞体向轴突的分布、表达和/或生物物理特性发生变化,导致DRG 异常兴奋性发生(Abd El-Aziz 等. 2021)。通过基因缺失和反义寡核苷酸敲除Na
1.8 mRNA 靶向处理Na
1.8 钠通道的小鼠,表现出对伤害性热刺激反应降低并出现延迟的热痛觉过敏
。表明Na
1.8 的表达、转导和再分配发生改变是传入神经致敏和疼痛产生的主要因素,而Na
1.8 通道在伤害感受性神经元上的专一性分布使其成为疼痛治疗很有吸引力的靶点。
然而,在小鼠和人类研究中证实,疼痛状态并不全部依赖Na
1.7 的表达。在Na
1.7 缺失突变小鼠中,骨癌性疼痛和奥沙利铂诱发的触、冷诱发痛均正常发生。另一方面,携带与CIP 相关的SCN9A(Na
1.7 编码的基因表型)功能缺失突变的个体仍有可能发展为NP
。导致这些差异现象的可能机制尚不清楚,未来仍需进一步深入研究。
Na
1.7 与化疗药物诱导的周围神经病变 (chemotherapy-induced peripheral neuropathy, CIPN) 密切相关。最近Braden 等
报道了一种有效的Na
1.7选择性抑制剂:小分子化合物194,通过选择性抑制DRG 神经元中Na
1.7 电流,从而逆转NP 动物模型(选择性神经损伤和紫杉醇诱导的周围神经病变)的机械性痛觉超敏。重要的是,当与奥沙利铂合用时,194 可防止机械性痛觉超敏的发生。表明小分子化合物194 是一种强大的CIPN 抑制剂,在小鼠和大鼠使用多种抗肿瘤药物治疗期间,可以减轻NP 的痛觉超敏,且与抗肿瘤药物合用时,具有防止NP 发生的作用,这将给临床治疗CIPN 带来新的防治策略。
目前,国内城市轨道交通列车多采用MVB(多功能车辆总线)作为列车线及车辆线的通信介质。MVB是IEC 61375标准中定义的一种总线形式,主要用于列车内各子系统设备的互联。由于国内城市轨道交通列车多采用固定编组方式,基本不存在重联运营的工况,因此MVB总线既用作列车总线,也用作车辆总线。
Na
1.8 通道有两种突变与感觉神经元超敏相关:G1662S 和T790A,其通过降低电流阈值和增加触发频率,大大提高了DRG神经元的兴奋性(Xiao等. 2019)。SFN 可能与Na
1.8 功能获得性突变有关。该通道功能获得性突变可以使TTX-R 电流的开放通道阻断增强,导致SFN 中感觉表型的改变,有助于维持伤害性神经元的高兴奋性。而高选择性Na
1.8 通道阻滞剂药物A-803467,能显著降低大鼠DRG 内向电流,减少机械触发的脊髓背角广动力范围神经元异常放电及机械性异常疼痛
。
最近Wang 等
研究发现,天麻素 (gastrodin,GAS) 可减轻长春新碱诱导周围NP 的机械性和热痛觉超敏。GAS 通过抑制Na
1.7 和Na
1.8 通道的电流密度,加速Na
1.7 和Na
1.8 通道的失活过程,从而抑制神经元的超兴奋性。Western blot 和免疫荧光分析结果显示,GAS 可显著降低长春新碱处理大鼠DRG 神经元中Na
1.7 和Na
1.8 的过表达。这些结果揭示了DRG 神经元中Na
1.7 和Na
1.8 钠通道参与周围NP 的过程,拓宽了人们对于神经调节剂在NP 中复杂作用的认识。
Na
1.9 通道:Na
1.9 也是TTX-R 钠通道,优先表达于DRG 和三叉神经节 (trigeminal ganglion, TG)的伤害性神经元。Na
1.9 产生持久的、抗河豚毒素的电流,在激活和稳态失活之间有广泛的重叠,可以调节静息电位并使小的去极化放大。这些特性表明,Na
1.9 对初级伤害性神经元的电反应特性有显著影响。另外研究发现,在周围神经病变病人中,编码Na
1.9 通道的SCN11A 基因存在7 个不同的突变,其中两个突变 (I381T 和L1158P) 可导致动作电位阈值的降低,并增加了对阈上刺激的放电频率,从而使DRG 神经元的兴奋性增加
。
Na
1.9 通道在低温下仍能正常工作,在寒冷反应的感觉神经元中表现出增强的活动。该通道在伤害性寒冷刺激(0℃和5℃)的反应中,通过上调对寒冷反应的损伤感知神经元亚群,放大由冷转导器激活产生的阈下去极化,导致激活电位在Na
1.9 通道中受损。而Na
1.9 缺失的小鼠或通过基因敲除Na
1.9 的大鼠显示出冷痛阈值增加。编码Na
1.9 的SCN11A 基因突变与NP 痛觉超敏有关。Matsubara等
通过研究低温暴露 (4℃) SCN11A p.R222S 突变体 (R222S) 和野生型C57BL/6N (WT) 小鼠行为和生化表型的影响发现,在冷诱导的R222S 小鼠机械性异常痛模型中,与WT 小鼠相比,冷暴露的R222S 小鼠表现出更强的机械性和热痛觉超敏反应。对乙酰氨基酚 (250 mg/kg) 可显著减轻R222S 小鼠的机械性痛觉超敏。表明Na
1.9 的SCN11A p.R222S基因突变与小鼠冷诱导机械异常疼痛有关,冷诱导的R222S 小鼠机械性异常痛模型可作为一种评价研发Na
1.9 相关顽固性NP 镇痛药物效果的新方法。
单细胞RNA 测序 (scRNA-seq) 是一种非常有效的技术,它促进了人们对单细胞转录组的理解,以及对小鼠DRG 神经元细胞簇的识别。在体内,全细胞贴片记录加上单细胞实时PCR 可用于确定与神经元类型对应的细胞功能。Li 等
进行了高覆盖率的scRNA 测序,在每个神经元检测到(10950±1218)个基因,从而确定了DRG 神经元的10 种类型和14 种亚型,该研究不仅提供了单个神经元的转录组,而且还鉴定了神经元类型 (C1-C10)和亚型的不同标记基因,例如,C1 神经元用galanin (Gal) 标记,C2 用利钠肽B (Nppb) 标记,C3 用Th 标记,C4 用Mrgpr3 标记,C5 用Mrgprd 标记等。通过这些标记基因来预测DRG 神经元分型及其参与疼痛性疾病的可能机制,将为NP 的治疗提供新方向。
利用Stata14.0软件对面板数据进行随机效应和固定效应回归,估计结果如表4和表5所示。表4中模型以环境规制作为唯一自变量,表5中模型加入控制变量。模型1、模型5和模型2、模型6分别是采用本省环保系统实有人数作为环境规制变量的固定效应模型和随机效应模型;模型3、模型7和模型4、模型8分别是采用本省环保系统实有人数与全省人数比重作为环境规制变量的固定效应模型和随机效应模型。表5中所有模型整体上通过了显著性水平检验,说明模型设定合理;Hausman检验表明应当采用固定效应模型。
近年来,有关DRG 神经元VGCCs 调控的新的镇痛途径正在研究中。例如,脑衰反应调节蛋白2(collapsin response mediator protein 2, CRMP2) 是Cav2.2通道的一种调节肽。CRMP2 拮抗剂TAT-CBD3 可干扰CRMP2 与Cav2.2 的交互作用,并可强烈抑制Cav2.2 电流,减少NP 超敏反应啮齿动物模型的伤害行为
。
[43]Roger M. Smith, ed., Southeast Asia: Documents of Political Development and Change, Ithaca and London: Cornell University Press, 1974, pp.101-102.
2.瞬时受体电位
1958年7月15—17日涑水河流域普降暴雨,造成涑水河发生特大洪水,位于涑水河上游的吕庄水文站7月16日实测洪峰流量655 m3/s。而涑水河由于河道行洪能力不足,洪水在蓄滞洪区和伍姓湖大量蓄积,受此影响流域把口站张留庄水文站所测数据不能直接反映本次洪水的演进过程。为研究涑水河流域暴雨洪水时空分布规律,弥补水文实测资料的不足,特针对本次洪水作历史洪水调查。
4、变速后自由跳档。拖拉机运行中,变速后出现自由跳档现象,主要是拔叉轴槽磨损、拔叉弹簧变弱、连杆接头部分间隙过大所致。此时应采用修复定位槽、更换拔叉弹簧、缩小连杆接头间隙,挂档到位后便可确保正常变速。
TRPA (ankyin),TRPC (canonical),TRPM (melastatin),TRPML (mucolipin),TRPP (polycystin),TRPV(vanilloid)
。其中,TRPV、TRPA、TRPM 与NP相关,目前研究较多的是TRPV1 和TRPM8。
(1)TRPV1 通道:TRPV1 又称香草酸通道,是一种非选择性的高钙渗透性阳离子通道。它可以通过多种刺激,如化学物质(如辣椒素),有害热(> 43℃) 和酸中毒而被激活。主要表达于初级感觉神经元亚群,特别是薄髓鞘的A
纤维和无髓鞘的C 纤维
,包括肽类和非肽类。已知TRPV1 直接参与体温控制、热敏感、炎症和慢性疼痛的进展。TRPV1 在DRG 表达水平升高,导致DRG 局部释放炎性介质(如P 物质、CGRP、谷氨酸),并通过辣椒素和活性氧自由基的激活介导NP和神经毒性。
由于消费者对再制造产品的支付意愿不可能大于对新产品的支付意愿,且消费者对再制造产品的支付意愿不可能为负,所以有0<(θ+β)/γ<1。
在紫杉醇 (paclitaxel, PTX) 诱导的CIPN 中,Wang 等
通过大鼠腹腔注射PTX (2 mg·kg
·d
),当PTX 累积剂量达到8 mg/kg 时,Western blot 和免疫组化显示,腰椎DRG 和脊髓背角中TRPV1 的表达上调。而持续给予5 天的度洛西汀 (20 mg·kg
·d
)后可显著抑制PTX 相关的机械性和热痛觉超敏,明显改善PTX 诱导的DRG 和脊髓背角中TRPV1、CGRP 和P 物质的上调,并减少了PTX 诱导的脊髓胶质细胞激活和TNF-α 的表达。这些结果表明,TRPV1 在CIPN 中起重要作用,可通过下调TRPV1的表达来缓解NP,这也为将来研发新的TRPV1 拮抗剂提供了实验支持。
过度氧化应激和DRG 神经元Ca
内流与NP的病理生理学密切相关。Ca
通透性TRPV1 通道在DRG 高表达。通过大鼠DRG 神经元全细胞膜片钳研究发现
,还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH) 氧化酶和蛋白激酶C (PKC) 通过TRPM2和TRPV1 对Ca
内流的起作用。另一项研究中发现
,甘氨酸乙酯对氧化神经毒性具有多种抗氧化保护作用,包括下调TRPV1 活性,减少链脲佐菌素诱导糖尿病性神经病理性疼痛 (diabetic neuropathic pain, DNP) 的DRG 凋亡、线粒体氧自由基、脂质过氧化,并减少TRPV1 电流密度、谷胱甘肽 (GSH)和细胞内游离Zn
和Ca
浓度。TRPV1 通道也可以通过上游药物调节进行靶向治疗,如通过拮抗血管紧张素II 型受体 (AT
R),阻断DRG 中TRPV1 通道的磷酸化来产生镇痛作用
。
(2)TRPM8 通道:TRPM8 是低温环境的主要探测器,最初通过克隆表达鉴定其为冷却剂薄荷醇的受体。在小直径到中等直径DRG 或TG 的感觉神经元中表达,支配皮肤、眼睛和角膜。TRPM8 的基因缺失大大降低了小鼠区分寒冷和温暖表面的能力,这些动物在各种模型中表现出较低的冷异常痛(23~28℃),它们的感觉神经元对降温的反应明显减弱
。
新一代鞘内镇痛药物齐考诺肽靶向作用于N 型VGCCs,可抑制痛觉传入神经递质释放,阻断疼痛传递,将为重度癌性疼痛及顽固性NP 提供另一种选择
。目前齐考诺肽在国外应用较多,仍需进一步评估其临床应用策略,以提高其治疗效果和病人的耐受性。
TRPM8 参与铂类化疗药物(如奥沙利铂)诱导的CIPN,该类病人主要表现为冷痛觉超敏。直接阻断TRPM8 具有显著的镇痛作用,但也会引起低温等严重不良反应。Aierken 等
采用优化的热点中心方法从头测序设计了环肽DeC-1.2,DeC-1.2模式特异性抑制TRPM8 的配体激活,但不抑制单通道膜片钳记录中测得的冷激活,使其在不改变体温的情况下消除奥沙利铂治疗小鼠的冷痛觉超敏。虽然TRPM8 拮抗剂对于人体核心温度没有明显影响,但在不良反应(一种不耐受的,局限于口、脸、上半身、手臂和手的热感觉)和疗效之间缺乏治疗指标,以及在人体内半衰期较短,限制了其进一步临床发展,TRPM8 拮抗剂在冷痛觉超敏NP 中的作用尚有待进一步研究。
2021 年度诺贝尔生理学或医学奖获得者美国生理学家David Julies 与亚美尼亚裔美国神经科学家Ardem Patapoutian 发现了在DRG 高表达的温度感受器 (TRPV1 和TRPM8) 和触觉感受器 (Piezo)
,首次整合了痛觉和温度感知的内在分子机制,为人们理解热觉、冷觉和机械刺激感知的形成及探究感知觉和其他病理生理性疾病的内在联系奠定了基础,并将成为人类研发包括NP 在内的多种疾病治疗新方法的里程碑。
1.2.7 数据分析方法 用SPSS 16.0统计分析软件对数据进行处理,结合方差对实验数据进行分析。
3.嘌呤P2X 受体
嘌呤受体分为两种:离子通道型和G 蛋白偶联型 (P2X 和P2Y) 受体。P2X 受体家族是腺嘌呤核苷三磷酸 (adenosine triphosphate, ATP) 配体门控的非选择性阳离子通道,在脊髓背角和DRG 神经元中表达,通过与ATP 结合而被激活,触发细胞膜上离子通道的开放(Ca
、Na
内流,K
外流),从而发挥生物学效应,它也是DRG 神经元和卫星胶质细胞之间双向作用的关键元素。目前在哺乳动物和其他脊椎动物中克隆出P2X 共7 种亚型:P2X1-7。研究证实,不同类型的疼痛与DRG 表达P2X 嘌呤受体的激活有关
,其中与NP 密切相关的P2X 亚型受到广泛关注。
可是,没想到,老秦有过一段婚姻,因为感情不合离了。女儿判给了他,还不满一岁。乡下教师的工资很低,老秦把老乡做的扫把买来去桂林卖,搭生活用。这让我想起小时候挑柴火卖。有时候,他还用摩托车搭客人到山里来玩儿,能挣十几块。但这个活儿比较稀有。摩托车是借钱买的,债还没还完。
(1)P2X3 受体:P2X3 受体高选择性大量地表达于DRG 中小直径神经元上,广泛参与疼痛信号产生、传导和疼痛敏化调制,在NP 中起着重要作用。He 等
研究表明,DRG 中P2X3 的上调在链脲佐菌素 (STZ) 诱导的DNP 中发挥作用。随后,他们对可能的机制做了进一步研究。Western blot 结果显示,DNP 大鼠DRG 中p-CaMKIIα 水平升高,伴有疼痛相关行为。免疫荧光显示,p-CaMKIIα 与P2X3 共表达。应用CaMKII 拮抗剂KN93 能显著减轻DNP大鼠的机械性痛敏和热痛敏,且这些作用呈剂量依赖性。表明DRG 中P2X3 可能通过介导p-CaMKIIα的上调参与DNP 的发病机制,这一研究发现揭示了CaMKIIα 可能是DNP 治疗的有效靶点。
(2)P2X7 受体:P2X7 受体对ATP 的亲和力较低,同聚体激活需要较高浓度的ATP (> 100 μmol/L),该浓度大约是ATP 激活其他P2X 受体亚型的10 倍。已有大量研究证实P2X7 受体在NP 中起重要作用。在水痘-带状疱疹病毒 (VZV) 感染的CV-1 细胞诱导PHN 模型中
,PHN 大鼠的机械缩足反射阈值降低,P2X7 在神经组织中表达升高,内质网应激被激活。同时,半胱天冬氨酸酶-1 (Caspase-1)、NOD样受体蛋白3 (NLRP3)、IL-1β 和IL-18 上调,导致PHN 大鼠细胞焦亡增加。给予P2X7 拮抗剂BBG可提高PHN 大鼠痛阈,减轻内质网应激和细胞焦亡,从而缓解PHN。虽然,目前尚未明确P2X 特异性拮抗剂以何种信号通路阻断pannexin 1 通道打开并释放ATP,减弱DRG 的后期反应,但P2X7-pannexin 1-P2X 受体/通道诱导自分泌或旁分泌ATP释放(Schimid 等. 2019),在NP 感觉传导通路中扮演重要角色,DRG 靶向功能性P2X 受体可能是一种重要的疼痛调节新策略。
瞬时受体电位 (TRP) 是一种非选择性阳离子通道,通常被称为“生物传感器”,用于感知多种生理功能,包括视觉、听觉、味觉、热感觉,并用来检测周围环境和细胞状态的变化。事实上,TRP 通道构成了哺乳动物痛觉中最大的伤害性离子通道组,在序列同源性基础上,TRP 家族分成6 个亚型:
4. DGR 卫星胶质细胞
室温下,分别用超纯水配制50 mL质量浓度为200 ng·L-1的HHCB和AHTN溶液,FeSO4投加量为 400 μmol·L-1,分别投入不同用量的 H2O2,使Fe2+/H2O2摩尔比分别为1/5、1/4、1/3、1/2、1、2,反应时间为60 min。不同Fe2+/H2O2摩尔比下HHCB和AHTN的去除率如图8所示。
在DRG 培养中,神经元被辣椒素激活并释放ATP,从而激活P2X7 受体诱导SGCs 周围的钙瞬变,随后SGCs 被激活。SGCs 的激活可能反过来影响邻近神经元,从而参与感觉神经节的信号处理和传递。外周神经损伤增加了SGCs之间缝隙连接的发生率,一氧化氮 (NO) 作为细胞间信使作用于SGCs,刺激环磷酸鸟苷 (cGMP) 的合成,导致DRG 神经元的高兴奋性和疼痛
。
DRG 中SGCs 主要表达电压依赖性钾 (K
) 通道,包括内向整流钾通道 (Kir)、电压依赖性外向钾通道和小电导Ca
激活的SK3 通道,其中Kir4.1是决定SGCs 内静息膜电位的主要离子通道。炎症或神经压迫损伤后,Kir4.1 介导的SGCs 电流明显减少,提示损伤后Kir4.1 表达下降降低了SGCs 对K
缓冲能力,提高了神经元附近的细胞外K
浓度,使神经元去极化和过度兴奋,从而导致NP
。
近几年,关于SGCs 中Cx43 在维持NP 痛觉敏化状态的研究越来越受到关注。在高迁移率族蛋白-1 (HMGB-1) 诱导的NP 机械性痛觉超敏反应模型中发现,HMGB-1 可增加小鼠原代SGCs 中toll样受体4 (TLR-4) 和Cx43 的表达,并通过JNK 信号通路调节Cx43(Liu 等. 2020)。由此可知,通过TLR-4/JNK 信号通路调节SGCs 中Cx43,是HMGB-1诱导NP机械性疼痛超敏反应的可能机制。由于人类与动物的SGCs 有一定差异,人类一个SGCs 大约有200 万的突触,因此,在人体SGCs 中Cx43 参与NP 痛觉敏化的作用更为复杂,需要进一步探索。
三、DRG 新认识
1. DRG 解剖进展
(2)电压门控钙通道 (voltage-gated calcium channels, VGCCs): DRG 神经元细胞膜大量表达VGCCs。VGCCs 通过电压门控钙离子 (Ca
) 内向电流或Ca
敏感K
通道产生外向电流来调节DRG神经元的兴奋性。VGCCs 分为两类:高电压激活型,即L、N、P/Q 和R 型;低电压激活型,也称为T 型。NP 以DRG 致敏和高兴奋为特征,可能机制与神经损伤和随后的炎症反应致N型和T型钙通道的上调,Ca
内流触发突触前囊泡释放兴奋性神经递质增加有关,通过选择性作用于VGCCs 的特定亚型,抑制Ca
内流,降低NP 中DRG 的高兴奋性,减少脊髓背角及中枢敏化(Alles 等. 2021)。Kang 等
研究发现,在选择性神经损伤 (spared nerve injury,SNI) 模型受损的中等直径DRG 神经元中,VGCCs中的Cav3.2 蛋白表达增加,而未受损DRG 中,Cav3.2 蛋白表达未增加。采用全细胞膜片钳记录技术,在膜电位为-85 mV 和-95 mV 时,受损的中等直径DRG 神经元去极化后振幅显著增加。表明在中等直径的神经元损伤后,Cav3.2 T 型钙通道的功能上调。在行为学上,反义寡核苷酸阻断Cav3.2 可以显著逆转机械异常疼痛。这些结果提示,受损的中等直径DRG 神经元中的Cav3.2 T 型钙通道可能与周围神经损伤后的NP 有关。
除了DRG,TG 也是慢性疼痛状态的关键驱动因素,两者虽然在功能上具有高度的相似性,但在发育谱系与中枢神经系统的功能连接方面存在重要差异。采用全基因组分析表明
,TG 和DRG 具有一些独特的基因组特征。通过对雄性和雌性小鼠TG 和DRG 中SCN10A 阳性伤害感受器的mRNA 进行了全面表征和比较后发现,雷帕霉素 (mTOR) 相关基因的机械靶点在TG 中的翻译效率高于DRG,而与mTOR 负调节因子单磷酸腺苷(AMP) 活化蛋白激酶相关的基因在DRG 中的翻译效率更高;TG 对辣椒素的致敏刺激反应更大,且在mTOR 抑制下完全可逆。这些数据提供了TG 和DRG 痛觉感受器中转录组和翻译组活动的比较视图,从而增强了我们对痛觉感受器生物学的理解。
2.细胞研究
以细胞为基础的治疗为NP 带来了新的希望。间充质干细胞 (mesenchymal stem cells, MSCs) 可通过基因工程获得,并且它们分泌的治疗性多肽功能强大。Yu 等
在脊神经结扎大鼠NP 模型中,将基因工程骨髓MSCs 注射到大鼠L
和L
DRG 中,可以有效缓解大鼠的机械性疼痛和痛觉过敏,显示了靶向DRG 的MSCs 给药方法具有组织特异性、减少全身不良反应和移植细胞总负荷小的优点,表明MSCs 作为NP 治疗新策略的可能性。
最近科学家从成人外周神经中分离出新的外周神经源性干细胞 (PNSCs)(Lee 等. 2021),这种PNSCs 通过释放多种神经营养因子显示出强大的治疗潜力,这些神经营养因子包括:胶质细胞源性神经营养因子、胰岛素样生长因子、神经生长因子和神经营养因子-3。与非球形PNSCs 相比,球形PNSCs 分泌数倍于非球形PNSCs 的神经营养因子,并表达多种类型的细胞外基质。在动物脊髓损伤模型中,这些球形PNSC 可诱导神经元再生和功能恢复,并减轻脊髓损伤再髓鞘化后伴随的NP。这些球形PNSCs 可能代表了脊髓损伤后NP 的一种崭新的治疗方法。
采用SPSS11.5软件包用于统计分析,等级资料的比较采用Ridit检验,对分级数据进行比较,P<0.05为差异有统计学意义。
3.基因研究
近些年的科学研究见证了DRG 疼痛基因治疗的发展,DRG 介导的疼痛已经成为基因治疗转化应用的靶标。最常用的方法是在DRG 中,通过病毒载体用治疗性DNA 替换病毒DNA 的复制部分进行遗传基因转移,治疗性DNA 一旦进入宿主细胞,就被翻译成感兴趣的蛋白质,从而实现病毒基因组的修改。这些病毒载体包括:基于非病毒质粒的基因转移载体、腺病毒、腺相关病毒 (AAV) 和基于逆转录病毒的基因转移系统。在啮齿类动物模型中,辅助依赖腺病毒载体已被证明可以有效地在体内转导DRG 神经元,并可直接靶向到DRG 多肽。该载体在基因敲除小鼠感觉缺陷综合征模型中展示其实用性,可在不影响中枢神经系统或运动系统的情况下,改善基因受损DRG 的感觉功能(Ogawa 等.2018)。将miR-7a 的microRNA 通过AAV 载体转染到受损DRG 神经元中,miR-7a 的过表达抑制了VGSCs β2 亚基表达的增加,使痛觉神经元的长期高兴奋性趋于正常化(Sakai 等. 2013)。表明将慢病毒载体靶基因导入DRG 探索NP 机制和治疗的研究中,miR-7a 的补充可能为NP 提供了一种新的治疗策略。
通过加权基因共表达网络分析
,将DRG 神经元分为不同的亚型,发现了共同调控的损伤反应基因,包括与神经元发育、蛋白质翻译和细胞质运输相关的新再生相关基因,从而揭示了在单个神经元水平上mRNA 转录组反应的独特性和持续异质性,表明不同基因调控网络参与了DRG 神经元的再生、细胞凋亡和神经性病变。
小干扰RNA (siRNA) 方法也被用于靶向DRG介导的疼痛。siRNA 干扰互补基因序列的表达,阻止蛋白质翻译,限制了阿片类药物在NP 状态下的有效性,而通过鞘内注射Rab7-siRNA 可沉默Rab7介导的溶酶体,可恢复阿片受体对阿片的反应性,使之成为一种潜在的有吸引力的辅助治疗
。
4.遗传学研究
随着表观遗传学 (epigenetics) 研究的不断推进,确定了DNA 甲基化、组蛋白修饰(包括甲基化、乙酰化和泛素化)、和非编码RNA 在NP 的发生及维持中发挥重要作用
。DNA 甲基转移酶 (DNMT)触发的DNA 甲基化可沉默基因表达。周围神经损伤通过转录因子环磷酸腺苷 (cAMP) 反应元件结合蛋白触发DNMT1 基因的转录激活,使受损DRG中DNMT1 的表达上调。这种上调导致电压门控钾通道Kcna2 基因启动子和5'非编码区内由神经损伤诱导的DNA 甲基化,使Kcna2 表达降低,K
电流减少,受损DRG 神经元异常放电,最终引起NP 的发生。通过基因敲除或药物抑制DNMT1 可有效减轻NP 的痛觉超敏反应
。
L-乙酰肉碱 (L-acetylcarnitine, LAC) 可使DRG中Grm2 基因启动子结合位点乙酰化组蛋白H3 水平升高,Notartomaso 等
通过表观遗传进一步上调脊髓中2 型代谢型谷氨酸 (mGlu2) 受体表达,从而产生镇痛作用,此镇痛效果比普瑞巴林、曲马多治疗的小鼠作用更持久。这可能与LAC 促进组蛋白H3 乙酰化,进而增强Grm2 基因启动子的转录活性有关。
非编码RNA (ncRNAs),包括微小RNAs (miRNA)、长链非编码RNA (lncRNA)和环状RNA (circRNA),通过在转录后水平调控与疼痛通路相关的各种mRNA 的表达,参与多种生物学过程。Hu 等
在脊髓神经结扎 (spinal nerve ligation, SNL) 诱导的NP 中,miRNAs-30b 可以直接靶向SCN3A 3'非编码区,通过抑制DRG 神经元和脊髓中VGSCs 中Na
1.3 的表达来缓解NP。同样在SNL 模型中 (Hu等. 2019),lncRNA 和PKIA-AS1 显著上调,而抑制PKIA-AS1 可减缓NP 的进展。此外,PKIA-AS1的过度表达可显著诱导未受伤大鼠出现NP样症状,其通过调节细胞周期蛋白依赖性激酶6 (cyclin dependent kinase 6, CDK6) 的表达和功能来发挥作用。因此,PKIA-AS1 有望成为NP 相关神经炎症的新治疗靶点。以上研究表明,ncRNAs 的异常调控与NP 的发生发展密切相关,了解这些机制有助于通过表观基因重编程开发新的治疗策略来预防或治疗NP。
近十年来光遗传学 (optogenetics) 技术在科学研究领域得到了迅猛发展。光遗传学技术利用光敏感蛋白来控制细胞信号动力学和靶基因表达,这些光敏感蛋白包括:绿光驱动的细菌视紫红质、蓝光驱动的视紫红质及黄光驱动的嗜盐菌紫红质等,并凭借对光照硬件的精确控制,使其与传统的电生理刺激和药理学刺激相比,具有明显优势,如高度时空特异性、灵敏性更好、毒性低、精准快速、高度可逆等,通过不断改变光照的波长及光脉冲强度,来精准调控细胞、组织乃至器官的生物学反应。随着在体内暴露和注射单个DRG 神经元示踪剂或病毒成为可能,意味着可通过光遗传学的激发光照射调节单个DRG 内表达特定表型光敏感蛋白的神经元活动,进而控制细胞甚至动物行为的开启或关闭 (Zhu 等. 2022)。近期一项研究显示
,在单个DRG 上表达光敏感视蛋白,然后将微型发光二极管 (micro LED) 植入感兴趣的DRG 附近,从而实现对清醒小鼠的内脏和躯体传入局灶性DRG 的特异性控制,揭示了光遗传学研究方法具有良好的效能和广阔的应用前景,对疼痛基础研究和转化医学研究具有重要指导意义。
四、小结
对DRG 的解剖细节及特有的或者主要在DRG上表达的分子及通道的认识,为疼痛药物靶点的选择提供新的潜在思路。DRG 靶向给药的动物模型可提供足够的特异性,在疼痛研究中是一个很有价值的工具。如何将动物实验研究进行有效的临床转化,对NP 病人群体,尤其是年老体弱的人群开展有效的DRG 靶向镇痛,从而避免全身用药所产生的不良反应具有重要意义。随着单DRG 水平持续输注和使用病毒载体进行基因传递新技术的发展,单DRG 水平局部治疗将成为给药方法的新途径。在未来的研究中,对从胸、腰或骶区分离的DRG 神经元进行基因测序,可能会揭示基因表达的解剖学指纹,探寻与其相关疾病之间紧密的遗传关系,也将有助于确定最有价值的治疗靶点。
利益冲突声明:作者声明本文无利益冲突。
[1] Attal N, Bouhassira D. Advances in the treatment of neuropathic pain[J]. Curr Opin Neurol, 2021, 34(5):631-637.
[2] Bannister K, Sachau J, Baron R,
. Neuropathic pain: mechanism-based therapeutics[J]. Annu Rev Pharmacol Toxicol, 2020, 60:257-274.
[3] Leng L, Liu L, Si D. Morphological anatomy of thoracolumbar nerve roots and dorsal root ganglia[J].Eur J Orthop Surg Traumatol, 2018, 28(2):171-176.
[4] Djouhri L, Zeidan A, Alzoghaibi M,
. L
spinal nerve axotomy induces distinct electrophysiological changes in axotomized L
and adjacent L
dorsal root ganglion neurons in rats in vivo[J]. J Neurotrauma,2021, 38(3):330-341.
[5] Hong SW, Kim MJ, Park CH,
. Dorsal root ganglion stimulation combined with spinal cord stimulation for effective treatment of postherpetic neuralgia-a case report[J]. Anesth Pain Med (Seoul), 2021, 16(4):387-390.
[6] Fei Y, Huang B, Deng J,
. Efficacy of dorsal root ganglion pulsed radiofrequency combined with paravertebral injection of recombinant human interferon-α2b in herpetic neuralgia[J]. Pain Res, 2021,14: 711-719.
[7] Shen J, Wang HY, Chen JY,
. Morphologic analysis of normal human lumbar dorsal root ganglion by 3D MR imaging[J]. AJNR Am J Neuroradiol, 2006,27(10):2098-2103.
[8] Macone A, Otis JAD. Neuropathic pain[J]. Semin Neurol, 2018, 38(6):644-653.
[9] Meltzer S, Santiago C, Sharma N,
. The cellular and molecular basis of somatosensory neuron development[J]. Neuron, 2021, 109(23):3736-3757.
[10] Chiu IM, Barrett LB, Williams EK,
. Transcriptional profiling at whole population and single cell levels reveals somatosensory neuron molecular diversity[J].Elife, 2014, 3: e04660.
[11] Ma RSY, Kayani K, Whyte-Oshodi D,
. Voltage gated sodium channels as therapeutic targets for chronic pain [J]. Pain Res, 2019, 12: 2709-2722.
[12] Emery EC, Luiz AP, Wood JN. Na
1.7 and other voltage-gated sodium channels as drug targets for pain relief[J]. Expert Opin Ther Targets, 2016, 20(8):975-983.
[13] Fertleman CR, Baker MD, Parker KA,
. SCN9A The primary erythermalgia-susceptibility gene is located on chromosome 2q31-32mutations in paroxysmal extreme pain disorder: allelic variants underlie distinct channel defects and phenotypes[J]. Neuron, 2006, 52(5):767-774.
[14] Lee SI, Hoeijmakers JGJ, Faber CG,
. The small fiber neuropathy Na
1.7 I228M mutation: impaired neurite integrity via bioenergetic and mitotoxic mechanisms, and protection by dexpramipexole[J].Neurophysiol, 2020, 123(2):645-657.
[15] Braden K, Stratton HJ, Salvemini D,
. Small molecule targeting Na
1.7 via inhibition of the CRMP2-Ubc9 interaction reduces and prevents pain chronification in a mouse model of oxaliplatin-induced neuropathic pain[J].Neurobiol Pain, 2021, 11:100082.
[16] Minett MS, Falk S, Santana-Varela S,
. Pain without nociceptors? Na
1.7-independent pain mechanisms[J].Cell Rep, 2014, 6(2):301-312.
[17] Joshi SK, Mikusa JP, Hernandez G,
. Involvement of the TTX-resistant sodium channel Na
1.8 in inflammatory and neuropathic, but not post-operative,pain states[J]. Pain, 2006, 123(1-2):75-82.
[18] Xiao Y, Barbosa C, Pei Z,
. Increased resurgent sodium currents in Na
1.8 contribute to nociceptive sensory neuron hyperexcitability associated with peripheral neuropathies[J]. Neurosci, 2019, 39(8):1539-1550.
[19] Wang X, Zhang B, Li X,
. Mechanisms underlying Gastrodin alleviating vincristine-induced peripheral neuropathic pain[J]. Front Pharmacol, 2021, 12:744663.
[20] Huang J, Han C, Estacion M,
. Gain-of-function mutations in sodium channel Na
1.9 in painful neuropathy[J]. Brain, 2014, 137(6):1627-1642.
[21] Matsubara Y, Okuda H, Harada KH,
. Mechanical allodynia triggered by cold exposure in mice with the SCN11A p.R222S mutation: a novel model of drug therapy for neuropathic pain related to Na
1.9[J].Naunyn Schmiedebergs Arch Pharmacol, 2021, 394(2):299-306.
[22] Kang XJ, Chi YN, Chen W,
. Increased expression of Cav3.2 T-type calcium channels in damaged DRG neurons contributes to neuropathic pain in rats with spared nerve injury[J]. Mol Pain, 2018, 14:1744806918765808.
[23] McDowell GC, Saulino MF, Wallace M,
.Effectiveness and safety of intrathecal ziconotide: final results of the patient registry of intrathecal ziconotide management (PRIZM)[J]. Pain Med, 2020, 21(11):2925-2938.
[24] Feldman P, Khanna R. Challenging the catechism of therapeutics for chronic neuropathic pain: Targeting Cav2.2 interactions with CRMP2 peptides[J]. Neurosci Lett, 2013, 557:27-36.
[25] Watanabe M, Ueda T, Shibata Y,
. The role of TRPV1 channels in carrageenan-induced mechanical hyperalgesia in mice[J]. Neuroreport, 2015, 26(3):173-178.
[26] Viana F. Nociceptors: thermal allodynia and thermal pain[J]. Handb Clin Neurol, 2018, 156:103-119.
[27] Wang J, Zhou F, Zhang S,
. Participation of transient receptor potential vanilloid 1 in the analgesic effect of duloxetine for paclitaxel induced peripheral neuropathic pain[J]. Neurosci Lett, 2022,773:136512.
[28] Nazıroğlu M. Activation of TRPM2 and TRPV1 channels in dorsal root ganglion by NADPH oxidase and protein kinase C molecular pathways: a patch clamp study[J]. Mol Neurosci, 2017, 61(3):425-435.
[29] Düzova H, Nazıroğlu M, Çiğ B,
. Noopept attenuates diabetes-mediated neuropathic pain and oxidative hippocampal neurotoxicity via inhibition of TRPV1 channel in rats[J]. Mol Neurobiol, 2021, 58(10):5031-5051.
[30] Khan N, Muralidharan A, Smith MT. Attenuation of the infiltration of Angiotensin II expressing CD3
T-cells and the modulation of nerve growth factor in lumbar dorsal root ganglia-a possible mechanism underpinning analgesia produced by EMA300, an angiotensin II type 2 (AT
) receptor antagonist[J]. Front Mol Neurosci,2017, 10:389.
[31] Izquierdo C, Martín-Martínez M, Gómez-Monterrey I,
.TRPM8 channels: advances in structural studies and pharmacological modulation[J]. Int J Mol Sci, 2021,22(16):8502.
[32] Aierken A, Xie YK, Dong W,
. Rational design of a modality-specific inhibitor of TRPM8 channel against Oxaliplatin-induced cold allodynia[J]. Adv Sci (Weinh),2021, 8(22): e2101717.
[33] 孙小砚, 刘风雨, 万有. 2021 年诺贝尔生理学或医学奖颁给发现“温度和触觉感受器”的科学家[J].中国疼痛医学杂志, 2021, 27(10):731-732, 736.
[34] Bernier LP, Ase AR, Séguéla P. P2X receptor channels in chronic pain pathways[J]. Br J Pharmacol, 2018,175(12):2219-2230.
[35] He XF, Kang YR, Fei XY,
. Inhibition of phosphorylated calcium/calmodulin-dependent protein kinase IIα relieves streptozotocin-induced diabetic neuropathic pain through regulation of P2X3 receptor in dorsal root ganglia[J]. Purinergic Signal, 2022. doi: 10.1007/s11302-021-09829-z.
[36] Zhu Y, Zhang S, Wu Y,
. P2X7 receptor antagonist BBG inhibits endoplasmic reticulum stress and pyroptosis to alleviate postherpetic neuralgia[J]. Mol Cell Biochem, 2021, 476(9):3461-3468.
[37] Wang D, Lu J, Xu X,
. Satellite glial cells give rise to nociceptive sensory neurons[J]. Stem Cell Rev Rep,2021, 17(3):999-1013.
[38] Lemes JBP, de Campos Lima T, Santos DO,
. Participation of satellite glial cells of the dorsal root ganglia in acute nociception[J]. Neurosci Lett, 2018, 676:8-12.
[39] Tang X, Schmidt TM, Perez-Leighton CE,
. Inwardly rectifying potassium channel Kir4.1 is responsible for the native inward potassium conductance of satellite glial cells in sensory ganglia[J]. Neuroscience,2010, 166(2):397-407.
[40] Li CL, Li KC, Wu D,
. Somatosensory neuron types identified by high-coverage single-cell RNA-sequencing and functional heterogeneity[J]. Cell Res,2016, 26(1):83-102.
[41] Megat S, Ray PR, Tavares-Ferreira D,
. Differences between dorsal root and trigeminal ganglion nociceptors in ice revealed by translational profiling[J]. Neurosci, 2019, 39(35):6829-6847.
[42] Yu H, Fischer G, Ebert AD,
. Analgesia for neuropathic pain by dorsal root ganglion transplantation of genetically engineered mesenchymal stem cells: initial results[J]. Mol Pain, 2015, 11:5.
[43] Sharma N, Flaherty K, Lezgiyeva K,
. The emergence of transcriptional identity in somatosensory neurons[J]. Nature, 2020, 577(7790):392-398.
[44] Mousa SA, Shaqura M, Khalefa BI,
. Rab7 silencing prevents μ-opioid receptor lysosomal targeting and rescues opioid responsiveness to strengthen diabetic neuropathic pain therapy[J]. Diabetes, 2013,62(4):1308-1319.
[45] 王琳,刘雪,刘冰清,等.神经病理性疼痛的表观遗传学研究进展[J].中国疼痛医学杂志, 2020, 26(4):287-290.
[46] Sun L, Gu X, Pan Z,
. Contribution of DNMT
to neuropathic pain genesis partially through epigenetically repressing
in primary afferent neurons[J].Neurosci, 2019, 39(33):6595-6607.
[47] Notartomaso S, Mascio G, Bernabucci M,
. Analgesia induced by the epigenetic drug, L-acetylcarnitine,outlasts the end of treatment in mouse models of chronic inflammatory and neuropathic pain[J]. Mol Pain,2017, 13:1744806917697009.
[48] Hu C, He M, Xu Q,
. Advances with non-coding RNAs in neuropathic pain [J]. Front Neurosci, 2021,15: 760936.
[49] Spencer NJ, Hibberd TJ, Lagerström M,
. Visceral pain-Novel approaches for optogenetic control of spinal afferents[J]. Brain Res, 2018, 1693(Pt B):159-164.
