神经源性炎症痛的分子机制及研究进展*
2022-07-28孙建梅刘彤彤唐宗湘
神经源性炎症痛是由于神经源性炎症敏化了外周和中枢的伤害性神经末梢而导致的疼痛。组织损伤或传入神经纤维自身受损后,可引起内源性炎性物质释放,包括前列腺素、5-HT、P 物质、降钙素基因相关肽 (calcitonin gene related peptide, CGRP)、脑源性神经营养因子 (brain derived neurotrophic factor,BDNF)、腺苷、缓激肽等,这些炎性物质作用到痛觉相关受体,从而导致疼痛。本文综述了近年来发生在外周组织的外周神经源性炎症痛和发生在中枢神经系统的中枢神经源性炎症痛的主要研究成果,以及一些神经源性炎症痛疾病,例如骨关节炎、复杂性区域疼痛综合征、偏头痛、肌痛、癌痛、皮炎、细菌病毒感染和代谢类疾病等。
(1)四种中心锥结构水力旋流器内压力场与速度场均呈轴对称分布。适当的减小上锥段底角能增大径向压力梯度和最大切向速度,有利于固液分离从而提高分离效率。
一、神经源性炎症痛的定义
1.神经源性炎症痛“概念”的形成
“神经源性炎症”的术语最早是由Jancsó 提出的,用以描述感觉神经受到局部刺激物刺激时,皮肤和黏膜中发生的血管通透性增加、血浆外渗和组织肿胀症状,首次将炎症的发生与神经系统的损伤关联了起来。20 世纪50 年代,Jancsó 又发现,辣椒素敏感的感觉神经末梢被化学物质刺激后能够释放导致血管扩张和通透性增加的“神经介质”,研究者将感觉神经末梢受刺激后促进血管扩张的这一现象统称为神经源性炎症反应
。随着研究的不断深入,研究者发现这种能促进血管活性增加的“神经介质”是包括速激肽、P 物质、神经激动素A (NKA)和CGRP 在内的神经肽,这些由感觉神经元释放的神经肽能够引起血浆外渗和组织肿胀等炎症反应
。这种由神经元受刺激释放神经肽直接引起外周炎症反应的现象被定义为神经源性炎症。
神经源性炎症的表现最初在皮肤中发现,因此,过去研究中神经源性炎症术语均指外周组织神经源性炎症,即神经肽从感觉神经元的外周轴突末端直接释放以产生血管扩张、水肿和其他炎症表现的过程。感觉神经元的轴突末端释放神经肽可归因于神经末梢的直接兴奋,或背根神经节、三叉神经节及结状神经节的轴突反射对轴突“逆向刺激”。在这些感觉神经元中,细胞体直径较小的神经元和传导伤害性感受的无髓C 类纤维在神经源性炎症的发生中起关键作用
。
近年来对于神经源性炎症的研究不再限制于外周组织,除了外周组织神经源性炎症外,神经元活动在中枢神经系统中也能够引发炎症,这一现象被称为中枢神经系统的神经源性炎症,也被直接称为“神经源性神经炎”。与外周一样,中枢神经系统中的神经元突触会释放出类似外周神经元释放的神经肽类物质来响应神经元的活动,如肽能初级传入C 纤维的激活可导致包括谷氨酸、P 物质、CGRP、BDNF 和ATP 在内的各种炎症介质的释放,这些神经递质和神经肽与存在于神经系统附近的免疫细胞、血管细胞和临近其他中枢神经元上的受体结合,导致血管扩张、血管通透性增加等炎症反应
。
各种伤害性刺激,如直接电刺激神经或瞬时受体电位香草酸受体1 (transient receptor potential vanilloid 1, TRPV1) 通道,都会引起C 纤维(无髓伤害性神经纤维)的兴奋,导致神经源性炎症。C纤维兴奋所产生的动作电位逆向传导至C 纤维的外周末端,进而使其释放P 物质、CGRP 和神经肽Y 等神经肽,这些物质的释放会迅速影响包括血管细胞、肥大细胞、巨噬细胞在内的各类细胞开始释放炎性介质,创造出“炎症环境”,从而引发组织炎症。比如,肥大细胞会迅速脱颗粒并释放包括细胞因子、前列腺素、5-羟色胺和组胺等在内的物质。组织炎症反应主要包括血管扩张、血浆外渗和白细胞募集。此外,伤害性感受器神经元末梢在各种炎性介质的影响下兴奋,从而导致疼痛
。神经元活动增强触发周围组织神经源性炎症的途径如下(见图1)。
由于神经源性炎症痛最初在皮肤组织中被发现,早期的神经源性疼痛研究主要集中在皮肤,但随着近年来研究的拓展和深入,神经源性炎症痛在包括周围神经、软组织、关节、气道、眼睛、牙龈、脑膜、胰腺和内脏等多个组织和器官中也被发现,在多种以疼痛为主要症状的疾病研究中(如组织损伤、术后疼痛、肌肉痛、偏头痛等),神经源性炎症是疼痛的主要触发机制,或可能放大疾病状态。因此,研究人员也逐渐将目光聚焦到了这一共同的发病原因上,研究神经源性炎症的发生发展,并试图寻找缓解各种相关疾病疼痛症状的潜在靶点
。
对于神经源性炎症痛的研究较为复杂,临床上伴发疾病较多且种类不同,神经源性炎症的产生是多种以疼痛为主要临床表现的疾病触发机制
,如组织损伤、偏头痛、细菌病毒感染、癌痛、代谢类疾病等
。因为涉及多种不同类型疾病的发病机制,对于神经源性炎症痛的独立研究仍缺乏系统性,因此,整理神经源性炎症痛的发病机制、并发症状及诊断治疗方法,既能为研究神经源性炎症痛的基础研究人员和相关的临床工作者提供参考,同时也为相关疾病药物研发和不同疾病治疗方法提供借鉴。
2.神经源性炎症痛的其他临床症状
疼痛是神经源性炎症痛的重要临床症状,除此之外,神经源性炎症还具有 “红、热、肿”三个主要特征。①红热:以肢端发凉或发红,少汗或多汗、角化增强等自主神经的功能障碍;②肿胀:疼痛部位出现肿胀,以指端、趾端出现灼烧样疼痛、麻木,并出现感觉减退甚至“手套式感觉丧失(glove anesthesia)”为主要症状的感觉障碍;③功能丧失:以肌力减退、肌张力下降、腱反射减弱或消失及肌萎缩为特征的运动障碍
。而神经源性炎症痛的疼痛症状表现为对热伤害性和机械刺激以及异位痛觉的痛觉过敏,感觉异常(麻木、发痒、刺痛)和感觉迟钝
,以及自发痛
;此外,还伴有身体不同部位出现的局部疼痛,如头面部的三叉神经痛、舌咽神经痛、枕神经痛,脊髓病变导致的颈神经痛、胸腹神经痛、肋间神经痛,截肢后产生的残端痛,病变部位放射到上下肢的疼痛等。
2.3.2 洗脱液流速的选择 随着洗脱液流速增加,大孔吸附树脂对总黄酮解吸率也增加,直至洗脱液流速为4 mL/min时,大孔吸附树脂解吸率达到最大,为69.3%。当洗脱液流速超过4 mL/min时,树脂解吸率开始下降,这是因为较低流速下,吸附和解吸会达到一种平衡,流速过高则会导致解吸不彻底,降低解析率。最终确定4 mL/min为洗脱液合适流速(图5)。
(2)神经元活动的增强触发中枢神经系统神经源性炎症
二、神经源性炎症痛的形成机制
神经源性炎症可由“经典”因素触发,如感染、自身免疫或毒素等
,也可由导致神经元活动增强的因素触发,如伤害性刺激、心理应激和癫痫发作等
,两者均可能引起中枢神经系统内的免疫细胞、血管细胞和神经元的协同作用,导致C 纤维激活,然后通过背根反射(顺向信号)或轴突反射(逆向信号),使中枢神经系统或外周组织中的免疫细胞释放炎性介质,从而产生炎症反应
。
1.“经典”因素触发神经源性炎症
此外,炎症或神经损伤还可导致脊髓神经胶质细胞产生一氧化氮,然后合成并释放IL-1β。IL-1β 与其受体的结合可能诱导甲基-D-天冬氨酸(NMDA)受体NR1亚单位的磷酸化,以加强疼痛信号的传递
。
中枢神经系统被感染或损伤时,初级传入神经纤维会受到刺激并释放一系列物质(如P 物质、ATP 以及谷氨酸等),这些物质可以直接激活星形胶质细胞和小胶质细胞。具有先天免疫的星形胶质细胞被Toll 受体(TLR)和NLR 信号激活后释放炎性因子参与先天免疫反应,这是中枢神经系统中先天免疫炎症介质的主要来源
。表达所有TLR 的小胶质细胞在识别入侵的细菌和病毒之后会被激活,通过活化的炎性小体分泌IL-1β 和IL-18,进而引起小胶质细胞和星形胶质细胞产生继发性炎症级联反应
,导致伤害性感受器的痛觉敏化
。
中枢神经系统中的神经源性炎症是由神经胶质细胞的激活和细胞因子的释放以及由神经元活动所招募的其他炎症反应共同构成。伤害性刺激导致神经元活动增强,进而兴奋感觉神经纤维并产生动作电位,动作电位顺向传导至中枢神经系统之后,会导致中枢神经系统中的突触释放出类似外周组织中的物质以响应神经元的活动。例如,激活肽能初级传入C 纤维产生的动作电位在顺向传导到中枢神经系统后,导致突触释放多种神经肽和神经递质,包括:谷氨酸、P 物质、CGRP、BDNF、生长抑素、ATP 等
。这些神经肽和神经递质的受体存在于中枢神经系统中的各类细胞中,因此,它们的释放会影响中枢神经系统中的各类细胞参与C 纤维活动增强的反应并释放炎性介质
。例如,星形胶质细胞释放谷氨酸、GABA、前列腺素等;神经血管单位释放NO、前列腺素和细胞因子等。这些炎性介质可通过直接激活伤害性感受器来诱导疼痛
。此外,硬脑膜上的肥大细胞、血管周围的巨噬细胞以及CD4
和CD8
的T 细胞也可能参与并释放物质。同时,神经元活动的增强可能引起外周免疫细胞的募集以及血液-中枢神经系统屏障的变化,从而产生进一步的中枢神经源性炎症反应
。
2.神经元活动增强触发神经源性炎症
外周组织中的神经源性炎症是由肽能-感觉神经纤维外周末端依赖动作电位而释放的物质引发的,涉及血管扩张、血浆外渗、白细胞募集和肥大细胞脱颗粒等炎症表现。在外周组织中,神经元活动水平的增强可以引发炎症反应,即外周组织神经源性炎症
。伤害性感受器神经元中的动作电位可顺向传导至中枢神经系统,即背根反射
;也可逆向传导至传入纤维的非活动分支,即轴突反射
。
(1)神经元活动的增强触发周围组织神经源性炎症
炎症是机体受到有害刺激后以清除或摧毁有害物质为目的的一种防御反应。大多数情况下,炎症是由局部防御和免疫细胞的驻留、迁移或循环触发的,没有明显的神经系统参与。然而,免疫、内分泌和神经系统可能在许多炎症过程中相互作用,导致炎症的持续、加重或终止。炎症能够通过促进机体发热、增加睡眠、增强痛觉过敏来支持宿主防御功能
。但是长期、反复的炎症反应伴随着的痛觉敏感和对热冷的超敏则给病人带来了较大困扰。神经源性炎症也具有炎症反应的一般特点,即痛觉敏化,因此,将神经源性炎症带来的机体特定部位或全身性的疼痛症状定义为神经源性炎症痛。

3.2.1 采取UPS供电,电能需要经过多级转换,整体效率相对不高,提高了基站电费的支出。例如:某站点主设备功率为1kW,采用一台3kVA UPS供电,UPS转换效率为90%,不考虑电池充放电带来的影响,则该站点UPS每天耗电2.67度电,一年耗电974度。
大肠癌是消化道常见恶性肿瘤之一,全球发病率居第3位[1]。为有效提高大肠癌生存率,卫生部颁布的结直肠癌诊疗规范(2010版)[2]已将术后化疗列入了晚期或转移性结肠癌的辅助治疗原则,且术后化疗为1个疗程连续6次用药的方案。面对连续多次化疗的化疗方案,患者不仅会担心化疗反应和不良反应,也会产生负性心理状态并发生累积效应,严重影响患者治疗和康复效果。本文通过对结肠癌术后连续多次入院化疗患者的焦虑状况进行连续评估,旨在了解患者在1个疗程内每次接受化疗前的焦虑状况,从而为结肠癌术后化疗患者的心理评估及护理对策提供科学依据。
预包装的现制现售食品,现场分装或包装食品应张贴标签;标签内容应至少包括品名、生产日期与保质日期、保存条件、大卖场的名称、地址、联系电话;应按标签标注的储存条件下储存和销售;张贴标签后的产品不得再更改生产日期与保质期,也不得以加贴形式覆盖原来的生产日期与保质期;分装食品的保质期不得长于原包装上的保质期。
感觉神经纤维的兴奋还可激活中枢神经系统中的胶质细胞和血管细胞,并使其释放P 物质和CGRP 等神经肽。P 物质主要由脊髓背根神经节中的感觉神经元合成,以轴浆运输的方式输送至中枢端和外周端(感觉神经末梢),在外周,P 物质可引起其神经支配区域血管扩张、通透性增加、血浆外渗等神经源性炎症反应。CGRP 主要由背根神经节和三叉神经节的中、小型神经元合成,以轴浆运输的方式输送至中枢端和外周端,参与痛觉信息的产生和传递
。
某些类型的神经病理性疼痛与中枢神经系统的神经源性炎症有关。神经源性炎症会敏化伤害性感受器,产生疼痛。一方面,星形胶质细胞可通过缝隙连接传递信号,另一方面,其分泌的促炎介质可在脊髓组织中扩散,从而导致神经源性炎症扩散到激活的C 纤维的脊髓投射区之外,这可能引起非损伤部位的痛敏(继发性痛觉过敏)、镜像疼痛(相应对侧部位的疼痛)和广泛性疼痛
。神经元活动增强触发中枢神经系统神经源性炎症的途径如下(见图2)。
高层建筑一般采用钢结构或钢筋混凝土结构,其二者各有其特点。其中:钢结构具有自重轻、抗震性能好、强度高、延性好以及施工工期短等优点,其缺点是造价要比钢筋混凝土结构高。当场地地基土的特征周期较长时,地震时极易引发共振,造成更大的破坏;钢筋混凝土结构具有刚度大、造价低、整体性好、承载能力大等优点。其缺点是结构自重大、抵抗塑性变形的能力相对较差。因此,钢结构一般用于柔性结构,钢筋混凝土结构一般用于控制塑性变形的刚性结构。

3.神经源性炎症导致疼痛的机制
伤害性感受器是感受神经源性炎症并导致疼痛的特殊结构,它可以通过缓激肽、前列腺素、促炎细胞因子和趋化因子等
结合或激活位于神经末梢和细胞体上的G 蛋白偶联受体(G-protein coupled receptors, GPCRs)、离子通道受体和酪氨酸激酶受体来传递信号。
目前发现的参与神经源性炎症的G 蛋白偶联受体主要有Mrgprs 家族蛋白和蛋白酶激活受体 (protease activated receptors, PARS)。激活伤害性神经元上的 PAR2 的蛋白酶可刺激 P 物质和CGRP 的释放,从而导致外周组织中的神经源性炎症并介导脊髓背角的疼痛传递;神经源性的P 物质和CGRP 等肽类物质可通过MrgprX2 受体激活肥大细胞,促进肥大细胞的脱颗粒,并释放大量的促炎因子和趋化因子
,这些促炎因子和趋化因子通过刺激伤害性感受器导致痛觉敏化。
柜员在最底层货架找了半天,拿出一小瓶白色药片,我给了她两块钱,转身走的时候听见她还补了一刀:“这种维生素C不能经常吃,会伤身。”
参与神经源性炎症痛的离子通道主要是TRPV1和TRPA1。TRPV1/TRPA1 的激活会导致感觉神经末梢增加炎性介质(神经肽和细胞因子)的释放,这些介质又可以通过致敏TRPV1/TRPA1 介导疼痛
。此外,一些细胞因子,如肿瘤坏死因子α(TNF-α) 是通过酪氨酸激酶受体介导神经源性炎症并引起痛觉过敏的
。
总之,神经源性炎症是由神经末梢或突触释放P 物质和CGRP 等神经肽而引起,这些神经肽除了本身可以刺激伤害性感受器导致痛觉过敏之外,还可以通过影响其他免疫细胞释放的促炎因子和趋化因子导致伤害性感受器的痛觉过敏。
三、常见伴随神经源性炎症痛的疾病
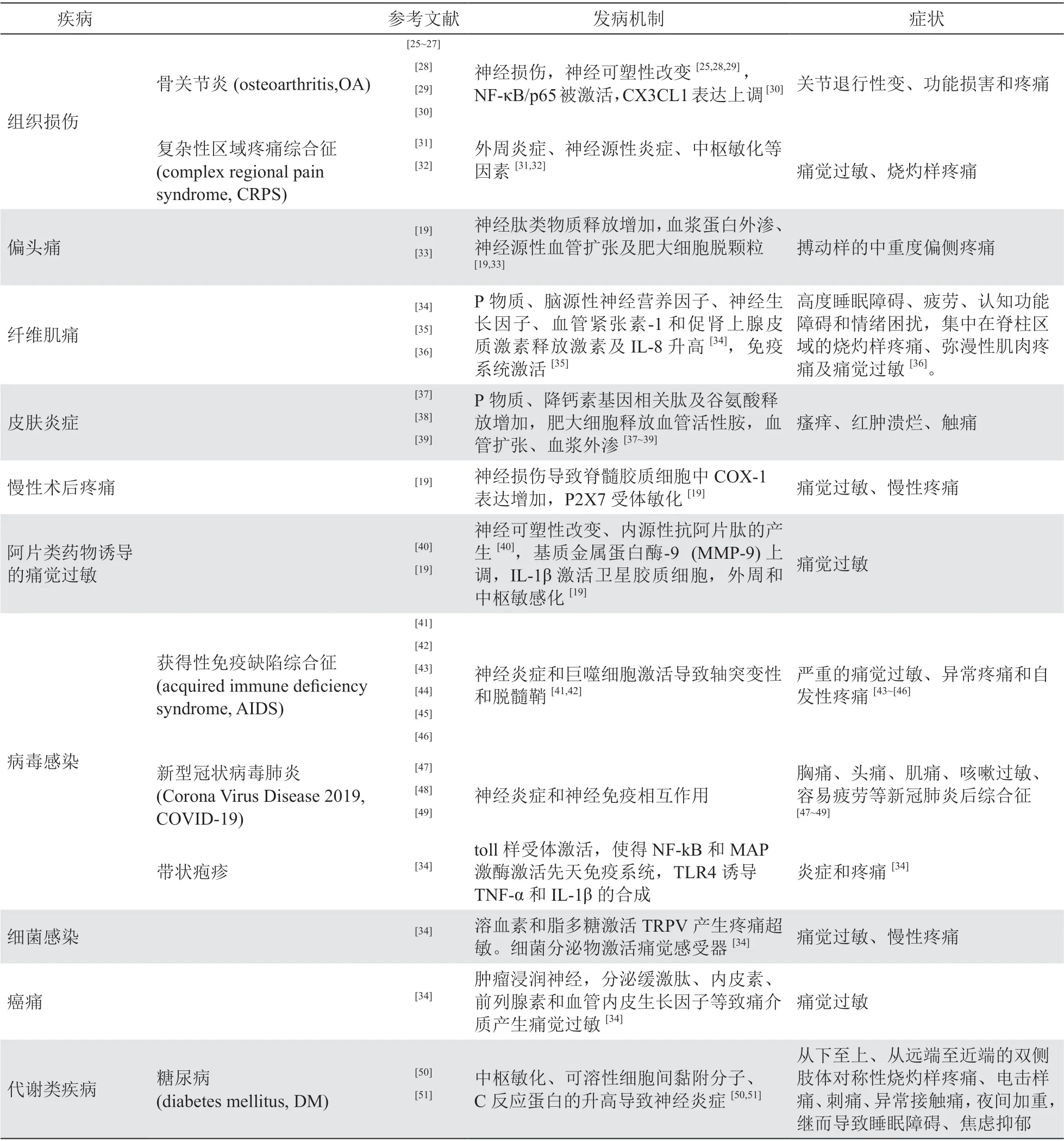
神经源性炎性痛是许多疾病的主要症状或伴发症状之一,临床上许多疾病的病人都同时遭受着并发神经源性炎症痛带来的痛觉过敏和痛觉异常,这些疾病的流行病学、发病率、发病机制见表1。
除表1 中列出的常见疾病外,神经源性炎症痛还伴随三叉神经痛、气道源性痛、重金属和农药中毒、神经性牙痛、面神经炎并发导致的膝状神经节综合征以及强直性脊柱炎等疾病产生。上述疾病导致躯体神经损伤,产生自发性疼痛、痛觉过敏、痛觉超敏、感觉异常等症状
。神经源性炎症痛的共同特点有血管通透性增加、白细胞浸润、胶质细胞活化和炎症介质生成。在产生机制上,施万细胞、卫星胶质细胞、小胶质细胞、星形胶质细胞等均参与此病理过程,其中胶质细胞活化和炎症介质生成介导的突触重塑及中枢敏化是其重要机制
。
减压塔化学清洗以往清洗的基础上有了较大的改善,减压塔侧线建立循环,确保循环量不小于200 t/h,减压塔塔底增加专线至清洗槽,经过清洗槽的沉降和过滤后至加药槽,再通过专泵打入减压塔一线冷回流过滤器处返塔,形成减压塔清洗大循环,流量控制不小于100 t/h,现场实物见图2。通过增设沉降槽,一方面可以观察清洗液变化情况,从而判断减压塔清洗效果,另外一方面可以沉降塔底带来的杂物和油泥,通过沉降和过滤,有效防止杂物和油泥再次带入塔内。从实际操作和清洗效果来看,效果较好。
四、总结
神经源性炎症痛伴发疾病种类繁多,涉及组织损伤、神经损伤、细菌病毒感染以及代谢类疾病等,受累人群广泛,发病机制复杂。目前关于神经源性炎症痛的机制的研究,主要集中于中枢神经系统神经源性炎症和外周组织神经源性炎症两个方面。本文总结整理了神经源性炎症痛产生的分子基础,集中阐述了神经元活动增强所引发的神经源性炎症的机制。即伤害性感觉神经纤维感受到的刺激信号以动作电位的形式随着背根反射和轴突反射到达神经纤维末端,进而引起P 物质、CGRP 等神经肽的释放。这从而导致神经源性炎症的产生以及伤害性感受器的痛觉过敏。
对于易反复、病程长的神经源性炎症痛,治疗应秉持早期防治、缓解疼痛、减轻炎症、辅以康复训练、恢复身体机能、降低复发率的原则,以药物治疗、神经调控技术和中医康复疗法为主要的治疗策略
。常用的药物有减少谷氨酸、P 物质和去甲肾上腺素释放的钙通道调节剂,如加巴喷丁、普瑞巴林;阻断疼痛传导通路多个环节的三环抗抑郁药,如阿米替林;抑制5-羟色胺和去甲肾上腺素再摄取的抑制类药物,如文拉法辛和度洛西汀;阻断钠通道的抗惊厥药物,如卡马西平、奥卡西平;抗炎药物,如阿司匹林、双氯芬酸钠
。此外,阿片类镇痛药也是常用的临床治疗药物。
除了药物治疗外,通过不同频率经皮电刺激穴位激发脑和脊髓中发挥镇痛作用的阿片肽等神经肽释放的韩氏仪、经皮神经电刺激术、脊髓电刺激及经颅磁刺激术等神经调控技术也可缓解神经源性炎症痛。此外,还可根据病人的不同情况,辅以鞘内注射镇痛药物、神经阻滞、射频治疗
,以及针灸推拿、按摩理疗等中医方法。除上述常用的治疗方案外,保护神经减轻疼痛
、阻断突触可塑性减轻炎症
、调节与疼痛密切相关的TRP 通道、采取骨髓干细胞的细胞治疗控制神经炎症等非药物的替代疗法也为临床上治疗神经源性炎症痛提供了新思路
。
研究疾病的发病机制对于临床上疾病的治疗方案开发具有重要意义,本文经过对不同疾病的神经源性炎症痛的诱发机制进行了归纳整合,发现其共同诱因为神经损伤、中枢及外周敏化,旨在为神经源性炎症痛的治疗梳理潜在靶点,提供一定理论支持,推进临床上相关高效药物的研发进程。
利益冲突声明:作者声明本文无利益冲突。
[1] Jancsó G, KAtona M, Horváth V,
. Sensory nerves as modulators of cutaneous inflammatory reactions in health and disease[J]. Neuroimmune Biology, 2009, 8(1):3-36.
[2] Berczi I, Szentivány I. Neuroimmune Biology[J]. Elsevier, 2009, 8:1-346.
[3] Chiu IM, Von Hehn CA, Woolf CJ. Neurogenic inflammation and the peripheral nervous system in host defense and immunopathology[J]. Nat Neurosci, 2012,15(8):1063-1067.
[4] Xanthos DN, Sandkühler J. Neurogenic neuroinflammation inflammatory CNS reactions in response to neuronal activity[J]. Nat Rev Neurosci, 2014, 15(1):43-53.
[5] Roosterman D, Goerge TWS. Neuronal control of skin function the skin as a neuroimmunoendocrine organ[J].Physiol Rev, 2006, 86(4):1309-1379.
[6] Keeler JL, Patsalos O, Chung R,
. Short communication: serum levels of brain-derived neurotrophic factor and association with pro-inflammatory cytokines in acute and recovered anorexia nervosa[J]. J Psychiatr Res, 2022, 150:34-39.
[7] 邱晓, 华艳, 白玉龙. 神经源性炎症在复杂性区域疼痛综合征发病中的作用机制研究进展[J]. 中国临床神经科学, 2019, 27(3):329-334.
[8] 周围神经病理性疼痛诊疗中国专家共识[J]. 中国疼痛医学杂志, 2020, 26(5):321-328.
[9] Russo R, Cristiano C, Avagliano C,
. Gut-brain axis: role of lipids in the regulation of inflammation,pain and CNS diseases[J]. Curr Med Chem, 2018,25(32):3930-3952.
[10] Hasriadi, Wasana PWD, Sritularak B, Vajragupta O,
.Mechanistic insight into the effects of curcumin on neuroinflammation-driven chronic pain[J]. Pharmaceuticals(Base), 2021, 14(8):777.
[11] Skaper SD, Giusti P, Facci L. Microglia and mast cells:two tracks on the road to neuroinflammation[J]. Faseb J,2012, 26(8):3103-3117.
[12] Ransohoff RM, Brown MA. Innate immunity in the central nervous system[J]. J Clin Invest, 2012, 122(4): 1164-1171.
[13] Combes V, Guillemin GJ, Chan-Ling TL,
. The crossroads of neuroinflammation in infectious diseases:endothelial cells and astrocytes[J]. Trends Parasitol,2012, 28(8):311-319.
[14] Roosterman D, Goerge T, Schneider SW,
. Neuronal control of skin function: the skin as a neuroimmunoendocrine organ[J]. Physiol Rev, 2006, 86(4):1309-1379.
[15] 黎明江, 黄鹤, 吴钢. 瞬时受体电位离子通道:生理功能与疾病 [M]. 湖北:湖北科学技术出版社, 2007.
[16] 郝飞, 宋志强.《特异性皮炎》神经肽 [M]. 北京:人民军医出版社, 2008.
[17] Baylis S. On the origin from the spinal cord of the vaso-dilator fibres of the hind-limb, and on the nature of these fibres[J]. J Physiol, 1901, 26(3-4):173-209.
[18] Amaya F, Izumi Y, Matsuda M. Tissue injury and related mediators of pain[J]. Curr Neuropharmacol, 2013,11(6):592-597.
[19] Matsuda M, Huh Y, Ji RR. Roles of inflammation,neurogenic inflammation, and neuroinflammation in pain[J]. J Anesth, 2019, 33(1):131-139.
[20] White FA, Bhangoo SK, Miller RJ. Chemokines:integrators of pain and inflammation[J]. Nat Rev Drug Discov, 2005, 4(10):834-844.
[21] 朱婵, 王媚媛, 唐宗湘. Mrgprs 家族蛋白在疼痛形成中的作用和特点[J]. 中国疼痛医学杂志, 2021,27(2):98-104.
[22] Gouin O, L'Herondelle K, Lebonvallet N,
. TRPV1 and TRPA1 in cutaneous neurogenic and chronic inflammation: pro-inflammatory response induced by their activation and their sensitization[J]. Protein Cell,2017, 8(9):644-661.
[23] Planells-Cases R, Garcia-Sanz N, Morenilla-Palao C,
.Functional aspects and mechanisms of TRPV1 involvement in neurogenic inflammation that leads to thermal hyperalgesia[J]. Pflug Arch Eur J Phy, 2005, 451(1):151-159.
[24] Lu SC, Chang YS, Kan HW,
. Tumor necrosis factor-alpha mediated pain hypersensitivity through ret receptor in resiniferatoxin neuropathy[J]. Kaohsiung J Med Sci, 2018, 34(9):494-502.
[25] Krustev E, Rioux D, Mcdougall JJ. Mechanisms and mediators that drive arthritis pain[J]. Curr Osteoporos Rep, 2015, 13(4):216-224.
[26] 高鹏, 覃文聘, 牛丽娜. 外周神经致痛机制促进骨关节痛的研究进展[J]. 临床口腔医学杂志, 2020,36(10):633-636.
[27] Chen D, Shen J, Zhao WW,
. Osteoarthritis: toward a comprehensive understanding of pathological mechanism[J]. Bone Res, 2017, 5(01):1-13.
[28] Schuelert N, Mcdougall JJ. Grading of monosodium iodoacetate-induced osteoarthritis reveals a concentration-dependent sensitization of nociceptors in the knee joint of the rat[J]. Neurosci Lett, 2009, 465(2):184-188.
[29] Syx D, Tran PB, Miller RE,
. Peripheral mechanisms contributing to osteoarthritis pain[J]. Curr Rheumatol Rep, 2018, 20(2):1-11.
[30] 刘翠翠, 徐灵军, 余少君. 背根神经节NF-κB/p65激活介导的CX3CL1 上调在大鼠膝关节骨性关节炎痛觉过敏中的作用[J]. 中国康复医学杂志, 2021,36(12):1481-1486.
[31] URits I, Shen AH, Jones MR,
. Complex regional pain syndrome, current concepts and treatment options[J]. Curr Pain Headache R, 2018, 22(2):1-9.
[32] 薛婷婷, 陈永权. 复杂区域疼痛综合征药物治疗的研究进展[J]. 医学综述, 2021, 27(6):1194-1199.
[33] 董兰真, 蒲圣雄, 周冀英. 偏头痛与神经源性炎症的研究进展[J]. 重庆医学, 2015, 44(8):1126-1128.
[34] Ji RR, Chamessian A, Zhang YQ. Pain regulation by non-neuronal cells and inflammation[J]. Science, 2016,354(6312):572-577.
[35] Littlejohn G, Guymer E. Neurogenic inflammation in fibromyalgia[J]. Semin Immunopathol, 2018, 40(3):291-300.
[36] JI RR, Xu ZZ, Gao YJ. Emerging targets in neuroinflammation-driven chronic pain[J]. Nat Rev Drug Discov, 2014, 13(7):533-548.
[37] Littlejohn G. Neurogenic neuroinflammation in fibromyalgia and complex regional pain syndrome[J]. Nat Rev Rheumatol, 2015, 11(11):639-648.
[38] Chen Y, Lyga J. Brain-skin connection stress, inflammation and skin aging[J]. Inflamm Allergy Drug Targets, 2014, 13(3):177-190.
[39] Liu Q, Tang ZX, Surdenikova L,
. Sensory neuron-specific GPCR mrgprs are itch receptors mediating chloroquine-induced pruritus[J]. Cell, 2009,139(7):1353-1365.
[40] 刘艳丽, 张二飞, 张俊英. 阿片类药物诱导痛觉过敏及阿片受体拮抗剂应用的研究进展[J]. 广西医学,2016, 38(3):402-405.
[41] Merlin JS, Long D, Becker WC,
. Brief reportthe associa-tion of chronic pain and long-term opioid therapy with HIVtreatment outcomes[J]. J Acquir Immune Defic Syndr, 2018, 79(1):77-82.
[42] 刘民强, 吴海萍, 石浩文. HIVAIDS 患者疼痛诊疗现状[J]. 中国艾滋病性病, 2021, 27(1):101-104.
[43] Chai QQ, Jovasevic V, Malikov V,
. HIV-1 counteracts an innate restriction by amyloid precursor protein resulting in neurodegeneration[J]. Nat Commun, 2017,8(1):1-13.
[44] Keswani SC, Jack C, Zhou CH,
. Establishment of a rodent model of HIV-associated sensory neuropathy[J]. J Neurosci, 2006, 26(40):10299-10304.
[45] 乐晓琴, 张仁芳. 富马酸替诺福韦二吡呋酯对艾滋病患者肾脏毒性的研究进展[J]. 新发传染病电子杂志, 2018, 3(3):150-153.
[46] 陈瑶, 韩亚坤, 吴强. HIV 相关感觉神经病的研究进展[J]. 新发传染病电子杂志, 2021, 6(4):361-367.
[47] Fukuda K, Straus ES, Hickie I,
. The chronic fatigue syndrome a comprehensive approach to its definition and study[J]. Ann Int Med, 1994, 121(12):953-959.
[48] Rivera MC, Mastronardi C, Silva-Aldana CT,
.Myalgic encephalomyelitis/chronic fatigue syndrome: a comprehensive review[J]. Diagnostics, 2019, 9(3):91.
[49] Song WJ, Hui CKM, Hull JH,
. Confronting COVID-19-associated cough and the post-COVID syndrome: role of viral neurotropism, neuroinflammation,and neuroimmune responses[J]. Lancet Resp Med,2021, 9(5):533-544.
[50] 杨慧芳, 魏碧玉, 高明龙. 2 型糖尿病并发周围神经病理性疼痛的患病率及危险因素分析[J]. 武警医学,2021, 32(7):562-567.
[51] 孟庆冕, 王洪新. 神经电生理技术诊断糖尿病前期周围神经病变的研究进展[J]. 中国现代医学杂志,2021, 31(19):70-75.
[52] 袁文茜,曹伯旭,胡永生,等. 慢性神经病理性疼痛[J].中国疼痛医学杂志, 2021, 27(7):481-485.
[53] 曹人郦, 蓓袁, 顾艳丽. 星形胶质细胞介导神经炎症调节神经病理性疼痛的分子机制及中医药干预的研究进展[J]. 转化医学电子杂志, 2018, 5(9):20-25.
[54] Xu ZZ, Zhang L, Liu T,
. Resolvins RvE1 and RvD1 attenuate inflammatory pain via central and peripheral actions[J]. Nat Med, 2010, 16(5):592-597.
[55] Zhang LL, Terrando N, Xu ZZ,
. Distinct analgesic actions of DHA and DHA-derived specialized pro-resolving mediators on post-operative pain after bone fracture in mice[J]. Fronti Pharmacol, 2018, 9:412.
