新生儿重症监护患者耐碳青霉烯类肺炎克雷伯菌定植发展为感染的危险因素分析
2022-07-27殷丽军杨韦菁王晓华何磊燕王传清
殷丽军,杨韦菁,缪 瑾,王晓华,何磊燕,王传清,
(复旦大学附属儿科医院 1. 院内感染控制与防保科; 2. 临床检验中心细菌室,上海 201102)
耐碳青霉烯类肠杆菌目细菌(carbapenem-resistantEnterobacterales, CRE)以耐碳青霉烯类肺炎克雷伯菌(CRKP)为主,通常具有广泛的耐药性,CRKP感染具有高发病率和高病死率的特点,严重威胁人类健康[1-2]。受多种侵入性医疗操作、自身免疫系统受损、长期住院等因素的影响,重症监护病房患者住院期间CRE新发感染的风险增高,而且医疗设备和抗菌药物的使用为细菌耐药创造了理想环境[3-4]。据2017年我国细菌耐药监测结果显示,CRKP对碳青霉烯类抗生素的耐药率已超过20%[5]。
CRE定植是感染的先决条件[6],但大多数研究的对象为成人患者,发病率为7.6%~44.4%[7],并且属于症状性感染,缺乏同源性检测结果的验证,但上述条件是指导感染监控干预决策的重要依据。儿童中相关研究报道较少,作为CRKP感染的高危人群,新生儿重症监护病房(NICU)新生儿中CRKP定植发展为临床感染的概率及相关危险因素目前尚不清楚。在前期的一项研究中,某院NICU新生儿CRKP医院感染发病率较高[8],且新生儿和非新生儿患者表现出不同的分子学特征[8]。因此,在NICU新生儿中识别CRKP感染的危险因素至关重要。
复旦大学附属儿科医院是一所拥有800张病床的三级甲等专科医院。多年来,CRE医院感染发病率最高的科室为NICU(1.3%)[8]。因此在本研究中,为确定CRKP定植患者中后期发展为临床感染的危险因素,在NICU进行了一项单中心、横断面的回顾性研究,结合临床资料和Diversilab同源性监测对CRKP定植菌株和后继发生临床感染的菌株进行同源性检测,确定NICU新生儿CRKP定植后发生临床感染的风险,并查阅相关病历资料对CRKP感染的危险因素进行分析。
1 对象与方法
1.1 研究对象 选取该院2017年1月—2018年12月入住本院NICU的新生儿为研究对象。纳入标准:研究期间入住NICU的新生儿中,入院后48 h内进行了至少一次咽拭子/肛拭子主动筛查,并且入院前无证据表明有CRKP定植或临床感染的新生儿。排除标准:入院后48 h内未进行咽拭子/肛拭子主动筛查的新生儿;入院前有证据表明存在CRKP导致的定植或临床感染的新生儿。
1.2 研究方法
1.2.1 病例分组 将有CRKP定植且后期住院期间发生CRKP临床感染的新生儿列为病例组(CRKP感染株与定植株具有同源性),有CRKP定植但在后期住院期间未发生CRKP临床感染的新生儿列为对照组。CRKP定植48 h后出现的临床感染定义为筛查标本和临床标本之间的“后续”感染。
1.2.2 调查内容 所有CRKP定植和感染新生儿的临床资料均从电子病历系统中进行查阅,包括性别、出生体重、胎龄、入院日期、既往手术史、侵入性操作[包括机械通气、脐静脉导管(UV)、脐动脉导管(UA)、外周中心静脉导管(PICC)、鼻胃管插入]和抗菌药物暴露。新生儿营养风险评估(基于STRONGkids[9]的改良评估量表,见表1)和新生儿危重评分II(SNAP-Ⅱ)[10]均在入院时完成。

表1 新生儿营养评估风险量表
1.2.3 细菌培养与药敏试验 采用常规细菌培养方法对临床微生物标本进行细菌培养,细菌鉴定采用MALDI-TOF biotyper细菌质谱鉴定仪(德国布鲁克公司)进行鉴定。采用Vitek 2 Compact对菌株进行仪器法药敏试验。采用AST GN13抗菌药物敏感性试验卡片(法国梅里埃公司)检测菌株对亚胺培南和厄他培南的最低抑菌浓度(MIC),采用纸片扩散法测定菌株对美罗培南的抑菌圈直径。采用标准菌株大肠埃希菌 ATCC 25922、ATCC 35218(产酶株)作为仪器法药敏试验质控菌株,采用标准菌株大肠埃希菌 ATCC 25922作为纸片扩散法药敏试验质控菌株,监测目标菌为CRKP。
1.2.4 Diversilab同源性监测 为确定感染是否由患者自身定植菌引起,对CRKP定植菌和后续引起临床感染的菌株进一步进行Diversilab同源性监测。Diversilab同源性监测方法参阅文献[11]。临床感染菌株与定植菌株相似度>95%的菌株定义为与CRKP定植菌同源的菌株。
1.3 判断标准 根据2016年美国临床实验室标准化协会(CLSI)指南[12],经鉴定对碳青霉烯类抗生素(厄他培南、亚胺培南和美罗培南)具有耐药性的直肠或咽拭子分离株被确认为定植菌株。本研究中,CRKP定植定义为患者仅有直肠和/或咽拭子分离培养阳性,但未表现出临床体征和/或症状。定植率的计算方法为 CRKP阳性患者数/筛查患者总数。CRKP感染定义为患者至少有一种临床分离阳性标本,并且表现出临床感染阳性体征和/或症状。主动筛查率=主动筛查新生儿总数/在院新生儿总数×100%;定植率=主动筛查阳性例数/同期筛查总例数×100%。
作为减少CRE感染的集束化感控措施的一部分,在2017年1月1日—2018年12月31日,对新入NICU或是转入新生儿入院48 h内及住院期间每周一次进行肛拭子和咽拭子主动筛查,经专门培训的临床医务人员严格按照2013年《全国临床检验操作规程》进行标本采集和送检[5]。对观察期间的NICU住院新生儿采用医院感染管理信息系统的医院感染疑似病例模块进行医院感染实时监测。医院感染判断标准依据美国疾病控制与预防中心/国家医疗保健安全网络(CDC/NHSN)发布的《医疗保健相关感染的监测定义和急性医疗机构感染的分型标准(2009年)》进行判定。
1.4 统计学方法 应用SPSS 23.0统计软件进行数据分析。连续变量以平均值±标准差表示,分类变量以例、百分比表示。危险因素的单因素分析采用χ2检验或Fisher’s确切检验,危险因素的多因素分析采用logistic回归分析。P≤0.05为差异具有统计学意义。
2 结果
2.1 CRKP主动筛查情况 2017年和2018年NICU住院新生儿分别为1 783、1 578例,主动筛查主要集中在入院48 h内,入院48 h内新生儿咽拭子与肛拭子2018年的主动筛查率均高于2017年,差异均有统计学意义(均P<0.001)。见表2。
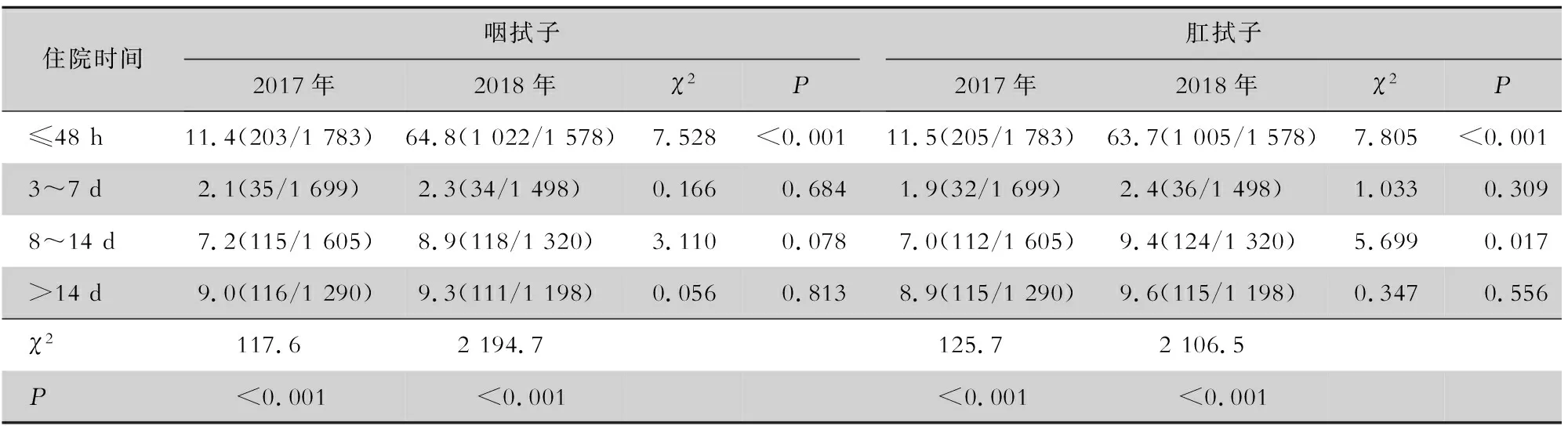
表2 2017、2018年NICU新生儿CRKP主动筛查情况[%(筛查例数/新生儿例数)]
2.2 CRKP定植患者临床特征 1 230例患者进行了CRKP定植筛查,其中110例患者CRKP阳性,定植率为8.9%。其中肠道定植率8.1%(97/1 197),高于上呼吸道(5.2%,49/945);入院48 h内患者CRKP定植率(2.6%)较住院时间>48 h患者(13.1%)低;CRKP定植率随胎龄减小和出生体重的降低而增加;随着住院时间的增加,CRKP上呼吸道和肠道CRKP定植率均增加;差异均有统计学意义(均P<0.05)。见表3。
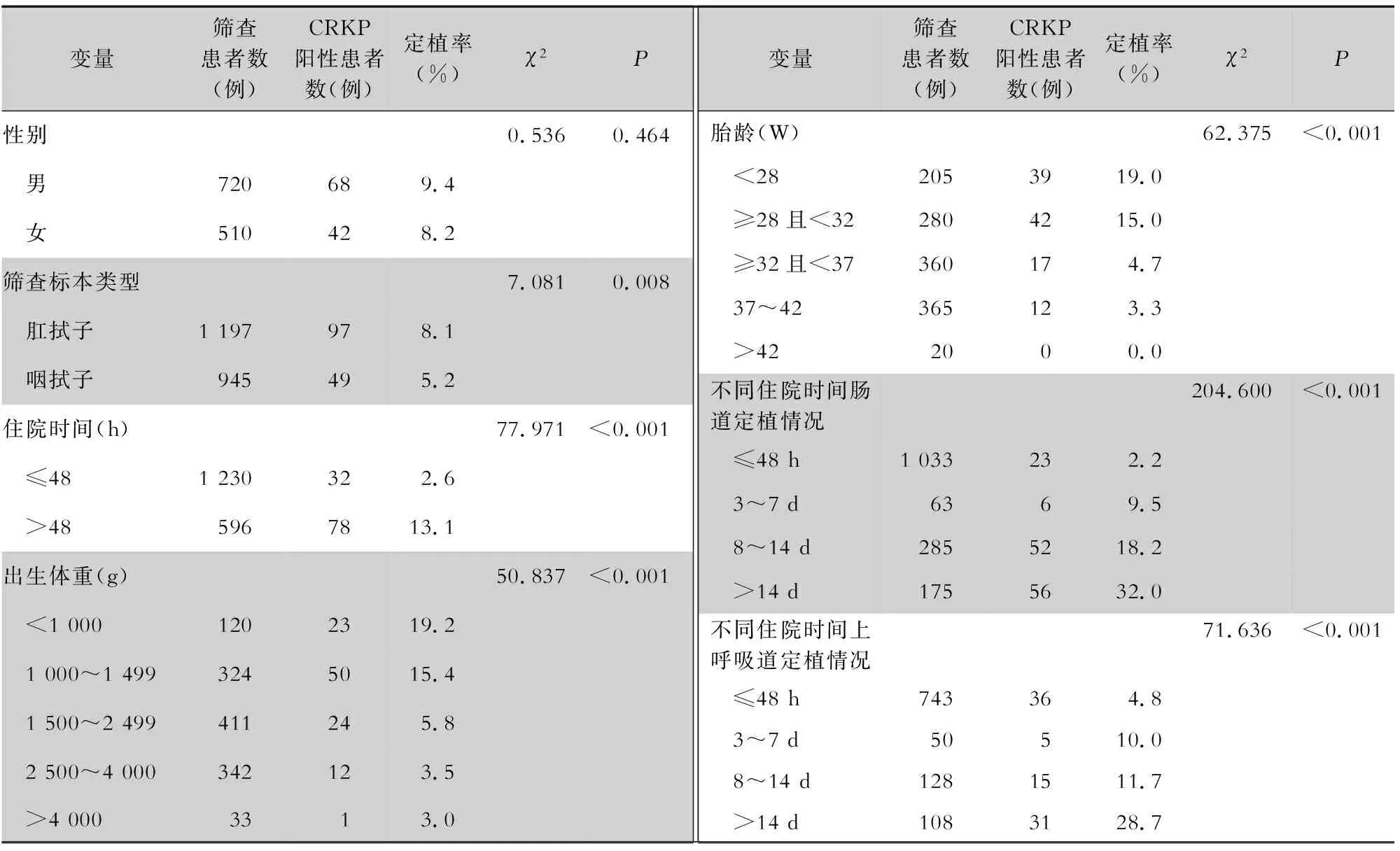
表3 不同临床特征NICU新生儿CRKP定植率比较
2.3 CRKP定植发展为感染情况 在110例CRKP定植阳性新生儿中,23例患者在定植后住院期间发生CRKP临床感染。91.3%(21/23)的CRKP临床感染新生儿其定植和临床感染菌株相似度>95%,为同一克隆菌株,见图1, CRKP定植新生儿发展为临床感染的风险为19.1%(21/110)。CRKP感染最常见的部位是泌尿道,有11例,其次是呼吸道(8例)和血流感染(2例)。CRKP定植发展为临床感染新生儿中共有4例死亡,病死率19.0%(4/21)。
2.4 CRKP定植发展为感染的危险因素分析 在110例CRKP定植新生儿中21例发生了与 CRKP定植菌同源的感染,49例新生儿在住院期间CRKP仍呈定植状态,病例对照比为1∶2.3。为了确定定植新生儿中CRKP感染的危险因素,对21例病例组和49例对照组新生儿进行比较分析。结果显示病例组的总住院时间和定植后的住院时间明显长于对照组,差异有统计学意义(均P<0.05)。单因素分析显示,病例组新生儿住院史比率(61.9% VS 32.7%)、机械通气史比率(81.0% VS 20.4%)、鼻胃管史比率(66.7% VS 40.8%)、既往手术史比率(23.8% VS 4.1%)、SNAP-Ⅱ评分[(17.2±11.3)分 VS (9.8±7.3)分]均高于对照组,差异均有统计学意义(均P<0.05)。病例组与对照组不同营养风险程度新生儿所占比率比较,差异有统计学意义(P=0.018),见表4。多因素分析显示,CRKP定植发展为临床感染的独立危险因素为机械通气、新生儿营养风险高评估和SNAP-Ⅱ高评分,见表5。

表4 新生儿CRKP定植发展为临床感染的单因素分析

表5 新生儿CRKP定植发展为临床感染的危险因素多因素分析
3 讨论
本研究对1 230例NICU患者进行了筛查,发现8.9%的患者发生CRKP定植。此外,19.1%定植患者发展为CRKP临床感染。回顾性研究发现,接受机械通气、营养不良和新生儿危重状态是CRKP感染的独立危险因素。
胃肠道是最常见的耐药菌筛查部位,特别是直肠拭子[13-14]。国外研究[15-16]发现,入院时CRKP定植率为1%~30%。此外,国内研究发现,通过ICU住院期间的随机筛查,CRKP定植率分别为6.5%[17]、20.8%[18]。本研究中进行了上呼吸道和肠道主动筛查,发现CRKP定植率为8.9%,低于上海成人患者相关研究(15.2%,37/243)[14]。此外,本研究发现随着住院时间延长,CRKP定植率呈上升趋势。Ruiz等[19]研究发现,在ICU入住时间超过3周的患者中,多重耐药肺炎克雷伯菌(MDR-KP)的定植率超过50%,表明住院环境增加定植的风险。另外,在新生儿中随着胎龄减小和出生体重的降低,CRKP定植率增加,提示早产和低出生体重是新生儿CRKP定植的危险因素。
CRE在儿童中的患病率不断增加,尤其是NICU新生儿, CRKP医院感染比例最高,并且表现出与非新生儿患者不同的流行病学特征[6],因此,确定感染危险因素尤为重要。尽管有大量新生儿CRE定植的相关研究报道[20],但目前尚未有NICU新生儿定植发展为感染的相关危险因素报道。国外研究[6]表明,CRE定植后感染风险为7.6%~44.4%。本研究发现,CRKP定植导致8.9%的临床感染风险。同时本研究发现CRKP定植率随胎龄和出生体重的降低而增加。然而,当分析定植发展为感染的危险因素时出生体重和胎龄并没有统计学意义。此外,本研究首次发现新生儿营养风险评估和新生儿危重状态是CRKP感染的独立危险因素。另外与成人患者研究[21]相似,机械通气是CRKP感染的独立危险因素。
Diversilab 系统是基于重复序列聚合酶链反应(rep-PCR)技术原理的半自动基因分型方法,通过PCR扩增细菌基因组的非编码重复序列后,根据扩增片段的多态性比较菌株间相似性,其操作简单可重复、数据标准化,可广泛应用于医院感染菌株的快速诊断分型[22]。与以往的研究不同,本项研究利用Diversilab进一步验证定植和感染菌株之间的同源性,结果发现91.3%的CRKP定植菌和感染菌为同一克隆菌株,进一步说明CRKP定植是临床感染的重要因素。此外,本研究还发现不同新生儿间同源性较高,提示不同新生儿间克隆传播的可能,提示该院NICU应采取更加严格的感染控制措施。
本研究的局限性:本研究为单中心研究;此外,由于回顾性研究的局限性,缺乏对相应时间环境、手卫生的采样和分析,因此,无法确定菌株之间的传播途径。
总之,CRKP的定植可增加NICU新生儿CRKP感染的发生。与成年患者不同,早产、低出生体重和住院时间延长是NICU新生儿CRKP定植的危险因素,而由定植到感染的发展过程中新生儿的营养状况和危重状态是其危险因素。此外同源性监测还发现不同新生儿间水平传播的可能,医院NICU应加强医院感染控制措施。
利益冲突:所有作者均声明不存在利益冲突。
