63例特殊类型宫颈腺癌的临床特征分析*
2022-07-27刘岿然
李 悦,刘岿然
(中国医科大学附属盛京医院妇产科,沈阳 110004)
宫颈癌在发展中国家的发病率(18.2%)与死亡率(12.0%)均占女性恶性肿瘤的第二位,仅次于乳腺癌[1],是我国发病率最高的女性生殖道恶性肿瘤[2]。最常见病理类型为鳞癌,患病率约占75%,其次是腺癌,患病率约占25%[3]。特殊类型宫颈腺癌多与HPV感染无关,近年来其发病率呈上升趋势,因早期症状隐匿,常规筛查检出率较低,临床工作中极易漏诊[4]。特殊类型宫颈腺癌的病理类型较多,预后情况不一,尚缺乏特异的诊疗方案。因此,研究特殊类型宫颈腺癌的临床特征对于疾病的诊治及预后有重要意义。本文通过回顾分析中国医科大学附属盛京医院收治的63例特殊类型宫颈腺癌患者的临床病例资料,探讨此类疾病的临床特点、病理学特征、免疫组化特点及治疗方案等,以期优化诊疗方案,提高生存率,改善患者预后。
1 资料与方法
1.1 临床资料 收集中国医科大学附属盛京医院2009年至2021年间收治的63例特殊类型宫颈腺癌患者的资料,包括宫颈绒毛管状腺癌(villoglandular papillary adenocarcinoma,VPA)28例,微偏腺癌(minimal deviation adenocarcinoma,MDA)12例,透明细胞癌(clear cell adenocarcinoma of the uterine cervix,CCAC)21例,中肾管腺癌(mesonephric adenocarcinoma,MNA)2例,并对所有患者进行电话随访。
1.2 观察指标 统计分析患者的一般资料、临床表现、辅助检查、治疗方法及预后。将患者手术时间或接受末次放(化)疗时间(未手术者)至可疑复发的时间间隔作为无进展生存期,回顾分析影响总体生存及疾病复发情况的相关因素。
1.3 免疫组化 病理标本经10%福尔马林固定,常规石蜡包埋,4μm连续切片,进行免疫组化染色,显微镜下观察。石蜡切片经2~3位高年资病理医师复核确诊。免疫组化采用EnVision两步法,抗体包括NapsinA、p16、p53、PAX8等,均为即用型抗体。判断标准:NapsinA为细胞质着色,p53、ER、PR、PAX8、HNF-1β、WT-1为胞核着色,CK7、CK20为细胞膜及细胞质着色。对着色强度及阳性细胞比例分别评分:(1)着色强度评分:不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;(2)阳性细胞比例评分:阳性着色细胞<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将两项评分结果相乘,0~2分为阴性(-),3~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
1.4 统计学方法 采用SPSS24.0软件。计数资料采用百分比表示,计量资料采用一致性卡方检验。用Kaplan-Meier法及Log-rank检验分析相关因素与预后的关系。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 患者就诊年龄22~75岁,中位年龄48岁;中位孕次2次(0~6次),中位产次1次(0~5次)。FIGO(2018版)宫颈癌分期:Ⅰ期36例(57.14%),其中1例Ⅰa1期,10例Ⅰb1期,19例Ⅰb2期,6例Ⅰb3期;Ⅱ期患者15例(23.81%),其中7例Ⅱa1期,6例Ⅱa2期,2例Ⅱb期;Ⅲ期患者6例(9.52%),其中4例Ⅲc1期,2例Ⅲc2期;Ⅳ期患者4例(6.35%),其中3例Ⅳa期,1例Ⅳb期。见表1。
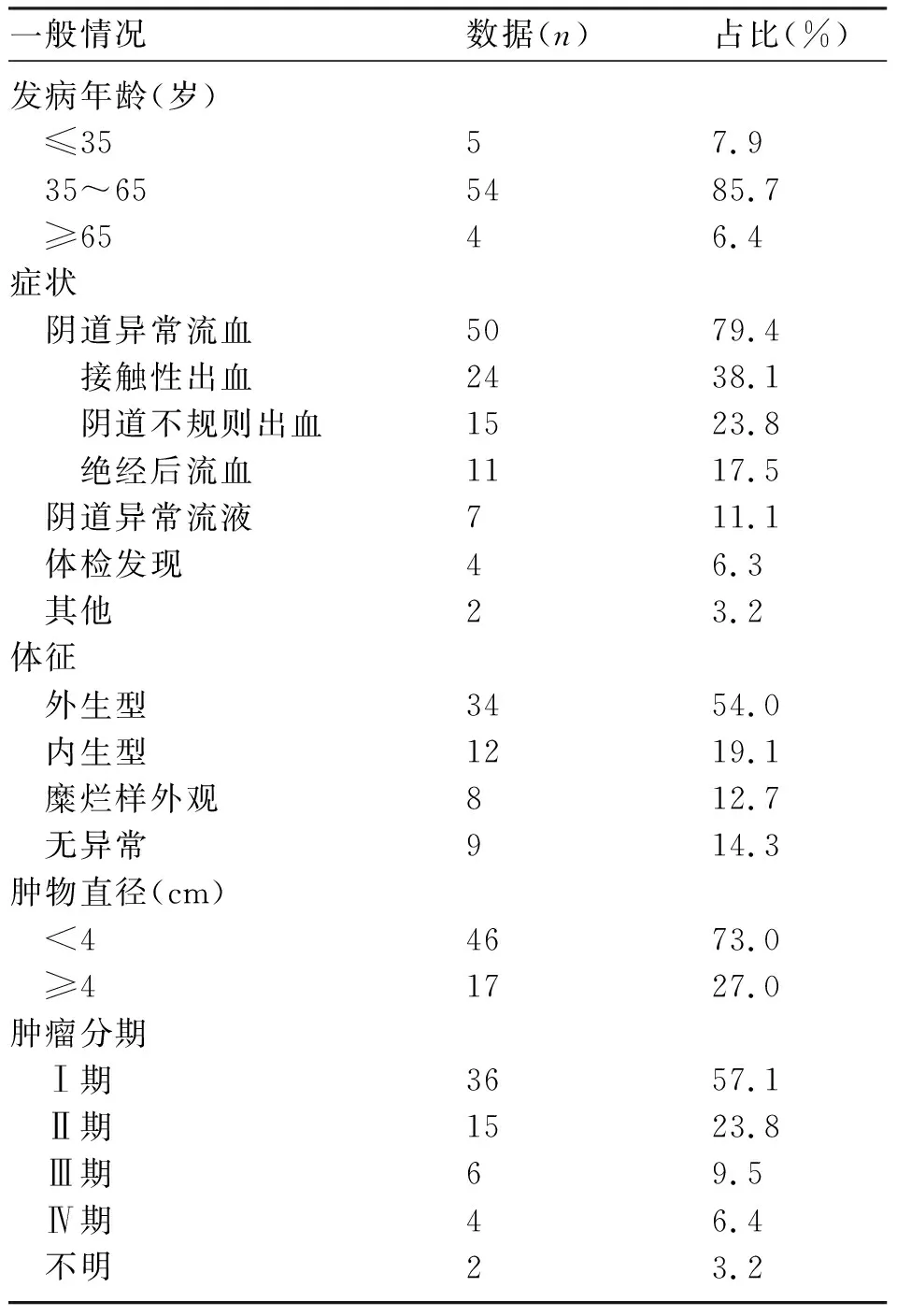
表1 患者的一般资料及临床表现(n=63)
2.2 临床表现
2.2.1 症状 首发症状为阴道异常流血者50例(79.37%),阴道异常流液者有7例(11.11%),体检发现宫颈病变者4例(6.35%),2例分别以自觉下腹包块、下腹痛为首发症状。5例伴随体重明显下降,5例伴随下腹胀痛,3例伴随腰部胀痛,3例伴随大小便异常。
2.2.2 体征 34例(53.97%)表现为宫颈菜花样肿物(外生型);12例(19.05%)表现为颈管增粗变硬,呈桶状外观(内生型);8例(12.70%)表现为糜烂样外观;9例(14.29%)宫颈表面光滑无异常。
2.3 辅助检查
2.3.1 HPV、TCT、肿瘤标志物 15例(28.31%)患者HPV检查提示高危型阳性,包括7例HPV16+,5例HPV18+,4例HPV52+,2例HPV33+,其中1例HPV18/52+,1例HPV18/52/33+;21例(33.33%)术前TCT提示异常,包括11例ASCUS,6例HSIL,3例CIN1,1例VPA。肿瘤标志物检查中,6例CA125升高(5例为CCAC,最大值172.1ng/mL),5例SCC升高(最大值13.6U/mL),4例CA724升高,3例NSE升高,2例CA199升高,2例细胞角蛋白19片段升高,1例HE4升高,1例CEA升高。
2.3.2 影像学检查 36例行全腹增强CT检查,其中14例提示淋巴结肿大,4例(28.57%)术后病理确定淋巴结转移。21例行增强MRI检查,其中7例提示淋巴结肿大,3例(42.86%)术后病理确定淋巴结转移。20例行PET-CT检查,其中4例提示淋巴结肿大,2例(50%)术后病理确定淋巴结转移。分别将术前3种影像学检查提示LN转移情况与术后石蜡病理进行一致性检验,见表2。
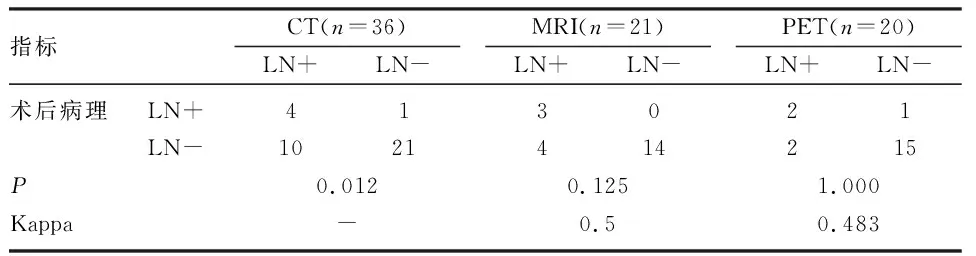
表2 术前CT、MRI、PET与术后病理一致性检验
2.4 免疫组化 21例CCAC患者中15例行免疫组化检查,其中13例(86.7%)NapsinA(+);12例(80%)HNF1β(+);10例(66.7%)Ki-67(+);10例(66.7%)p53(+);9例(60%)PAX8(+);8例(53.3%)ER(+);8例(53.3%)p16(+);7例(46.7%)Vimentin(+);4例(26.67%)PR(+);2例(26.67%)P504S(+);1例(6.67%)WT-1(+);1例LCA(+);1例CK7、BCL-2、CEA、EMA(+);1例CK8/18(+);1例MLH1、PMS2、MSH6、MSH2(+)。其中,NapsinA阳性表达率最高,>85%,高于其他分子标记物,HNF1β、Ki-67、p53表达均>60%(表3)。

表3 CCAC相关分子标记物的表达情况(n=15)
2.5 治疗及预后
2.5.1 单纯手术治疗 34例仅接受手术治疗,其中1例妊娠期VPA(Ⅰa1期)患者,剖宫产同时行肿物切除术,术后未复发;1例VPA(Ⅰb2期)患者行开腹宫颈癌根治术,术后5个月发生骨转移;3例(1例Ⅰb1期CCAC,1例Ⅰb2期VPA,1例Ⅰb2期MDA)患者行腹腔镜根治术,预后良好;1例VPA(Ⅱa1期)行阴式根治术,预后良好。
2.5.2 手术、放(化)疗 24例接受手术+放(化)疗,3例仅接受放(化)疗。放疗采取盆腔内外联合照射,总剂量40~60Gy;化疗采用铂类及紫杉醇为基础的联合化疗。17例(17/24)术后行同步放化疗的患者中,疾病进展者5例;3例(3/24)行新辅助化疗的患者中,1例MDA(Ⅱb期)失访;1例MDA(Ⅲc1期)死亡;1例CCAC(Ⅲc1期)至随访结束未复发。3例未行手术治疗的患者中,1例CCAC(Ⅳb 期)患者,未婚未育无性生活史,仅接受同步放化疗后行12次免疫治疗(艾瑞卡PD-1,200mg+天晴依泰4mg),至随访结束(14个月)仍存活。
2.5.3 预后 K-M分析结果显示,产次、肿瘤大小、肌层浸润深度、肿瘤分期、是否存在合并症及淋巴转移、治疗方案是影响预后的相关因素,差异有统计学意义(P<0.05)。进一步对疾病分期及不同治疗方案进行生存分析,Ⅰ、Ⅱ期与Ⅲ、Ⅳ期患者的预后比较,差异有统计学意义(P<0.05),但Ⅰ期与Ⅱ期,Ⅲ期与Ⅳ期之间无差异;仅接受手术治疗与新辅助治疗、仅接受放(化)疗对疾病预后有影响(P<0.05),但仅接受手术治疗与手术+放(化)疗对疾病预后无明显影响。见表4、图1。

表4 相关影响因素的K-M分析(n=55)

图1 K-M生存曲线
2.6 随访 8例失访,其余55例患者均进行电话随访,截至2021年11月观察终点,其中疾病进展11例,死亡10例(Ⅰ期2例,Ⅱ期2例,Ⅲ期3例,Ⅳ期3例),中位总生存期(overall survival,OS)为58个月,中位无进展生存期(progression-free survival,PFS)为53个月,总体第1、5年累积生存率分别为98.18%、83.64%。
3 讨 论
国际子宫颈腺癌标准和分类(International Endocervical Adenocarcinoma Criteria and Classification,IECC)将宫颈腺癌分为HPV相关型(HPVA)和非HPV相关型(NHPVA)2大类[5],具体包括普通型(HPVA)(73%),胃型(NHPVA)(10%),HPVA黏液型(9%),透明细胞型(NHPVA)及非特指类型(绒毛管状腺癌,中肾管腺癌,子宫内膜样癌,浆液性癌等)[6]。HPVA组包含黏液性、肠型、绒毛管状腺癌等;NHPVA组包含浆液性、胃型、透明细胞型、中肾管腺癌等[4]。其中胃型腺癌(gastric-type endocervical adenocarcinoma,G-EAC)是NHPVA型腺癌中最常见的类型[7],微偏腺癌(MDA)是其高分化形式。本文涉及绒毛管状腺癌(HPVA),微偏腺癌(NHPVA),透明细胞癌(NHPVA)以及中肾管腺癌(NHPVA)。
不同类型腺癌的HPV阳性率有明显差异,随着宫颈癌筛查和HPV疫苗的普及,常见的HPVA发病率大幅降低[8]。在特殊类型腺癌中,相当部分患者的发病与HPV感染无关[9-10]。本组63例患者中,15例(28.31%)HPV检查阳性,其中HPVA有12例(VPA),NHPVA有3例(2例MDA,1例CCAC),与既往研究相符。宫颈癌的发生还可能与生育及性生活情况相关,除常见的多育、性生活过早过频等情况,本组1例Ⅳ期CCAC患者未婚未育,无性生活史,提示临床工作中不应忽视此类患者患病的可能。
对于特殊类型宫颈腺癌的诊断,需结合影像学、血清学、组织病理学等综合判断。影像学检查方面,盆腔MRI检查的意义重大,有利于观察评价肿块生长、浸润及转移情况,在判断间质浸润深度方面有独特优势[11]。MRI在胃型黏液性病变的鉴别诊断方面具有一定的特异性,病灶可表现为“宇宙征”,即中央为较小的囊实性病灶,周围被较大囊肿包绕,T1WI序列多呈低信号,T2WI序列呈高信号[12]。本文分别将CT、MR、PET与术后病理进行一致性检验,MR和PET与病理结果一致,且MR一致性高于PET。本研究认为,盆腔MRI对于疾病的诊断价值较高,与既往研究结论相符[13]。
对于肿瘤标志物的检查,既往研究中约1/3 G-EAC患者CA125升高,提示存在盆腹腔转移[14]。本研究CA125升高多出现在CCAC患者中,表明CA125可能是对CCAC诊断有意义的肿瘤标志物[15],仍有待更大样本病例资料的验证。免疫组化对于不同类型腺癌的鉴别有重要意义。G-EAC患者中,50%可发生p53突变[16];Ki-67阳性率通常<40%;ER、PR表达多为阴性;CK7、CA125、CA199、HNF1β、CAIX、CDX2、CK20、PAX8、CEA等可呈阳性表达,其中PAX8阳性率可达68%~80%;STK11、TP53、POLE、CDKN2A/B、KRAS、BRCA2、ARID1A和错配修复基因等变异也可在散发性肿瘤中检测到[17]。VPA患者中,Ki-67、P16、CEA常呈高表达;p53、Vim、ER阳性表达也有助于辅助诊断[18]。MNA患者中,CK、Vimentin、CD10、calretinin多广泛表达;EMA、ER染色常为阴性;GATA3、TTF1、HER2染色可呈阳性[19]。既往对女性生殖系统透明细胞癌的研究发现,CK7、beta E12、CEA、Leu-M1、Vimentin、bcl-2 p53、CA125、ER、HER-2/neu不同程度地呈阳性表达[20-21]。本研究对CCAC患者的病理组织进行免疫组化分析,Napsin A、HNF-1β阳性表达率明显高于其他分子标记物,提示对于CCAC的诊断可能存在特异性;PAX8、Vimentin亦有阳性表达,对于诊断存在可能的临床价值。
对于特殊类型腺癌,目前尚无统一规范的治疗标准。HPVA治疗多同于普通腺癌,如本研究所涉及的VPA少有侵袭性[22],治疗方案倾向于保守。对于NHPVA:(1)G-EAC易侵犯神经和脉管而发生远处转移,对放化疗不敏感[23-25]。根据2021版专家共识,早期患者首选手术治疗,术中应全面探查盆腹腔,建议行双侧附件、大网膜、阑尾及盆腹腔内病变切除[26]。因其有与小细胞神经内分泌癌相似的生物学行为,NCCN(2021)指南认为无论首选手术或放疗,所有患者均应补充化疗[27]。(2)对于CCAC,治疗以手术为主,早期患者多行广泛的全子宫+盆(腹)腔淋巴结切除术,晚期及不适合手术者多行放(化)疗。目前CCAC术后的放化疗疗效尚不确定,Ablavi等[28]肯定了紫杉醇、卡铂、贝伐珠单抗等化疗方案的有效性及安全性。Wang等[20]研究也认为高风险患者术后接受放化疗是有益的。(3)对于MNA,其生物学行为尚不清楚,早期患者仍以手术治疗为主。Dierickx等[29]认为早期患者术后是否接受放化疗对于疾病复发情况无显著影响,而具有梭形细胞成分的肿瘤诊断期别往往较晚,预后较差。Ditto等则认为新辅助化疗是有效的。本研究生存分析显示,疾病分期及治疗方案对预后有影响,Ⅰ、Ⅱ期与Ⅲ、Ⅳ期总体预后有统计学差异;但Ⅰ期与Ⅱ期,Ⅲ期与Ⅳ期预后无明显统计学差异;仅接受手术治疗与仅接受放(化)疗对于疾病预后有影响,但仅接受手术治疗与接受手术+放(化)疗对于预后无明显影响,提示手术可能仍是更有效的治疗方式,放化疗对于特殊类型腺癌患者预后的有效性尚不确定。受疾病类型和病例数的限制,本研究具有一定的局限性,仍有待大样本数据进行支持。
在特殊类型腺癌中,VPA(HPVA)具有分化好,浸润深度浅,少有淋巴结转移等惰性生物学行为,预后相对较好,少有复发;而NHPVA复发率较高[30],淋巴结及卵巢转移率也较高[31],对放化疗敏感性差,预后较差。本研究单因素分析结果显示,产次、病灶大小、浸润深度、是否存在合并症、病理分期、是否存在淋巴转移、治疗方案是影响疾病进展及生存的因素;而年龄、病理类型、是否行放化疗对预后影响无明显差别。本组死亡患者10例,总体第1、5年累积生存率分别为98.18%、83.64%,生存率高于既往报道,与既往研究认为特殊类型腺癌恶性程度高、预后差的观点不一致。
目前妊娠合并特殊腺癌的病例极其少见,缺乏相关诊治经验。本研究中1例Ⅰa1期VPA患者于妊娠39周产检发现宫颈赘生物,剖宫产同时行宫颈赘生物切除术,术后石蜡病理提示宫颈高分化绒毛管状原位腺癌,产后行宫颈锥切术,后未进行后续治疗,至随访结束疾病未复发,佐证了早期VPA预后良好[22],可保留生育功能的观点。受妊娠期孕妇体内激素水平的影响,宫颈形态易发生改变,在诊断上应格外谨慎,对于妊娠期可疑宫颈病变的患者应进行病理检查。在治疗上应根据具体孕周、病变分期等情况,进行全面严格的评估,制定个体化的综合治疗方案[32]。
综上所述,考虑宫颈腺癌类型复杂,病变部位隐匿、复发转移率高、放疗敏感性差等特点,应综合考虑患者年龄、生育要求、疾病风险等情况选择最佳的治疗方案。在临床工作中,对于常规宫颈癌筛查为阴性而可疑恶性病变的患者,应考虑到特殊类型腺癌的可能,同时借助影像学及免疫组化进行鉴别,尽早诊断及治疗,改善患者预后。对于年轻早期女性患者,可否保留卵巢,以及妊娠期患者的治疗,仍需大样本的临床数据进行分析,需多中心的研究机构联合协作,共同努力。
