凝固酶阴性葡萄球菌致新生儿败血症病原学及青霉素联合万古霉素治疗效果分析
2022-07-27苌俊明别静洋李德亮王海云
赵 杰,朱 萍,苌俊明,别静洋,李德亮,王海云,杨 柳
(南阳市中心医院/郑州大学附属南阳中心医院新生儿重症监护病区,河南 南阳 473005)
新生儿败血症主要是由致病菌和条件致病菌等各种病原微生物侵入血液循环,在血液循环内生长繁殖继而产生毒素,从而导致全身感染和脓毒血症[1-2]。新生儿各系统发育尚不完善,免疫力较为低下,因此,新生儿败血症是新生儿期的危重急症,若诊断不及时或者治疗不恰当会导致不良预后,甚至新生儿死亡,其病死率高达11%~30%[3]。新生儿败血症的主要致病菌是凝固酶阴性葡萄球菌(coagulase-negativeStaphylococci,CNS),CNS毒力较强,可导致皮肤感染、呼吸道感染等。新生儿感染CNS后,临床症状不典型,但病情发展却十分迅速,若不能给予及时有效的治疗,可能会导致新生儿死亡[4]。CNS导致的新生儿败血症通常采取抗菌药物治疗,在病原菌尚未明确时,多采用抗菌药物联合治疗;经过血培养检测后,可根据药物敏感试验结果选择合适的抗菌药物进行治疗。近年来,CNS具有多重耐药性及较高的耐药率。因此,根据病原菌选取合适的抗菌药物进行治疗十分重要。万古霉素是糖肽类的抗菌药物,抗菌效果强且不良反应较小,其抗耐药菌效果显著[5]。本研究旨在探讨CNS致新生儿败血症的病原菌分布和耐药性,以及青霉素联合万古霉素治疗CNS致新生儿败血症的临床效果,以期为CNS致新生儿败血症抗菌药物的合理使用提供参考。
1 资料与方法
1.1 一般资料选择2019年1 月至2020年12月南阳市中心医院收治的185例CNS致新生儿败血症患儿为研究对象,其中男103例,女82例;胎龄36~42周,出生日龄1~22 d,出生体质量2 400~3 600 g;分娩方式:顺产123例,剖宫产62例。病例纳入标准:(1)符合《新生儿败血症诊疗方案》[6]中败血症诊断标准;(2)经痰培养或者血培养确诊为CNS致新生儿败血症。排除标准:(1)有先天性免疫功能障碍;(2)出生有严重缺陷,如严重心肺功能不全;(3)对青霉素、万古霉素等药物过敏者。按照治疗方法将患儿分为对照组(n=91)和观察组(n=94)。2组患儿的性别、胎龄、分娩方式、出生日龄、出生体质量比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究获得医院伦理委员会审核批准,患儿家属知情同意并签署知情同意书。

表1 2组患儿治疗前基线资料比较
1.2 治疗方法对照组患儿给予注射用青霉素钠(哈药集团制药总厂,国药准字H23021439)50 000 U·kg-1,静脉滴注,出生7 d 内每12 h 1次,出生第7天后每8 h 1次。观察组患儿在对照组基础上给予万古霉素(浙江海正药业股份有限公司,国药准字H20084268)治疗,第1天给予15 mg·kg-1,静脉滴注,滴注时间>1 h,每日1次;第2天开始给予10 mg·kg-1,静脉滴注,滴注时间>1 h,每日1次。2组患儿均治疗14 d。
1.3 观察指标
1.3.1 CNS病原菌分布及耐药性治疗前抽取患儿静脉血3 mL,置于儿童增菌培养瓶中,将其充分混匀,于BacT/Alert 3D全自动血培养仪(法国梅里埃公司)增菌,温度设为35 ℃,在阳性报警后取出,然后进行细菌分离培养,采用VITEK 2 Compact 全自动细菌鉴定及药物敏感性分析系统(法国梅里埃公司)进行菌种鉴定和药物敏感性分析。
1.3.2 临床疗效治疗14 d后,根据《抗菌药物临床研究指导原则》[7]对2组患儿进行临床疗效评定。痊愈:患儿的所有临床症状以及各项指标均完全恢复正常;显效:患儿病情明显好转但临床症状以及各项指标未完全恢复正常;有效:患儿病情部分好转但不明显,临床症状以及各项指标尚未完全恢复正常;无效:患儿的所有临床症状以及各项指标在治疗前后无明显变化,病原学检查与治疗前比较无明显变化。治疗总有效率=(痊愈例数+显效例数+有效例数)/总例数×100%。
1.3.3 不良反应发生情况在患儿治疗期间记录恶心呕吐、腹泻、皮疹、静脉炎等不良反应发生例数,不良反应发生率=不良反应发生例数/总例数×100%。
1.3.4 免疫功能指标和炎症指标分别于治疗前后采集患儿外周静脉血3 mL。应用美国BD公司FACSCanto型流式细胞仪检测全血自然杀伤(natural killer,NK)细胞活性,应用深圳迈瑞BC-5000型全自动血液细胞分析仪进行白细胞(white blood cell,WBC)计数。将外周静脉血3 000 r·min-1离心10 min,取上层血清-70 ℃保存,应用美国贝克曼库尔特公司AU5800型全自动生物化学分析系统检测血清免疫球蛋白(immunoglobulin,Ig)G、IgM水平;采用酶联免疫吸附法检测血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-8、C 反应蛋白(C-reactive protein,CRP)水平;试剂盒购自上海晶抗生物工程有限公司,严格按试剂盒说明书操作。
2 结果
2.1 新生儿败血症患儿CNS检出情况结果见表2。185例新生儿败血症患儿中,构成比前3位的CNS分别为表皮葡萄球菌、溶血葡萄球菌、人葡萄球菌,占比分别为40.54%(75/185)、28.11%(52/185)、14.05%(26/185)。

表2 185例新生儿败血症患儿CNS分布情况
2.2 表皮葡萄球菌、溶血葡萄球菌和人葡萄球菌对常见抗菌药物的耐药性结果见表3。表皮葡萄球菌对青霉素、氨苄西林、苯唑西林的耐药性分别为100.00%、97.33%、92.00%,对替考拉宁、万古霉素的敏感性均达100.00%;溶血葡萄球菌对青霉素、氨苄西林、苯唑西林、头孢曲松、红霉素的耐药性分别为100.00%、100.00%、96.15%、94.23%、92.31%,对替考拉宁、万古霉素敏感,敏感性均达100.00%;人葡萄球菌对青霉素、氨苄西林的耐药性分别为100.00%、92.31%,对替考拉宁、万古霉素敏感,敏感性均达100.00%。

表3 表皮葡萄球菌、溶血葡萄球菌、人葡萄球菌对常见抗菌药物耐药性
2.3 2组患儿临床疗效及不良反应比较结果见表4。治疗后,观察组患儿的临床疗效优于对照组(Z=30.179,P<0.05)。观察组和对照组患儿的治疗总有效率分别为98.94%(93/94)、89.01%(81/91);观察组患儿的治疗总有效率显著高于对照组,差异有统计学意义(χ2=8.145,P<0.05)。观察组和对照组患儿的不良反应发生率分别为19.15%(18/94)、18.68%(17/91);观察组与对照组患儿的不良反应发生率比较差异无统计学意义(χ2=0.007,P>0.05)。

表4 2组患儿的临床疗效及不良反应发生情况比较
2.4 2组患儿免疫功能指标比较结果见表5。2组患儿治疗前血清IgG、IgM水平和NK细胞活性比较差异无统计学意义(P>0.05);2组患儿治疗后血清IgG水平和NK细胞活性显著高于治疗前,血清IgM水平显著低于治疗前,差异有统计学意义(P<0.05);治疗后,观察组患儿血清IgG水平和NK细胞活性显著高于对照组,血清IgM水平显著低于对照组,差异有统计学意义(P<0.05)。
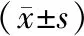
表5 2组患儿治疗前后免疫功能指标比较
2.5 2组患儿血清TNF-α、IL-6、IL-8、CRP水平及WBC计数比较结果见表6。2组患儿治疗前血清TNF-α、IL-6、IL-8、CRP水平及WBC计数比较差异均无统计学意义(P>0.05);治疗后,2组患儿血清TNF-α、IL-6、IL-8、CRP水平及WBC计数显著低于治疗前,观察组患儿血清TNF-α、IL-6、IL-8、CRP水平显著低于对照组,差异有统计学意义(P<0.05);观察组与对照组患儿治疗后WBC计数比较差异无统计学意义(P>0.05)。
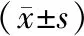
表6 2组患儿血清TNF-α、IL-6、IL-8、CRP水平及WBC计数比较
3 讨论
CNS属于条件致病菌,具有较强的耐药性和致病性。CNS含有的致病因子,如黏质会产生黏附素,而黏附素具有较强的黏附作用,使CNS容易在一次性输血袋、输液器、注射器等物体的表面滞留[8]。既往认为,CNS是在黏膜和皮肤共存的非致病菌,其产生的黏质物能够促进CNS黏附和定植,还能够阻止抗菌药物对细菌的渗透,从而发挥物理屏障作用;同时黏质物还具有抗吞噬作用,在CNS耐药性和致病性中起到重要作用[9]。新生儿的免疫功能较为低下,即使对较低毒力的条件致病菌也易发生感染;危重症、早产儿在抢救过程中常采用机械通气、静脉置管等侵入性诊疗措施,导致新生儿的天然屏障被破坏,使其免疫功能进一步受到损害,从而更易感染CNS[10]。近年来,新生儿败血症的致病菌中条件致病菌呈明显升高趋势,尤其是CNS已成为新生儿败血症患儿血培养的首位检出菌。黏质物与生物膜的形成及细菌生物膜的耐药密切相关。细胞外黏质物是毒力因子的标志物,其包绕于菌体外层,能增强细菌对某些抗菌药物的耐受性;已发现产细胞外黏质物的CNS不但对甲氧苯青霉素、庆大霉素、氯林可霉素、红霉素等药物的耐药性增加,而且呈多元耐药性的趋势[11]。因此,探讨新生儿败血症各种CNS菌种的分布情况及耐药性,对临床治疗CNS导致的新生儿败血症具有重要意义。
CNS包括表皮葡萄球菌、溶血葡萄球菌、人葡萄球菌等,常定植于人体皮肤表面及阴道、直肠腔道等部位,正常情况不会对人体产生危害,然而当其进入非正常部位及人体免疫系统功能低下时,则易成为感染病原体而导致人体感染,同时此类病原菌较易产生耐药性,且为多重耐药性,使抗生素治疗效果较差。本研究结果显示,新生儿败血症的CNS以表皮葡萄球菌、溶血葡萄球菌、人葡萄球菌为主,构成比分别为40.54%、28.11%、14.05%;药物敏感性试验结果显示,表皮葡萄球菌对青霉素、氨苄西林、苯唑西林的耐药性高,对替考拉宁、万古霉素敏感;溶血葡萄球菌对青霉素、氨苄西林、苯唑西林、头孢曲松、红霉素的耐药性高,对替考拉宁、万古霉素敏感;人葡萄球菌对青霉素、氨苄西林的耐药性高,对替考拉宁、万古霉素敏感。由此可知,本研究中3种CNS均表现出对青霉素、氨苄西林的高耐药性以及对替考拉宁、万古霉素的高敏感性。因此,建议新生儿败血症患儿可根据此药物敏感性试验结果选择替考拉宁、万古霉素治疗。
万古霉素是肽聚糖类的抗生素,会对致病菌细胞壁的肽聚糖造成干扰,使细胞壁的磷脂以及多肽合成减少,抑制细胞壁的合成,继而抑制细菌的生长以及增殖,最终对细菌起到有效杀灭作用[12]。万古霉素对CNS、金黄色葡萄球菌等葡萄球菌具有较强的抗菌作用,且耐药性低,耐药株也相对较少,在其他抗菌药物对致病菌治疗效果不佳甚至是没有效果时,给予万古霉素治疗往往效果较好[13]。万古霉素的半衰期相对较短,在静脉滴注后能够快速被吸收,分布到机体的各个组织,既可改变致病菌细胞膜的通透性,也可抑制其RNA的合成,具有较强的杀菌作用[14]。本研究结果显示,观察组患儿的临床疗效优于对照组,且2组患儿的不良反应发生率比较差异无统计学意义,提示使用万古霉素不仅能提高对患儿体内的CNS的抑制作用,改善患儿症状,同时不增加患儿不良反应发生,具有良好的安全性。
在机体受到致病菌感染时,IgG、IgM、NK细胞活性在机体的免疫应答中起到重要作用,可反映机体的抗感染能力;TNF-α、IL-6、IL-8、WBC、CRP是与免疫应答有关的炎症因子,反映机体的感染程度;提高免疫功能相关因子的表达,降低炎症因子的表达,对CNS致新生儿败血症的治疗十分重要。IgG分布于组织液以及血清中,可抗细菌以及病毒感染;IgM有较强的细胞毒性以及细胞溶解性,在机体受到抗原刺激后会最早出现;NK细胞在细胞受到感染时会进行非特异性杀灭,是机体重要的免疫细胞,可起到抗病毒感染和免疫调节作用[15-16]。TNF-α能够调节机体的免疫能力,强化巨噬细胞的吞噬作用,增加血管内皮细胞的通透性,并诱导其他炎症因子的产生,形成级联放大反应从而加重感染;IL-6能够对多种细胞的分化以及生长起到调节作用,对免疫应答有调节作用,在机体抗感染的免疫应答中具有重要作用;IL-8是趋化细胞,由单核-巨噬细胞等产生,对中性粒细胞产生趋化作用,调控炎症反应,释放溶酶体酶和氧自由基,在发生感染后水平快速升高;WBC水平是判断机体是否感染的常用指标,受到影响的因素很多,因此个体差异也相对较大;CRP是急性时相蛋白,在机体出现炎症,尤其是发生细菌感染时,肝脏合成CRP明显增加[17-18]。因此,炎症因子TNF-α、IL-6、IL-8、CRP水平及WBC水平越低,提示炎症被控制的越好,患儿的预后越好。本研究结果显示,2组患儿治疗前血清IgG、IgM水平和NK细胞活性比较差异无统计学意义;2组患儿治疗后血清IgG水平和NK细胞活性显著高于治疗前,血清IgM水平显著低于治疗前;治疗后,观察组患儿血清IgG水平和NK细胞活性显著高于对照组,血清IgM水平显著低于对照组;2组患儿治疗前血清TNF-α、IL-6、IL-8、CRP水平及WBC计数比较差异均无统计学意义;治疗后,2组患儿血清TNF-α、IL-6、IL-8、CRP水平及WBC计数显著低于治疗前,观察组患儿血清TNF-α、IL-6、IL-8、CRP水平显著低于对照组;治疗后,观察组与对照组患儿WBC计数比较差异无统计学意义。本研究结果表明,对CNS致新生儿败血症患儿给予万古霉素联合青霉素治疗可更有效提高免疫功能,降低炎症反应,从而更有效地改善临床症状。
综上所述,CNS致新生儿败血症的病原菌以表皮葡萄球菌、溶血葡萄球菌、人葡萄球菌为主,3种病原菌均对万古霉素敏感;对CNS致新生儿败血症患儿给予万古霉素联合青霉素治疗可更有效提高机体免疫功能,降低炎症反应,提高临床疗效,其治疗效果优于单独给予青霉素治疗。因此,对于CNS致新生儿败血症患儿,需根据血培养药敏试验结果给予合理有效的抗生素治疗,从而提高治愈率,改善患儿的预后。
