Cl–浓度对阳极氧化5A06铝合金/1Cr18Ni9Ti不锈钢偶接件腐蚀行为的影响
2022-07-27梁明辉吴向清谢发勤李正何鹏贺栋栋王少青
梁明辉,吴向清,谢发勤,李正,何鹏,贺栋栋,王少青
腐蚀与防护
Cl–浓度对阳极氧化5A06铝合金/1Cr18Ni9Ti不锈钢偶接件腐蚀行为的影响
梁明辉1,吴向清1,谢发勤1,李正2,何鹏1,贺栋栋1,王少青1
(1.西北工业大学 民航学院,西安 710072;2.西北工业大学 无人机特种技术重点实验室,西安 710065)
研究阳极氧化铝合金/1Cr18Ni9Ti不锈钢偶接的电偶腐蚀机理及Cl–浓度对其腐蚀行为的影响规律,为铝合金在不同服役环境中的腐蚀与防护提供依据。通过电偶腐蚀实验,在不同Cl–浓度下偶接阳极氧化5A06铝合金和1Cr18Ni9Ti不锈钢,根据腐蚀电流的变化规律分析、表面腐蚀形貌与成分的表征、并结合电化学测试,分析了Cl–浓度对阳极氧化5A06铝合金的电偶腐蚀行为的影响。随着腐蚀时间的延长,电偶电流呈现锯齿状波动,总体表现为由高到低逐渐趋于稳定。电偶电流随着Cl–质量分数的变化表现为3.5%>5%>2%>6.5%>8%>0.5%,且当Cl–质量分数为3.5%时电偶电流最大为16.56 μA/cm2。电偶腐蚀过程中5A06铝合金阳极氧化膜表面的腐蚀产物对点蚀坑产生堵塞,阻碍了溶液中Cl–进一步和基体发生反应,阳极氧化膜表现为破坏—修复—破坏的循环往复过程;溶液中Cl–既可以促进铝合金阳极氧化膜的溶解,增加铝合金电偶腐蚀的敏感性,也会降低溶液中溶解氧的浓度从而抑制阳极反应发生。当Cl–质量分数<3.5%时其促进溶解作用大于抑制反应作用,而当Cl–质量分数>3.5%时其抑制反应作用大于促进溶解作用,因此电偶腐蚀速率随着Cl–浓度的增大呈现先增大后减小的规律。
阳极氧化;5A06铝合金;电偶腐蚀;Cl–浓度;点蚀
铝合金由于其高比强度、优良的加工性能、良好的耐腐蚀性,被广泛应用于航空、航海、武器装备等各大领域[1-2]。尤其在减轻结构重量和船体维护方面具有显著优势[3],其中Al–Mg系5A06(高镁)铝合金具有良好的力学性能和成形性。适用于船舶制造的结构材料,在船舶的建造领域应用最广[4-6]。但海洋环境具有高盐碱、湿度大、富含Cl–的特点,恶劣的服役环境易诱发铝合金的点蚀、剥落腐蚀等多种腐蚀形式[7-8],因此在海洋环境中服役的铝合金通常都要经过适当的表面处理,以增强其耐蚀性。如表1所示,常见的铝合金表面处理技术例如电镀、化学镀、阳极氧化、微弧氧化等均能够有效提高铝合金的耐腐蚀性[9-15]。由于5xxx系铝合金主要运用于船舶结构,对硬度和耐磨性的要求较小,而对耐腐蚀性要求较高,故常常选用阳极氧化作为Al–Mg系铝合金的表面处理技术。
在实际工程应用中,铝合金经常与其他金属发生接触,在海洋环境中会产生电偶腐蚀。张晓云等[16]研究表明,0Cr13Ni8Mo2Al钢与铝合金接触时,铝合金会出现严重的电偶腐蚀;王玲等[17]、王莎莎等[18]研究发现,铝合金和钢偶接时会加速铝合金的腐蚀,与未偶接的铝合金相比腐蚀速率明显增加。此外,研究发现,不同的海水环境对铝合金的腐蚀行为影响很大。Cui等[19]、陈跃良等[20]研究发现Cl–浓度的变化对铝合金的电偶腐蚀行为会产生重要影响,而海水的总盐度则随着地区的不同而不同,在某些海区和隔离性的内海中,盐度都有较大的变化[21]。目前关于Cl–浓度对铝合金电偶腐蚀行为的研究大多聚焦在铝合金基体,针对阳极氧化后铝合金电偶腐蚀规律的研究还鲜有报道,而现阶段服役的铝合金几乎都需要经过阳极氧化处理。因此,研究不同Cl–浓度条件下阳极氧化5A06铝合金与1Cr18Ni9Ti不锈钢偶接后的电偶腐蚀行为和规律,对5A06铝合金结构的安全服役和防腐措施的实施具有重要意义,能够为铝合金在不同服役环境中的腐蚀与防护处理提供参考。
表1 铝合金不同表面处理方法对比
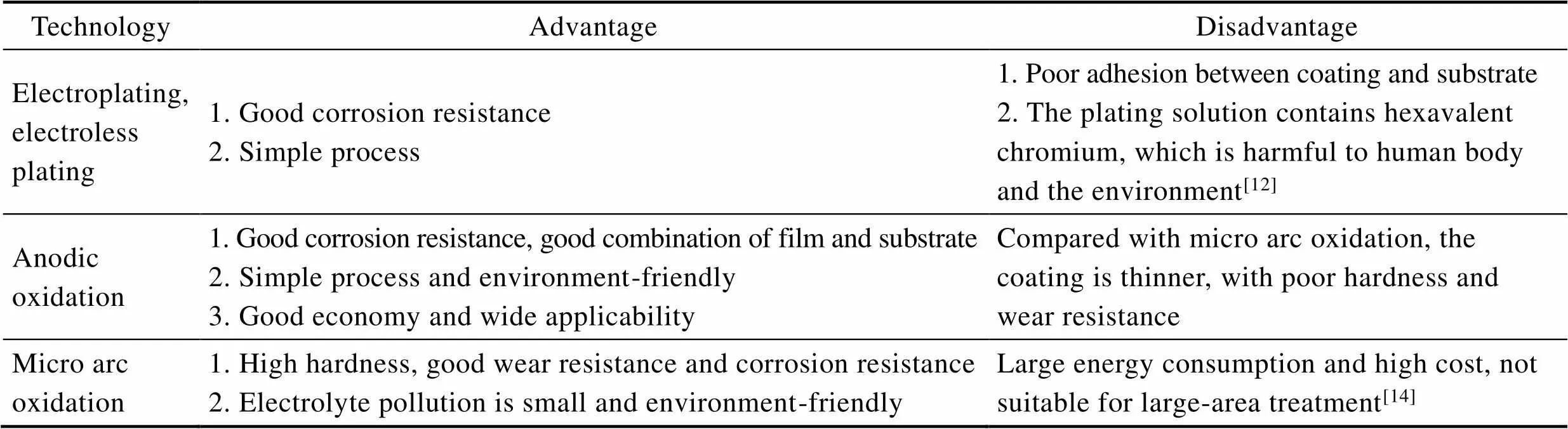
Tab.1 Comparison of different surface treatment methods of aluminum alloy
1 实验
1.1 材料
实验材料选用5A06铝合金和1Cr18Ni9Ti不锈钢,主要成分分别如表2和表3所示。按照航空工业标准HB5374加工5A06铝合金和1Cr18Ni9Ti钢试样,规格为110 mm×25 mm×3 mm。5A06铝合金试样表面经过打磨清洗后,进行硫酸阳极氧化处理,之后用重铬酸钾溶液进行封闭处理。
表2 5A06铝合金的化学成分

Tab.2 Chemical composition of 5A06 aluminum alloy wt.%
表3 1Cr18Ni9Ti不锈钢的化学成分
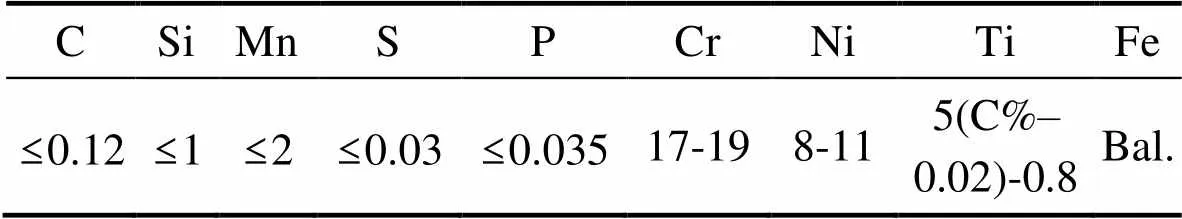
Tab.3 Chemical composition of 1Cr18Ni9Ti stainless steel wt.%
1.2 电偶腐蚀实验
按照工业标准ASTM G71—78进行,电偶对之间的间隙为5 mm,通过绝缘材料固定,电偶对通过铜片与导线连接,试样在溶液中的暴露面积均为25 mm2,电偶腐蚀示意图如图1所示。选择NaCl溶液中Cl–质量分数分别为0.5%、2%、3.5%、5%、6.5%、8%作为腐蚀溶液,并使用AR8406溶氧仪测定不同Cl–溶液的溶解氧含量。每组实验设置3组平行试样,试验时间为20 h,采用ARZ–2电偶腐蚀计测定电偶电流、电位差。腐蚀实验结束后,使用VEGA\ TESCAN型扫描电子显微镜(SEM)及能谱仪(EDS)对试样进行形貌和成分分析,采用二次电子成像,HV为20 kV。
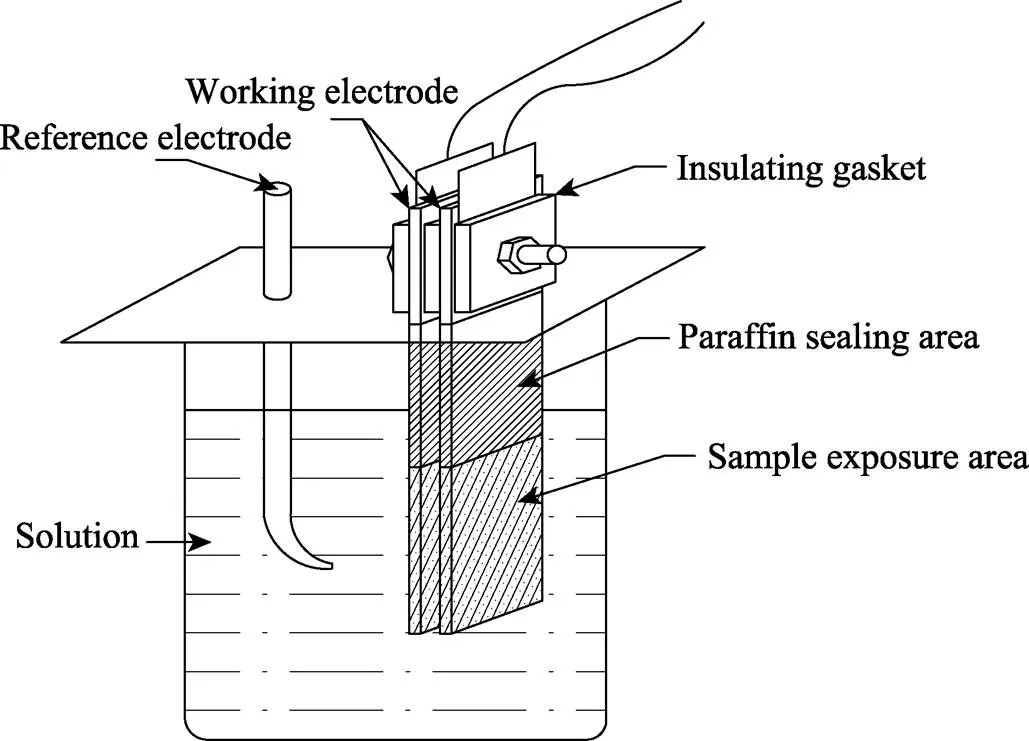
图1 电偶腐蚀试样连接示意图
1.3 电化学测试
使用PARSTAT 2273型电化学工作站进行阻抗谱(EIS)测试。采用经典的三电极体系,以电偶腐蚀20 h后的阳极氧化铝合金为工作电极,面积1 cm2,饱和甘汞电极作参比电极,Pt片作为辅助电极,测试溶液为中性环境中不同Cl–浓度的NaCl溶液,得到的数据用ZSimpWin软件进行分析。
2 结果与讨论
2.1 Cl–浓度对电偶电流的影响
图2为阳极氧化5A06铝合金和1Cr18Ni9Ti不锈钢偶接后不同Cl–浓度下的电偶腐蚀电流的变化曲线。由图2可见,3.5% Cl–下的电偶腐蚀电流最大,电偶腐蚀电流变化总体表现为锯齿状波动,随着腐蚀时间延长呈现出逐渐降低并趋于稳定的变化趋势,这是由于随着腐蚀反应过程的进行,电极表面被腐蚀产物所覆盖,导致阳极氧化膜层的孔隙减小,阻碍了电极过程的液相传质步骤,腐蚀过程由电子转移控制逐渐转变为氧扩散控制,造成了电偶腐蚀电流由大到小的变化趋势。
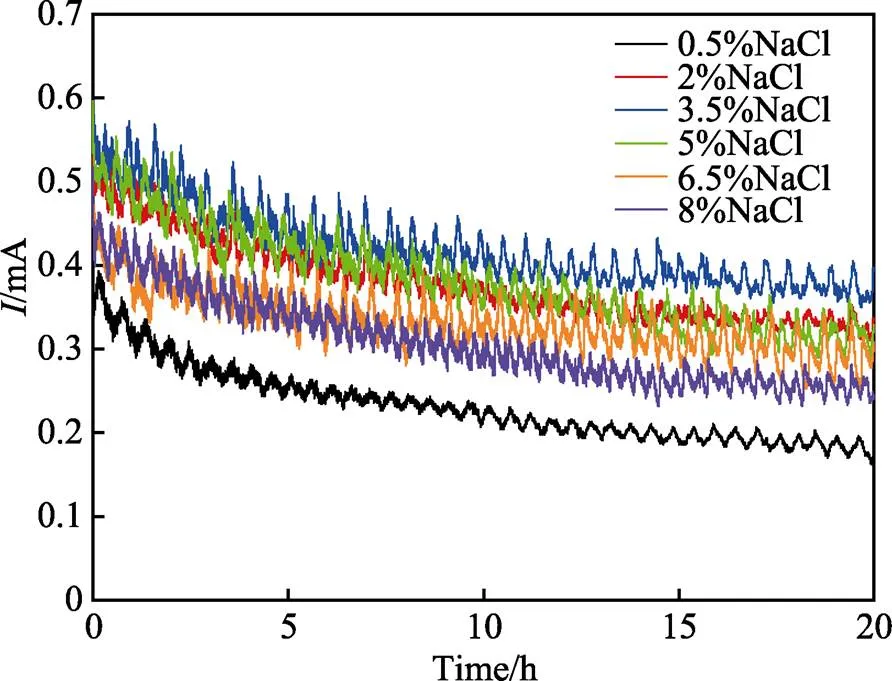
图2 阳极氧化铝合金和不锈钢在不同Cl–浓度下电偶腐蚀电流的变化曲线
图3为不同Cl–浓度条件下阳极氧化5A06铝合金和1Cr18Ni9Ti不锈钢偶接后的电偶腐蚀电流密度的变化。由图3可知,电偶腐蚀电流密度随着Cl–浓度增加呈现出先升高后降低的变化规律,当Cl–质量分数为3.5%时电偶腐蚀电流密度达到最大值,为16.56 μA/cm2。说明当Cl–质量分数低于3.5%时,Cl–浓度增大了铝合金电偶腐蚀的敏感性。但当Cl–质量分数超过3.5%后,随着Cl–浓度增加,电偶腐蚀电流反而降低。图4为通过溶氧仪测定的相同温度下不同Cl–浓度溶液中溶解氧的含量,可以看到Cl–浓度与溶解氧含量呈现负相关的关系,由此表明过高的Cl–浓度抑制了溶液中溶解氧的含量[22-23],间接抑制了偶接对中的阳极氧化反应的进行,此时Cl–浓度对电偶腐蚀电流的抑制作用大于促进作用,因此电偶腐蚀电流随着Cl–浓度的增大而降低。当Cl–质量分数为3.5%时,促进电偶腐蚀敏感性和抑制溶解氧含量的综合效果使电偶腐蚀电流密度达到最大值。
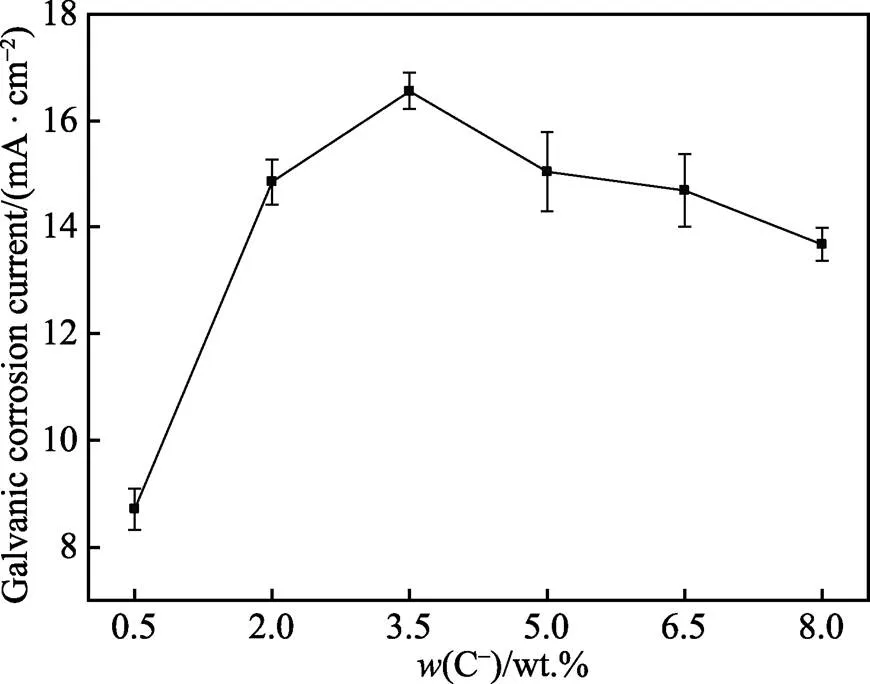
图3 电偶电流密度随Cl–浓度的变化曲线
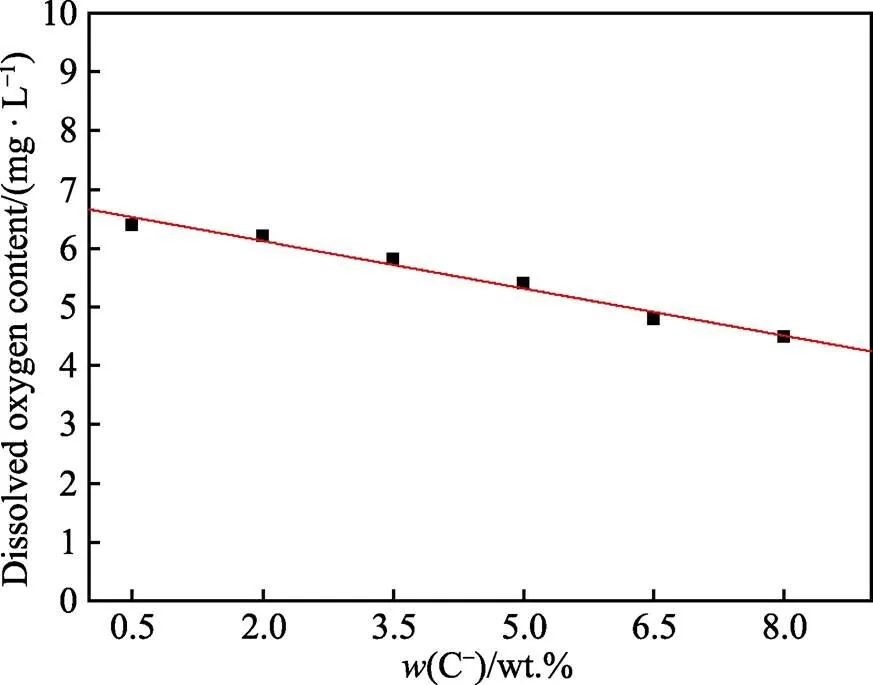
图4 溶解氧含量随Cl–浓度的变化曲线
2.2 Cl–浓度对电偶腐蚀电位的影响
表4为阳极氧化5A06铝合金和1Cr18Ni9Ti不锈钢在不同Cl–浓度条件下,偶接前和偶接20 h后的电偶电位。由表4可见,阳极氧化5A06铝合金的电极电位比1Cr18Ni9Ti不锈钢的电极电位负,因此偶接后阳极氧化铝合金作为阳极加速腐蚀,而不锈钢作为阴极受到保护。与此同时可以发现电偶腐蚀20 h后,阳极5A06和阴极1Cr18Ni9Ti的电极电位均出现不同程度的负移,说明阴阳极表面均出现了不同程度的腐蚀。
表4 阳极氧化铝合金和不锈钢偶接对在不同Cl–浓度下的电偶腐蚀电位
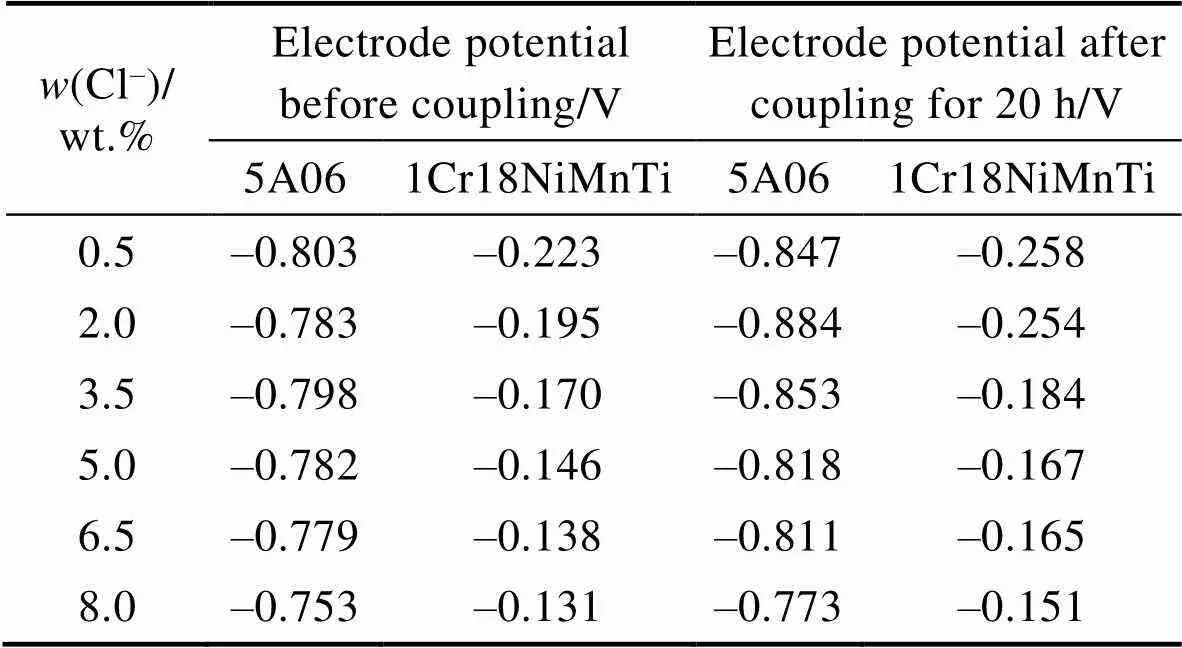
Tab.4 Galvanic corrosion potential of anodic aluminum alloy and stainless steel in different Cl– concentration
2.3 EIS分析
图5为不同Cl–浓度条件下偶接20 h后阳极氧化5A06铝合金试样的电化学阻抗谱。由图5a可见,Nyquist曲线由两个容抗弧组成,分别对应阳极氧化膜的双层结构。高频区的容抗弧反映出阳极氧化膜中多孔层的信息,不同Cl–浓度下电偶腐蚀后,试样在高频区容抗弧半径大小基本接近,说明5A06阳极氧化膜多孔层的阻抗不随Cl–浓度的变化而发生明显变化;而低频区的容抗弧则反映了阳极氧化膜阻挡层的信息,不同Cl–浓度下电偶腐蚀后,低频区容抗弧半径大小依次为0.5%>8%>6.5%>2%>5%>3.5%,说明当Cl–质量分数为3.5%时,氧化膜阻挡层的阻抗值最小,耐蚀性最差。此外,低频区容抗弧半径显著大于高频区容抗弧的半径,表明阳极氧化膜阻挡层的极化电阻远大于多孔层的极化电阻,阻挡层起主要的防腐蚀作用。由Bode图可以观察到两条曲线,如图5b所示,分别是相位角曲线和阻抗模值曲线,相位角曲线随频率的降低先减小后增大,相位角曲线在低频区和高频区分别存在两个波峰并与Nyquist图中的容抗弧相对应。

图5 阳极氧化5A06试样在不同Cl–浓度下偶接20 h后的电化学阻抗谱
上文提到的EIS拟合均是通过图6所示的等效电路进行,双时间常数EIS的电路码为()()。图中,s表示溶液电阻,p和b分别表示氧化膜多孔层和阻挡层的电阻;P和b为阳极氧化膜双电层的常相位角元件,即不完美电容,其阻抗可表示为CPE=[(j)]–1,其中j代表虚数单位,代表角频率,代表频率色散系数。由于多孔层和阻挡层不具有均匀性,多孔层和阻挡层处的非理想电容为恒定相位元素CPE,恒定相位元素用于解释各层性质的不规则性和变化,代表频散因子,范围为0~1,当=1时,CPE可被视为恒电容。
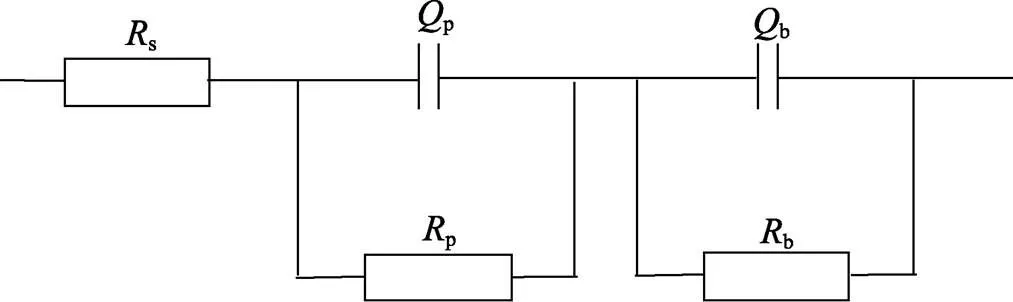
图6 拟合阳极氧化5A06铝合金试样EIS数据的等效电路
表5为EIS拟合后得到的电化学参数,由表可见,阳极氧化膜阻挡层的电阻值b比多孔层电阻值p高约1个数量级,说明阳极氧化膜中阻挡层起主要的防腐蚀作用。可以看到电偶腐蚀20 h后,阻挡层电阻值b随Cl–浓度变化的规律表现为0.5%>8%>6.5%> 2%>5%>3.5%,与电偶腐蚀电流的规律相一致(图2)。当Cl–质量分数为3.5%时,b最小,阻挡层的耐腐蚀性最差;而当Cl–质量分数为0.5%时,b最大,阻挡层的耐腐蚀性最好。
表5 EIS所得阳极氧化铝合金在不同Cl–浓度下偶接20 h后的电化学参数
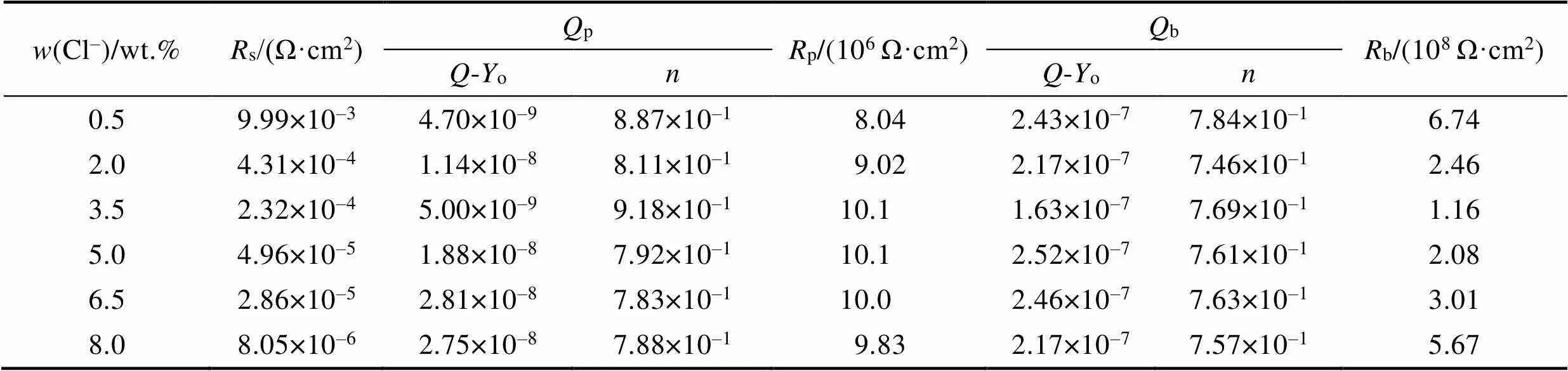
Tab.5 Electrochemical parameters of anodic aluminum alloy prepared by EIS after coupling in different Cl– concentrations for 20 h
2.4 腐蚀形貌及组成分析
图7为阳极氧化5A06铝合金原始试样和在不同Cl–浓度条件下电偶腐蚀20 h后试样的表面宏观形貌。由图7a—g可见,阳极氧化铝合金原始试样表面没有明显缺陷,在Cl–质量分数为0.5%和8%溶液中腐蚀后,阳极氧化5A06铝合金试样氧化膜较完整,膜层上仅有少量点蚀坑分布;而在Cl–质量分数为3.5%溶液中腐蚀20 h后,阳极氧化5A06铝合金试样氧化膜表面的点蚀坑数量最多,腐蚀最严重。1Cr18Ni9Ti作为电偶对的阴极,电极表面发生还原反应,受到保护,实验前后试样表面无显著变化。
图8为阳极氧化5A06铝合金原始试样和不同Cl–浓度条件下偶接20 h后的微观形貌。由图8可见,与原始试样表面相比,偶接20 h后阳极氧化5A06铝合金表面零散分布着点蚀坑,通过Image J软件计算阳极氧化铝合金在不同Cl–浓度下电偶腐蚀20 h后膜层孔隙率的结果表明(表6),氧化膜表面孔隙率大小依次为3.5%>5%>2%>6.5%>8%>0.5%,且当Cl–质量分数为3.5%时,阳极氧化5A06铝合金氧化膜表面点蚀坑之间形成腐蚀通道连接成片。
选取电偶腐蚀后阳极氧化5A06铝合金表面典型的点蚀坑进行观察(图9),并针对不同区域进行能谱分析(表7)。由图9可见,点蚀坑呈椭球状,中间凹陷处为黑色,蚀坑边缘为白色。EDS结果表明,点1、4处为阳极氧化膜表面无缺陷处,氧化膜主要由O和Al元素组成,Mg为铝合金中的第二相元素,而Cl、S、Cr元素分别为腐蚀环境、硫酸阳极化工艺和阳极氧化后封孔处理时所引入。图9点蚀坑中黑色区域点2、5的能谱分析结果表明(表7),其主要成分为Al和O,且Al元素含量略高于O元素含量,与点1、4处元素成分比较可以发现,点蚀坑中Al元素含量明显升高、而O元素含量降低,说明此处阳极氧化膜发生了溶解并且部分基体暴露,可以推断黑色区域为暴露的基体,溶液中的O2通过孔隙与基体发生氧化反应,过程如反应(1)所示。此外点2、5区域没有Mg元素存在,这是由于Mg元素相比Al元素更加活泼,因此Cl–在氧化膜表面活性处(缺陷或Mg元素等第二相粒子附近)发生吸附[24-25],并与活泼的Mg元素优先发生反应,从而诱发点蚀坑,促进了阳极氧化膜阳极溶解反应的进行。点蚀坑周围白色腐蚀产物的EDS结果显示(点3、6),与点1、4相比,点蚀坑周围的O元素含量升高,Al元素含量降低,说明此处氧化膜发生了溶解,并有腐蚀产物附着在表面,且Al元素和O元素的比例为1∶2~1∶3,可以推断白色腐蚀产物主要由AlOOH或Al(OH)3构成[26],AlOOH或Al(OH)3形成沉淀附着在点蚀坑周围。

图7 阳极氧化5A06铝合金原始试样及在不同Cl–浓度下偶接20 h后试样的宏观形貌

图8 阳极氧化5A06铝合金原始试样及在不同Cl–浓度下偶接20 h后的微观形貌
表6 不同Cl–浓度下偶接20 h后阳极氧化膜层的孔隙率
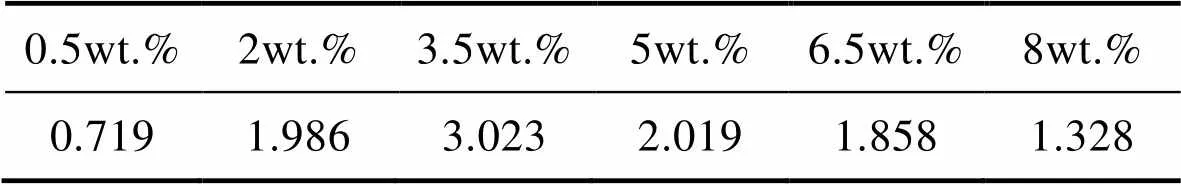
Tab.6 Porosity of anodic oxidation film in NaCl solution with different Cl– concentration after coupling for 20 h %

图9 5A06铝合金在不同Cl–浓度下偶接20 h后阳极氧化膜表面典型点蚀坑形貌
4Al+3O2+6H2O→4Al(OH)3(1)
表7 不同位置的EDS测试结果
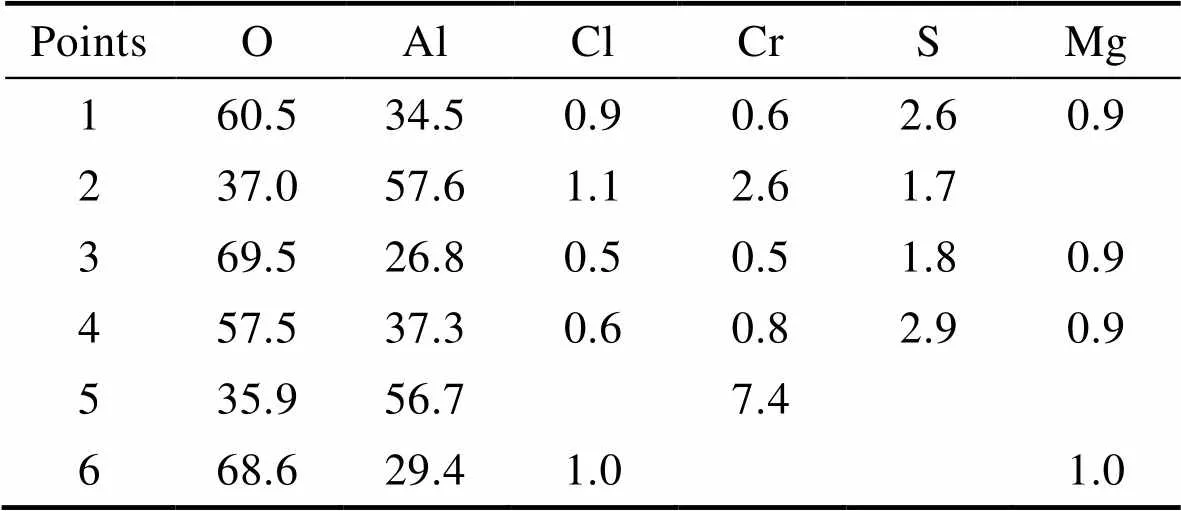
Tab.7 EDS test results at different locations at.%
2.5 电偶腐蚀过程及机理分析
铝合金阳极氧化过程中,氧化膜的形成和溶解同时进行。氧化膜的形成过程由反应(2)描述,氧化膜生长过程中形成的Al2O3膜和溶液中H+会发生反应,造成阳极氧化膜表面形成孔洞,溶解过程由反应(3)描述[27]。
2Al+3H2O→Al2O3+6H++e–(2)
Al2O3+6H+→2Al++3H2O (3)
因此铝合金表面阳极氧化膜具有多孔结构,这些多孔及缺陷处在电偶腐蚀过程中会优先发生腐蚀,形成点蚀坑。点蚀坑逐渐长大并与邻近的点蚀坑之间形成腐蚀通道,蚀坑中闭塞电池的自催化作用以及腐蚀介质的渗透引起蚀坑内部腐蚀加剧,点蚀坑逐渐长大至连接成片。随着反应进行,阳极氧化膜表面点蚀坑附近逐渐形成了AlOOH或Al(OH)3,同时溶液中Cl–选择性吸附在阳极氧化膜的空隙或缺陷处,并在反应中逐步取代Al(OH)3中的羟基,形成Al(OH)Cl3–x(< 3)暂态中间化合物并最终形成可溶性腐蚀产物AlCl3,从而导致阳极氧化膜不断溶解[28]。其过程由反应(4)—(6)描述。
Al(OH)3+Cl–=Al(OH)2Cl+OH–(4)
Al(OH)2Cl +Cl–=Al(OH)Cl2+OH–(5)
Al(OH)Cl2+Cl–=AlCl3+OH–(6)
随着铝合金表面阳极氧化膜的破坏,基体暴露在溶液中,氧化膜的孔隙有利于O2扩散至基体并发生氧化反应,促进了基体阳极溶解反应的进行。与此同时,基体Al与溶液中O2和水反应生成的Al(OH)3又阻碍了溶液中O2与基体的氧化反应,对基体产生了保护作用,使得阳极氧化膜表现为动态的破坏—修复—破坏的循环往复过程,即氧化膜具有自我修复功能,因此由图2观察到电偶腐蚀电流的变化呈现出锯齿状。
此外,Cl–浓度的升高促进了阳极氧化膜的溶解,使得电偶腐蚀速率表现出随Cl–浓度升高不断增加的趋势;但Cl–浓度的升高同时抑制了溶液中溶解氧含量,间接抑制了电偶腐蚀阳极反应的进行,因此电偶腐蚀速率呈现出随Cl–浓度升高达到最大值后又降低的规律。当Cl–质量分数小于3.5%时,其促进溶解作用大于抑制反应作用,表现为随着Cl–浓度增大,电偶电流逐渐增大;当Cl–质量分数约为3.5%时,促进作用和抑制作用达到一个相对平衡的状态,两种因素的综合作用使得此时的电偶电流达到最大;当Cl–质量分数大于3.5%时,其抑制反应作用大于促进溶解作用,表现为随着Cl–浓度增大,电偶电流逐渐减小。
3 结论
1)5A06铝合金阳极氧化膜具有自修复功能,电偶腐蚀过程中5A06铝合金阳极氧化膜表面的腐蚀产物对点蚀坑产生堵塞,阻碍了溶液中Cl–进一步和基体发生反应,阳极氧化膜表现为破坏—修复—破坏的循环往复过程,即电偶腐蚀电流出现锯齿状波动。
2)Cl–浓度对阳极氧化5A06铝合金的电偶腐蚀速率有显著影响,电偶电流密度随着Cl–浓度的变化表现为3.5%>5%>2%>6.5%>8%>0.5%。溶液中Cl–既可以促进铝合金阳极氧化膜的溶解,增加铝合金电偶腐蚀的敏感性,也会降低溶液中溶解氧的浓度从而抑制阳极反应发生。两种因素的综合作用,使电偶腐蚀速率呈现出先增大后减小的变化趋势。
3)当Cl–质量分数为3.5%时,阳极氧化5A06铝合金的腐蚀电流密度最大,为16.56 μA/cm2,此时阳极氧化膜表面的孔隙率最大,腐蚀最严重。
[1] 韩克, 欧忠文, 蒲滕, 等. 铝及铝合金硬质阳极氧化的研究进展[J]. 表面技术, 2011, 40(5): 92-96.
HAN Ke, OU Zhong-wen, PU Teng, et al. Development of Hard Anodizing of Aluminum and Aluminum Alloy[J]. Surface Technology, 2011, 40(5): 92-96.
[2] 高安江, 岳亮. 南海海洋大气环境下铝合金腐蚀与防护研究[J]. 世界有色金属, 2017(4): 15-17.
GAO An-jiang, YUE Liang. Study on Aluminum Alloy Corrosion and Protection under the South Sea AtmosphericEnvironment[J]. World Nonferrous Metals, 2017(4): 15-17.
[3] SIELSKI R A. Research Needs in Aluminum Structure[J]. Ships and Offshore Structures, 2008, 3(1): 57-65.
[4] WAHID M A, SIDDIQUEE A N, KHAN Z A. Aluminum Alloys in Marine Construction: Characteristics, Application, and Problems from a Fabrication Viewpoint[J]. Marine Systems & Ocean Technology, 2020, 15(1): 70-80.
[5] 齐忠原, 巫瑞智, 王国军, 等. 铝合金在船舶和海洋工程中的应用[J]. 轻合金加工技术, 2016, 44(1): 12-18.
QI Zhong-yuan, WU Rui-zhi, WANG Guo-jun, et al. Application of Aluminum Alloys in Shipping and Ocean Engineering[J]. Light Alloy Fabrication Technology, 2016, 44(1): 12-18.
[6] 侯健, 张彭辉, 郭为民. 船用铝合金在海洋环境中的腐蚀研究[J]. 装备环境工程, 2015, 12(2): 59-63, 80.
HOU Jian, ZHANG Peng-hui, GUO Wei-min. Study on Corrosion of Aluminum Alloys for Ship Applications in Marine Environment[J]. Equipment Environmental Engineering, 2015, 12(2): 59-63, 80.
[7] DELGADO-ALVARADO C, SUNDARAM P A. A Study of the Corrosion Behavior of Gamma Titanium Aluminide in 3.5 Wt% NaCl Solution and Seawater[J]. Corrosion Science, 2007, 49(9): 3732-3741.
[8] ZHANG Sheng, ZHANG Teng, HE Yu-ting, et al. Long-Term Atmospheric Corrosion of Aluminum Alloy 2024-T4 in Coastal Environment: Surface and Sectional Corrosion Behavior[J]. Journal of Alloys and Compounds, 2019, 789: 460-471.
[9] ZHAO Qi-yue. Corrosion Behavior of Anodized 7B50 Aluminum Alloy in Different Atmospheric Environments [J]. International Journal of Electrochemical Science, 2019: 8228-8242.
[10] 王慧婷, 史娜, 刘章, 等. 6xxx系铝合金表面腐蚀及其防腐的研究现状[J]. 表面技术, 2018, 47(1): 160-167.
WANG Hui-ting, SHI Na, LIU Zhang, et al. Surface Corrosion and Corrosion Prevention of 6xxx-Series Aluminium Alloy[J]. Surface Technology, 2018, 47(1): 160-167.
[11] ZHANG Jie, WANG Jia, ZHANG Bin-bin, et al. Fabrication of Anodized Superhydrophobic 5083 Aluminum Alloy Surface for Marine Anti-Corrosion and Anti-Biofouling [J]. Journal of Oceanology and Limnology, 2020, 38(4): 1246-1255.
[12] 梁轩, 魏凯. 金属防护用镍基化学镀的研究进展[J]. 电镀与涂饰, 2020, 39(17): 1166-1170.
LIANG Xuan, WEI Kai. Research Progress of Nickel- Based Electroless Plating Technologies in Protection of Metallic Materials[J]. Electroplating & Finishing, 2020, 39(17): 1166-1170.
[13] RASHIDI A M, AMADEH A. Effect of Electroplating Parameters on Microstructure of Nanocrystalline Nickel Coatings[J]. Journal of Materials Science & Technology, 2010, 26(1): 82-86.
[14] MATYKINA E, ARRABAL R, PARDO A, et al. Energy- Efficient PEO Process of Aluminium Alloys[J]. Materials Letters, 2014, 127: 13-16.
[15] 雷欣, 林乃明, 邹娇娟, 等. 铝合金微弧氧化的研究进展[J]. 表面技术, 2019, 48(12): 10-22.
LEI Xin, LIN Nai-ming, ZOU Jiao-juan, et al. Research Progress of Micro-Arc Oxidation on Aluminum Alloys[J]. Surface Technology, 2019, 48(12): 10-22.
[16] 张晓云, 汤智慧, 孙志华, 刘明辉, 李斌. 0Cr13Ni8Mo2Al钢与铝合金和钛台金接触腐蚀与防护研究[J]. 腐蚀与防护, 2002, 23(10): 423-426.
ZHANG Xiao-yun, TANG Zhi-hui, SUN Zhi-hua, et al. GALVANIC CORROSION AND PROTECTION OF OCrl3Ni8Mo2Al STAINLESS STEEL COUPLED WITH ALUMINUM ALLOY AND TITANIUM ALLOY[J]. Corrosion & Protection, 2002, 23(10): 423-426.
[17] 王玲, 宣卫芳, 牟献良. 2A11铝合金/碳钢偶接件在强化自然环境条件下的腐蚀特性[J]. 表面技术, 2011, 40(5): 1-4.
WANG Ling, XUAN Wei-fang, MU Xian-liang. CorrosionPerformance of 2A11 Aluminium Alloy Coupled with Carbon Steel in Accelerated Natural Environmental Condition[J]. Surface Technology, 2011, 40(5): 1-4.
[18] 王沙沙, 杨浪, 肖葵, 等. 工业海洋大气环境下阳极氧化6061铝合金的电偶腐蚀行为[J]. 工程科学学报, 2018, 40(7): 833-841.
WANG Sha-sha, YANG Lang, XIAO Kui, et al. Galvanic Corrosion of Anodized 6061 Aluminum Alloy in an Industrial-Marine Atmospheric Environment[J]. Chinese Journal of Engineering, 2018, 40(7): 833-841.
[19] PYUN S I, MOON S M, AHN S H, et al. Effects of Cl–, NO–3and SO2–4Ions on Anodic Dissolution of Pure Aluminum in Alkaline Solution[J]. Corrosion Science, 1999, 41(4): 653-667.
[20] 陈跃良, 赵红君, 王晨光, 等. 7B04铝合金和30CrMnSiA钢短期腐蚀的电化学行为研究[J]. 装备环境工程, 2018, 15(1): 34-39.
CHEN Yue-liang, ZHAO Hong-jun, WANG Chen-guang, et al. Short-Term Electrochemical Corrosion Behavior of 7B04 Aluminum Alloy and 30CrMnSiA Steel[J]. Equipment Environmental Engineering, 2018, 15(1): 34-39.
Effect of Cl–Concentration on Corrosion Behavior of Anodized 5A06 Aluminum Alloy/1Cr18Ni9Ti Stainless Steel Coupling
1,1,1,2,1,1,1
(1. School of Civil Aviation, Northwestern Polytechnical University, Xi’an 710072, China; 2. National Key Laboratory of Special Technology on UAV, Northwestern Polytechnical University, Xi’an 710065, China)
The work aims to study the galvanic corrosion mechanism of anodized 5A06 aluminum alloy/1Cr18Ni9Ti stainless steel coupling and the effect of Cl–concentration on its corrosion behavior, It provides a basis for the corrosion and protection of aluminum alloy in different service environments. The galvanic corrosion experiments of anodized 5A06 aluminum alloy and 1Cr18Ni9Ti stainless steel were set at different Cl–concentrations. The effect of Cl–concentration on the corrosion behavior of anodized 5A06 aluminum alloy was discussed, according to the analysis of the change law of the corrosion current, the characterization of the surface corrosion morphology and composition, and the electrochemical test. With the increasing of corrosion time, the galvanic current fluctuated zigzag and gradually decreases and then tended to be stable. The variation of galvanic current with Cl–concentration was 3.5%>5%>2%>6.5%>8%>0.5%,When the Cl–concentration was 3.5%, the maximum galvanic current was 16.56 μA/cm2. In the process of galvanic corrosion, the corrosion products on the surface of 5A06 aluminum alloy anodic oxide film block the pitting pits, hinder the further reaction of Cl–with substrate in solution. The anodic oxide film shows a cyclic process of destructing-repairing-destructing; Cl–can not only promote the dissolution of anodic oxide film of aluminum alloy, increase the sensitivity of galvanic corrosion of aluminum alloy, but also reduce the concentration of dissolved oxygen in solution, which help to inhibit the occurrence of anodic reaction. When the concentration of Cl–is less than 3.5%, the effect of promoting dissolution is greater than that of inhibiting reaction, and when the concentration of Cl–is more than 3.5%, the effect of inhibiting reaction is more obvious than that of promoting dissolution. Therefore, The galvanic corrosion rate increases first and then decreases with the increase of Cl–concentration。
anodic oxidation; 5A06 aluminum alloy; galvanic corrosion; Cl–concentration; pitting
TG174.4
A
1001-3660(2022)07-0161-08
10.16490/j.cnki.issn.1001-3660.2022.07.015
2021–08–12;
2021–09–29
2021-08-12;
2021-09-29
国家自然科学基金(52001256);陕西省自然科学基础研究计划重点项目(2021JM055)
National Natural Science Foundation of China (52001256); Natural Science Foundation of Shaanxi Province (2021JM055)
梁明辉(1997—),男,硕士研究生,主要研究方向为材料表面腐蚀与防护技术。
LIANG Ming-hui (1997-), Male, Postgraduate, Research focus: materials surface protection and corrosion technology.
吴向清(1968—),女,博士,副教授,主要研究方向为材料表面腐蚀与防护技术。
WU Xiang-qing (1968-), Female, Doctor, Associate professor, Research focus: materials surface protection and corrosion technology.
梁明辉, 吴向清, 谢发勤, 等. Cl–浓度对阳极氧化5A06铝合金/1Cr18Ni9Ti不锈钢偶接件腐蚀行为的影响[J]. 表面技术, 2022, 51(7): 161-168.
LIANG Ming-hui, WU Xiang-qing, XIE Fa-qin, et al. Effect of Cl–Concentration on Corrosion Behavior of Anodized 5A06 Aluminum Alloy/1Cr18Ni9Ti Stainless Steel Coupling[J]. Surface Technology, 2022, 51(7): 161-168.
责任编辑:万长清
