超声检查评估乳腺癌新辅助化疗疗效的准确性及影响因素分析
2022-07-26张曼琪查海玲刘心培栗翠英
张曼琪, 查海玲, 刘心培, 王 珏, 陈 锐, 栗翠英
(南京医科大学第一附属医院, 1. 超声诊断科, 2. 乳腺外科, 江苏 南京, 210029)
新辅助化疗是局部晚期乳腺癌患者术前进行的全身系统性治疗,研究[1-2]证实其可提高患者生存率及延长无病生存期,优点包括缩小病灶,增大局部进展期乳腺癌患者获得保乳手术的机会,了解肿瘤对化疗药物的敏感性及消灭微转移灶等。病理检查是评价乳腺癌新辅助化疗(NAC)疗效的“金标准”,但因其具有有创性和滞后性,限制了其临床应用。目前,超声检查和磁共振等影像学检查是评估NAC疗效的主要方式[3-4], 可提供残余肿瘤的相关信息,有利于后续手术方式的选择。超声因其价格低廉、便捷等优点被广泛应用于NAC疗效的评估[5]。本研究对比超声检查与术后组织病理学检查结果,判断乳腺超声检查评估NAC疗效和残余病灶大小测量的准确性,并分析影响评估准确性的因素。
1 资料与方法
1.1 临床资料
选取2018年1月—2021年10月在南京医科大学第一附属医院接受NAC并行手术治疗的260例浸润性乳腺癌患者为研究对象。纳入标准: ① 经空心针穿刺活检证实为浸润性乳腺癌者; ② 术前接受6~8个周期的NAC, 化疗结束后1~2周行手术治疗者; ③ NAC前及结束后均行超声检查者; ④ 超声图像均为肿块型者; ⑤ 临床及病理学资料完整者。排除标准: ① 双侧多灶性乳腺癌者; ② 术前合并远处转移者; ③ NAC后未在本院手术及临床资料缺失者。所有患者均为女性,年龄21~78岁,中位年龄为53岁。本研究经南京医科大学第一附属医院伦理委员会批准。
1.2 仪器与检查方法
采用Esaote的Mylab Twice彩超诊断仪对患者进行诊断,使用高频率(4~13MHz)线阵探头(LA523)对患者进行检查。所有患者采用仰卧位及侧卧位,充分暴露双乳及腋窝,由1名经验丰富的超声科医师在NAC前后对双乳及双侧腋窝进行全面扫查。观察并记录肿块位置、大小、内部回声、边缘、形态、后方回声、是否有钙化及血流分级等信息。
1.3 临床及病理学资料
收集所有患者的临床及病理学资料,包括年龄、超声检查及病理检查所测肿瘤最大径、血流分级、钙化、边缘、后方回声改变、分子分型、肿瘤组织学分级、人表皮生长因子受体2(HER2)、雌激素受体(ER)及孕激素受体(PR)。根据2011年GOLDHIRSCH A等制订的乳腺癌共识[6]将ER、PR表达阳性≥10%定义为ER、PR阳性。采用免疫组织化学法检测HER2, HER2(+)或无表达定义为HER2阴性; 病灶为HER2()则定义为HER2阳性; HER2()需进行荧光原位杂交(FISH)进一步判断扩增状态。
1.4 NAC方案
本研究中, 260例患者分别进行了包括表柔比星+环磷酰胺-多西他赛(EC-T)、多西他赛+紫杉醇-表柔比星+环磷酰胺(TP-EC)等基于紫杉醇类及蒽环类药物的NAC方案, HER2阳性患者同时接受曲妥珠单抗(H)的靶向治疗。治疗14 d为1个周期,共序贯或联合化疗6~8个周期。所有患者于NAC后1~2周行手术治疗。根据Miller-Payne(MP)分级系统[7]对术后病理标本进行评估。
1.5 评价标准
1.5.1 病理检查评估标准: 采用MP分级系统评价NAC疗效。1级为肿瘤细胞无变化或仅有少量退变; 2级为肿瘤细胞减少≤30%; 3级为肿瘤细胞减少>30%~90%; 4级为90%以上的肿瘤细胞减少、退变消失; 5级为原病灶区未见残存癌细胞,仅见间质内纤维及泡沫状组织细胞,但有时可见导管内癌成分,即病理学完全缓解(pCR)。将MP分级1~4级定义为非病理学完全缓解(non-pCR)。
1.5.2 临床评价标准: 超声评估NAC的疗效参考实体瘤反应评价标准(RECIST)[8]。完全缓解(CR)定义为病灶完全消失; 部分缓解定义为靶病灶基线最长径之和(若为单发病灶即为其最长径)缩小≥30%; 疾病稳定(SD)为靶病灶基线最大径减少<30%或增加<20%; 疾病进展(PD)为靶病灶基线最大径增加≥20%, 或出现新的病灶。将超声评估为部分缓解、SD及PD的患者归为非完全缓解(NCR)。
1.6 统计学方法

2 结 果
2.1 超声与病理所测肿瘤残存病灶最长径的相关性
NAC后超声所测肿瘤最大直径为(19.8±14.3) mm, 术后病理所测残余癌最大直径为(17.9±16.3) mm。超声所测肿瘤最大直径与术后病理所测残余癌最大直径显著相关(r=0.721,P<0.001)。
2.2 NAC后超声及术后病理检查评估结果
术后病理MP分级显示, MP分级1级5例, 2级49例, 3级65例, 4级63例, 5级78例,其中pCR占30.0%(78/260), non-pCR占70.0%(182/260)。超声检查结果显示,患者未发生PD, SD 61例(23.5%), 部分缓解114例(43.8%), CR 85例(32.7%)。
2.3 超声与病理检查评估结果比较
260例患者中,病理检查评估为pCR的78例病灶中同时超声评估为CR的有64例,超声误诊14例; 病理检查评估为non-pCR的182例患者中,超声评估为NCR的有161例,超声误诊21例。以病理学检查结果为参照,超声评估NAC的疗效及残余乳腺癌病灶的准确度、敏感度、特异度、阳性预测值及阴性预测值分别为86.5%、82.1%、88.4%、75.3%和86.3%,见表1。

表1 NAC后超声与病理检查评估结果
2.4 超声与病理检查评估的差异因素分析
患者年龄、HER2、NAC前肿瘤最大径等特征对NAC后超声与病理组织学评估残余病灶大小的一致性无显著影响(P>0.05), 但肿块边缘、后方回声、钙化、组织学分级、ER表达状态等临床病理特征对NAC后超声与病理评估残余病灶大小的一致性有显著影响(P<0.05), 超声与病理检查评估边缘尚光整、后方回声无改变、肿块内无钙化、组织学分级低和ER阴性的一致性较好。14例病理检查评估为pCR但超声评估为NCR的患者中, 13例ER阳性; 2例组织学分级Ⅱ级, 11例Ⅲ级; 超声图像方面, 14例患者中有13例边缘不光滑平整, 13例后方回声衰减, 12例肿块内有钙化。在21例病理检查评估为non-pCR但超声评估为CR的患者中, 18例ER阳性; 17例组织学分级Ⅱ级, 4例Ⅲ级; 在超声表现方面, 21例中有20例肿块边缘不光整, 20例后方回声衰减, 19例肿块内有钙化,见表2。
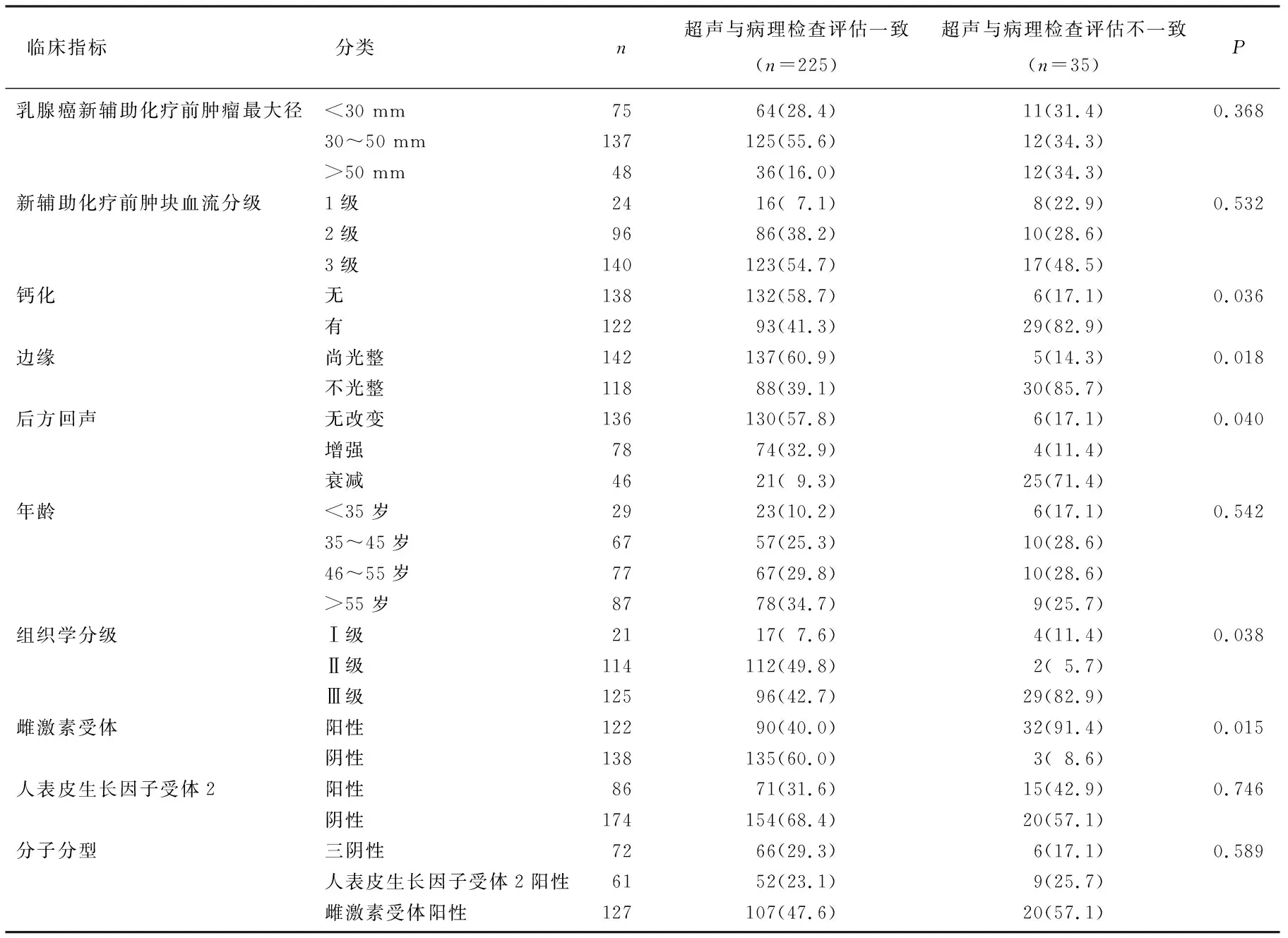
表2 不同临床指标对超声与病理检查评估一致性情况
2.5 典型病例
1例56岁ER(-)的女性乳腺癌患者, NAC前的二维超声图像表现为肿块内无钙化灶、肿块边缘尚光整及后方回声无改变,肿瘤最大径为11 mm; NAC后的超声图像中测得残余肿块最大径缩小至7 mm, 与术后病理图像所测残余灶最大径6.5 mm相近(见少许瘤灶残余),超声与病理评估一致性较好(见图1)。

A. NAC前超声图; B. NAC后超声图; C. 术后病理苏木精-伊红染色图(放大200倍)。图1 NAC前后超声与病理测量病灶最大径对比图
3 讨 论
近年来,乳腺癌发病率日渐增高,成为威胁女性生命健康的首要原因[9]。NAC在乳腺癌系统性综合治疗中的地位日益显著,成为局部晚期乳腺癌患者的首选治疗方案[10]。因此,及时准确地评价NAC疗效对手术方式的选择及后续治疗方案的制订尤为重要。病理学检查虽为疗效评价的金标准,但其仅能在术后获取并为有创操作,因而目前尚缺乏一种无创且准确的影像学方法进行术前疗效评估。
高频超声分辨率高,可以准确显示病灶形态、边缘、大小及血流等特征[11], 其中病灶大小、边缘及后方回声等是判断化疗效果较为直观的指征。准确评估残余病灶的大小对判断NAC的效果十分重要。本研究结果显示, NAC后超声与术后病理检查测量残余病灶大小的相关性较强(相关系数为0.721)。对NAC后残余病灶大小进行准确评估,可有效帮助临床医生于术前确定保乳患者的手术范围并为其制订个体化诊疗方案。
病理学pCR被认为是NAC预后良好的指标,本研究以RECIST作为超声评估NAC效果的标准,参照病理MP分级,判断了超声评估NAC疗效的准确性,超声准确性可达86.5%, 且具有较好的敏感性(82.1%)和特异性(88.4%)。但本研究仍存在一定的假阴性和假阳性病例,说明超声评估NAC的结果与病理金标准仍有一定差异。文献[12]报道, 假阴性可能是由于NAC后残存的微小浸润癌灶未能在超声中显示。本研究显示,21例病理评估为non-pCR但超声评估为CR的患者中, 19例存在小灶状浸润性癌,这与上述研究结果相似; 而假阳性可能由于化疗后肿瘤细胞变性坏死,瘤床区胶原化由瘢痕组织替代,在超声中显示似有病灶,但镜下无癌灶存在,这一点在本研究中14例病理为pCR而超声为NCR的患者中也得到印证。此外,本研究还探讨了超声图像其他特征以及临床病理资料的相关特征对超声评估NAC疗效的影响。
OCHI T等[13]研究发现, NAC后超声图像中肿瘤内部回声变化等特征与乳腺癌NAC后pCR有较强的相关性,NAC后疗效好的肿块内部回声较疗效差的患者增高明显。高歌[14]指出, NAC后超声形态变规则、边缘变光整及后方回声变正常等指征可作为NAC疗效好的预测指标。本研究中,超声表现为边缘相对光整、后方回声无衰减及肿块内无钙化患者的NAC疗效更好,即获得pCR患者的预后效果更好。EVANS A等[15]指出,边缘毛刺、微钙化及后方回声衰减大多出现于组织学分化差的乳腺癌中,这部分肿块浸润性强,早期易发生微转移及向周边组织浸润,从而多数对NAC的反应差。因此,将肿块大小与其他超声表现结合可进一步提高超声评估的准确性。此外,本研究中组织学分级高及ER阳性肿块的超声的评估准确性较低,与KO ES等[16]的研究结果相似,研究[17]指出原因可能为ER阳性和组织学分级高的乳腺癌对NAC的反应较差,多为非向心性巢样退缩模式,化疗后残癌体积相对较大且分布呈斑片状,较为散乱,导致测量误差较大。本研究发现,三阴性乳腺癌较其他分子分型者的超声与病理测量差异更小,即评估准确性更高,这与既往多项研究[18-20]结果相似,这可能是由于三阴性乳腺癌边缘相对光整,形态相对规则,且多为向心性退缩模式,使超声对NAC后病灶测量的误差小,提高了评估准确性[21-22]。
本研究尚存在以下不足: ① 本研究为回顾性研究,后续需增加前瞻性研究对结论加以验证; ② 本研究仅为单中心研究且样本量较小,尚需通过扩大样本量进行多中心验证。③ 本研究未纳入非肿块型乳腺癌,因超声测量肿块体积的准确性较低,可能会造成选择性偏倚。④ 本研究未引入超声弹性及超声造影成像,也未与磁共振成像、正电子发射计算机断层显像(PET-CT)等其他成像方法对比,这将成为未来的研究方向之一。
综上所述,超声检查是评估NAC疗效及测量残癌大小较为可靠的检查方法,与病理组织学评价结果一致性较高。在临床实践中, NAC降期后实施保乳手术需要精确定位残余病灶并评估疗效及残癌大小。将边缘相对光整及后方回声无改变等超声特征与ER阴性、组织学分级低等临床特征结合可在术前较为准确地评估NAC疗效及残癌大小,进而在术前确定保乳手术范围,避免患者遭受不必要的创伤。
