新型血管吻合器的结构设计及离体实验研究*
2022-07-25向炀郭宏波职康康王伟毛琳宋成利
向炀,郭宏波,职康康,王伟,毛琳,宋成利△
(1.上海理工大学健康科学与工程学院,现代微创医疗器械及技术教育部工程研究中心,上海 200093;2.海军军医大学第二附属医院,上海 200003;3.海军特色医学中心,上海 200433)
引言
血管吻合技术广泛应用于椎动脉重建、游离皮瓣移植、口腔颌面重建、头颈部重建等领域[1-3]。目前,临床上最常用的血管吻合方法为手工缝合法,但传统的手工血管缝合方法对医生要求较高,需要进行长时间的学习与练习,并且手工缝合时间长,易出现人为失误。另外,缝合后的异物反应、炎症反应和瘢痕组织,有可能增加术后血管狭窄或阻塞的风险[4-5]。
现有的血管吻合方法主要包括磁环吻合[6]、血管支架吻合[7]、医用黏合剂吻合[8-9]以及Coupler针环吻合[10-12]等。磁环吻合是使用磁压榨技术,利用磁体在相邻血管间产生持续的压迫,造成受压榨区域逐渐缺血坏死,周围组织逐渐愈合。其操作简单、吻合速度快,但生物相容性与稳定性不好,并且可能与其他吻合口相互影响,还会干扰体内心脏起搏器的正常工作及影像学检查。血管支架吻合法减少了血管吻合时缝线的使用,对血管正常生理功能起到了保护作用,但其需要在血管腔内植入血管支架。临床上血管支架材料多使用钽、医用不锈钢、镍钛合金等不可吸收金属,会造成血栓形成、血管再狭窄的风险[7,13]。医用黏合剂方法利用生物材料模拟创伤修复的过程,通过某种“胶水”将断裂的血管粘接在一起,以恢复血管的结构与功能[14],但吻合后吻合口质脆、弹性差。
目前,国内外血管吻合研究领域的主要方向之一为机械性的吻合方式。Coupler针环吻合器是目前唯一已商用的血管吻合器械,是机械吻合的代表产品。其吻合环由超高分子聚乙烯以及医用不锈钢针组成,该器械将血管穿过吻合环后将血管断端外翻,外翻的血管固定至不锈钢针上,然后将两端吻合环对合,完成血管吻合。该器械对操作要求较低、吻合时间短、并且血管腔内无异物、内膜光滑。但是该装置仅适用于静脉血管,由于动脉血管壁厚、弹性高,故不适用动脉血管,并且在操作过程中有血管撕裂风险,会对血管造成透壁性损伤。负压血管吻合环对Coupler针环吻合进行了改进,去除不锈钢针采用负压装置外翻血管,避免了血管的透壁性损伤,但该方法的稳定性差,吻合过程可能发生血管脱落[15]。另一吻合装置也对Coupler血管吻合器进行了改进,将针环拆解成四个旋转外翻部分,优化了手术操作[16],但仍有造成血管撕裂的风险,并且其对动脉的作用有限。
1 材料与方法
1.1 血管吻合器的结构设计
理想的血管吻合器应符合以下四个原则:避免吻合口狭窄、避免血管腔狭窄和凹凸不平、断端血管内膜紧贴、避免吻合材料与血液直接接触[17]。目前主流的手工缝合技术与coupler机械吻合由于缝针缝线穿透血管壁,且缝线与血液接触等原因,无法实现理想的血管吻合。因此,本研究设计的新型血管吻合器需满足以下要求:简化手术操作、缩短手术时间、提高手术效率;同时适用于动、静脉的血管吻合;吻合结构不与血液直接接触、断端血管之间内膜紧贴且需要能支撑吻合口。基于以上分析,所设计器械见图1。
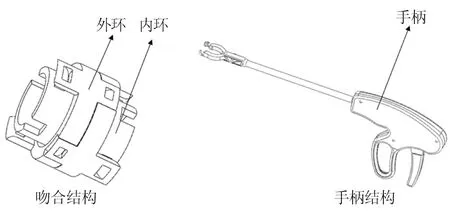
图1 新型血管吻合器的结构示意图Fig.1 Structural diagram of the novel vascular stapler
新型血管吻合器包括吻合结构与手柄结构两大部分。吻合结构包括内环与外环,环上采用非永久性止逆锁的卡扣结构,用于完成血管的吻合。吻合环设计有不同尺寸,以适应各个直径血管的吻合。手柄结构包括执行机构、传动机构和驱动机构。执行机构上设有相互垂直的卡槽安装吻合环;传动机构采用连杆传动,外管设计细窄便于进入狭窄处进行手术,手柄处符合人因工程学设计。该手柄结构用于辅助吻合环对合,完成血管吻合操作。吻合器吻合步骤见图2。首先,将血管断端穿过内环,修剪血管断端,减小血管张力。然后,将血管断端外翻,推入外环夹紧外翻血管且与内环对合,将血管断端固定,另一端相同操作后,将两端对合,完成血管吻合。吻合环、手柄外壳等使用3D打印加工,其余零件采用机加工方式。

图2 血管吻合步骤示意图Fig.2 Schematic diagram of anastomosis steps
1.2 血管吻合器结构的有限元分析
在血管吻合的过程中,若吻合环对血管的施压过大,会造成血管内膜永久性受损,若施压过小,则会造成吻合口密封性不好,渗漏量大,上述情形均视为吻合失败[18]。并且,扣合的吻合器需承受正常的生理载荷,故使用有限元分析模拟吻合过程中血管与血管吻合器的相互作用,完善器械参数。
1.2.1有限元模型与材料参数 几何模型使用SolidWorks建模,吻合环内环内径为6 mm,壁厚0.75 mm,外环内径8.4 mm,壁厚1.4 mm。动脉血管模型直径为6 mm,壁厚1 mm。模型导入ANSYS进行网格划分,共69 546个节点,15 589个单元。
动脉血管分为内层、中层和外层。研究表明,血管的力学性质取决于血管的中层。而动脉的主要力学特性有超弹性、各向异性、非线性和不可压缩性[19-20]。在模拟生理载荷下,动脉组织的周向和纵向特性无显著差异,故选用5常数3阶各向同性超弹性模型(Mooney-Rivlin)[21-22]:
W=a10(I1-3)+a01(I2-3)+a10(I1-3)2+
a11(I1-3)(I2-3)+a30(I1-3)3
(1)
其中,a10=18.90 kPa,a01=2.75 kPa,a10=85.72 kPa,a11=590.43 kPa,a30=0 kPa。
(3)ES 提供了RESTful API,使用JSON 格式,提供了非常优秀的外部交互能力,使得搜索引擎能够支持多种文件类型的搜索。ES 项目提供了多种语言版本的客户端,包括Java、Python、.NET 和Groovy,提供了友好的二次开发平台。
吻合环采用高密度聚乙烯(HDPE)材料,使用Sherwood-Frost模型描述HDPE的力学行为[23-24]:
(2)
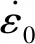
1.2.2边界与载荷 本研究使用有限元ANSYS19.2软件来仿真分析吻合环与血管之间的相互作用。吻合环通过对血管的轴向施压来完成吻合,首先需要确定吻合环对血管的施压距离。仿真中设置模型径向位移和周向位移为0,保留轴向位移。两侧吻合外环对外翻的血管壁持续施加等大反向的压力,记录此时吻合环产生的轴向位移作为其施压距离,该条件下血管壁产生的应力为吻合后血管上的预紧力。再对血管两端施加轴向位移,模拟由于日常活动而产生的血管拉伸,观察吻合环上的应力分布情况。
1.3 体外实验
1.3.1体外拉伸实验 在日常生活中,由于人的运动,血管会受到一定的拉伸。故设置拉伸实验评估本研究血管吻合器所能承受的最大力。将采集的猪动脉切成两半,然后利用新型血管吻合器将其重新连接。将血管两端使用缝线固定至PC软管,而后将两端软管分别固定于拉伸试验机的上、下夹具上,使血管保持竖直不能倾斜,见图3(a)。以100 mm/min的速度进行拉伸,直至断裂。重复进行6组实验(血管编号为1—6),记录最大拉伸力以及断裂状态。
1.3.2体外渗漏实验 在正常生理状态下,血管舒张压范围为60~80 mmHg,收缩压范围为100~120 mmHg。为了验证新型血管吻合器在正常情况的密封性,保证其安全有效,设计了渗露试验测试吻合口的渗露程度。将采集的主动脉分成两半,分为四组:第一组由血管外科医生使用手工缝合,将血管重新连接;第二组使用单侧加压距离为0.2 mm的血管吻合器将血管重新连接;第三组使用单侧加压距离为0.3 mm的血管吻合器将血管重新连接;第四组使用单侧加压距离为0.4 mm的血管吻合器将血管重新连接。然后将吻合完成的血管一端堵住,另一端匀速注水,使血压缓慢上升至极值,高于正常血压,至极值后观测5 min,见图3(c)。每组重复进行4次。记录血管吻合时间、极值水压以及5 min渗漏程度。

图3 体外拉伸实验与渗漏实验Fig. 3 Ex vivo tensile test and leaktest
2 结果
2.1 有限元分析结果
本研究对吻合环与血管的相互作用过程进行了仿真模拟。首先,对吻合环对血管施压过程进行仿真,单侧施压距离与血管的应力关系见图4。在单侧施压距离0.2、0.3、0.4 mm时,血管压缩率分别为20%、30%、40%,血管内膜所受到的最大应力分别为0.22、0.58、1.31 MPa。由图4可知,随着施压距离的增大,血管组织受到的应力也随之增加。

图4 血管在不同施压距离下的应力分布Fig. 4 Stress distributions of blood vessels under applying different pressures
然后,对吻合完成后的血管两端施加位移载荷,使血管处于极端拉伸情况,得到吻合环上的应力分布。在单侧施压距离0.2、0.3、0.4 mm,血管压缩率分别为20%、30%、40%时,吻合环所受到的最大应力分别为18.24、28.54、32.49 MPa,吻合环上的最大应力随着施压距离的增大而增大,但均低于材料屈服强度。可以得出,在三种不同压缩情况下,吻合环强度均可以满足吻合要求。
2.2 体外实验结果
2.2.1拉伸实验 拉伸实验对松弛的动脉施加载荷,直至动脉撕裂或吻合环脱落,结果见表1。在实验中出现了不同的断裂方式:(1)血管从单侧外环与内环之间脱落;(2)血管从PC软管处滑脱。吻合后血管的平均最大拉伸力为6.08 N,远高于血管在极端拉伸(20%)情况的受力[25]。故吻合后的动脉血管足以承受人体正常的生理载荷,满足吻合血管的要求。

表1 拉伸实验结果Table 1 Results of tensile test
2.2.2渗漏实验 渗漏实验结果见图5,第一组、第二组、第三组以及第四组的极值水压均值分别为90.87、83.04、148.25、148.20 mmHg,第一组的极值水压略高于第二组,但第一、第二组的极值水压均低于第三、第四组。
第一与第二组吻合后血管均发生渗漏,第三与第四组大部分吻合后血管发生渗漏。第一、二、三、四组的5 min渗漏量均值分别为21.4、46.9、5.7、7.8 mL,第二组平均渗漏最多,第一组渗漏略少于第二组,第三、第四组平均渗漏量较少,但出现单个渗漏略大情况。
第一、二、三、四组的平均吻合时间分别为8.6、2.8、3.0、2.9 min,第一组手工缝合组所用吻合时间高于其他3组。
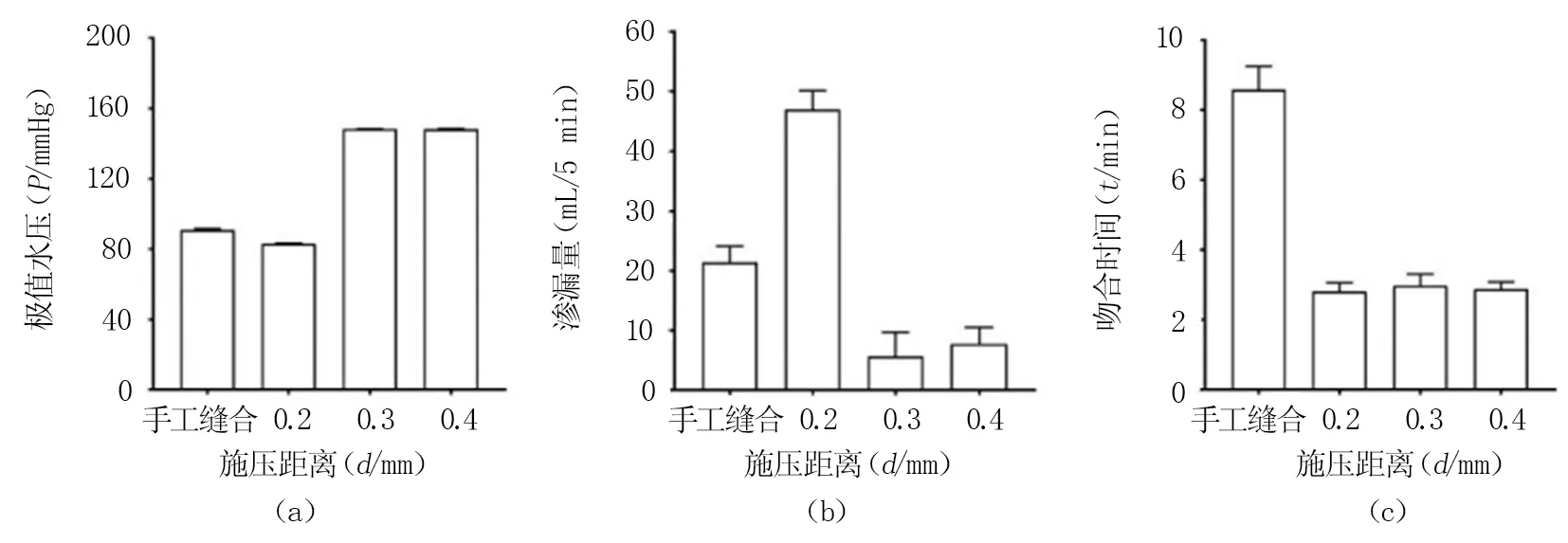
注:图中第一组为手工缝合组;第二组为吻合器组(施压距离0.2 mm);第三组为吻合器组(施压距离0.3 mm);第四组为吻合器组(施压距离0.4 mm)。
3 讨论
在渗漏实验中,手工缝合组与吻合器组的极值水压均高于人体平均生理载荷[26],但第二组的平均极值水压最低,且渗漏量与渗漏速度最大,还未达到最好的血管密封效果。第三组与第四组平均极值水压高于手工缝合组,且渗漏量均低于手工缝合组,吻合效果优于手工缝合。两组之间的平均极值水压接近,渗漏量均较少,但第四组出现单个血管极值水压下降、渗漏量较大的情况。从有限元分析结果可知,施压距离为0.3、0.4 mm时,血管内膜所受最大应力分别为0.58、1.31 MPa,第三组血管所受应力更小,血管内膜损伤程度小,组织愈合速度更快。第四组有血管出现极值水压下降以及渗漏量较大情况,可能是由于对血管内膜施压过大,血管出现了破损。综上,血管吻合器的最佳单侧施压距离为0.3 mm,此时,吻合后的血管可达到良好的密封效果,且对血管内膜损伤最小。
本研究的新型血管吻合器遵循理想血管吻合原则设计,实验研究证明,该器械的吻合速度要明显优于临床常用的手工缝合技术,并且在能够承受人体生理载荷的情况下,吻合密封效果比手工缝合更优。此外,该器械刚性的吻合环可以对血管起到支撑扩张的作用,使吻合后的血管有更好的通畅率,且不受人为影响。针环吻合需要钢针穿透血管壁,可能导致炎症,而且由于动脉壁厚而富有弹性,钢针无法起到很好的固定作用,吻合过程中易滑脱撕裂。因此,本研究针对针环吻合做出了改进,使用卡扣结构,利用内外环施压固定血管壁,并且外翻达到吻合动脉的目的。
实验过程中可观测到,使用新型血管吻合器吻合的血管内壁光滑、无异物,避免了缝线缝合后,内壁凹凸不平的情况。辅助安装手柄可以进入较深的位置进行吻合,避免了手工缝合时缝合不便的问题。本研究吻合环还配置了不同尺寸,以适应不同部位的血管。
在后续的工作中,我们会对器械进行更深入的研究和改进。刚性吻合环虽能起到支撑作用,但也限制了动脉正常的收缩与舒张,且吻合环需要永久留置于体内,使体内长期存在异物。因此,未来考虑采用可降解材料解决该问题,使吻合环在血管愈合后逐渐降解。这样既保留了其在血管愈合期间的支撑功能,吻合环降解后,不影响血管的舒缩,无体内留置异物。对于吻合器在生理状态下的表现,后续将进行动物实验验证,观察术中吻合时间和渗漏情况,并进行随访指标(吻合口狭窄率、血栓形成、血常规、凝血4项、D-二聚体等)以及病理指标(内中膜损伤、吻合口内皮生长、血管与周围组织粘连、炎症细胞浸润以及周围组织纤维化情况等)的数据采集。
4 结论
本研究基于理想血管吻合的四大原则设计了一种血管吻合器,建立了吻合器吻合血管的有限元模型,研究了血管内膜吻合后的受力情况,探究了吻合器施压距离对血管吻合效果的影响规律,并通过离体实验进行了验证。
研究结果表明,当单侧施压距离为0.3 mm时,吻合效果最好,吻合口密封性良好、渗漏量少,其极值水压为(148.25±0.13) mmHg,最大拉伸力为(6.08±1.78) N,满足临床上对血管吻合的要求。本研究设计的新型血管吻合器探究了新的血管吻合方式,可以实现快速有效的血管吻合,为未来的临床医学研究奠定了基础。
