细胞隧道纳米管结构组分对其形成和维持的影响*
2022-07-25李奥琦邓林红王翔
李奥琦,邓林红,王翔
(常州大学生物医学工程与健康科学研究院,常州 213164)
引言
2004 年Korenkova等[1]报道了一种新的细胞间通讯途径—细胞隧道纳米管(tunneling nanotube,TNT)。该亚细胞结构的命名源于其独特的形态特征:直径在几百纳米、长度为十几至几十微米的管状结构,两端连接于相邻细胞,但不接触培养基底。TNT 由细胞膜、微丝骨架(F-actin)和末端连接蛋白组成,极少数细胞中的 TNT还含有微管骨架[2]。大量研究显示,TNT广泛存在于各种类型的细胞和组织中[2-3]。尤其是,TNT具备从离子、核酸、蛋白质和膜脂等分子到细胞器和囊泡等亚细胞结构的转运功能[3-6]。由于 TNT通讯具有长距离、高特异性和多功能,因而,被称为细胞互联网[7]。
TNT不仅参与细胞正常生理活动,还在一些重大疾病中发挥独特的作用。例如癌症侵袭[8]、病原体传播[9-10]和耐药性[11-13]。因此,探索以 TNT 为潜在靶点的疾病治疗途径,已成为生物医学领域内的共识[3,14]。其中,通过抑制TNT生成来干预TNT介导的细胞间通讯最为直接。肌动蛋白抑制剂如:cytochalasin、latrunculin和tolytoxin已被证实对TNT有抑制效果[6,15-17]。然而,这些药物具有细胞毒性,因此不能作为临床药物[18-19]。许多实验室以微丝蛋白的调控为突破口,探寻 TNT生成的分子机制。在不同细胞体系中相继发现M-sec、p53/Akt/PI3K/mTOR、Myo10、CDC42/IRSp53/VASP 和 Rab11a/Rab8a 等信号途径与 TNT的生成有关[20-24]。然而,不同的信号通路说明, TNT的生成或因细胞特异性而没有一个普适的分子调控机制[25]。因此,寻找靶向TNT的广谱、低毒药物仍是TNT研究领域的重点方向。
鉴于TNT生成的分子机制不一,本研究聚焦于TNT普遍含有的结构成分:微丝骨架、粘附蛋白和胆固醇。通过确定对TNT生成频率和生存时间产生影响的分子,为今后筛选靶向TNT结构的广谱药物提供线索。实验结果表明,破坏微丝骨架、削弱钙黏蛋白连接以及去除膜上的胆固醇,均可减少HEK293细胞间TNT的数量。其中,破坏微丝骨架对TNT的生成频率抑制作用最强,削弱钙黏蛋白连接可有效减少TNT的生存时间,而减少胆固醇水平对TNT的生成频率和生存时间均有一定抑制作用。
1 材料与方法
1.1 材料、试剂与仪器
胚胎肾细胞株HEK293 (human embryonic kidney 293);杜氏改良培养基(Dulbecco′s modified eagle medium,DMEM)、胎牛血清(fetal bovine serum,FBS)、青霉素、链霉素及胰蛋白酶(gibco公司);细胞松弛素D、甲基β环糊精、Filipin III、多聚赖氨酸、鬼笔环肽(sigma 公司);质粒转染试剂盒、N-Cadherin Rabbit Polyclonal Antibody、Alexa Fluor 647标记的山羊抗兔IgG(H+L)(赛默飞公司);乙二醇双(2-氨基乙醇醚)四乙酸(EGTA)、多聚甲醛(国药集团化学试剂有限公司);Triton-X-100(赛尔斯);Cell Counting Kit-8(CCK8)试剂盒(碧云天生物技术有限公司)。
八孔板(ibidi公司);倒置荧光显微镜(cell observer)(德国 Zeiss公司);等离子清洗机(Potentlube PT-5S,深圳三和波达机电科技有限公司); 酶标仪(Infinite F50,Tecan,瑞士)。
1.2 方法
1.2.1细胞培养与转染 HEK293细胞培养于含10%胎牛血清的高糖DMEM 培养液中,并将其置于37℃、5% CO2的细胞培养箱中培养。取对数生长期的HEK293细胞,调整细胞密度为8.0×105个/mL并接种在6孔板中。待细胞密度达到60%后进行转染,按Lipofectamine®3000转染试剂说明书配制转染工作液,并将转染工作液加入到HEK293细胞中,孵育10 h换液。将转染的HEK293细胞消化、稀释后,转移至96孔板中进行单细胞增殖培养,挑选带有Cavin1-EGFP的克隆,以得到稳定表达Cavin1-EGFP的HEK293细胞系。
1.2.2TNT成像和统计 取对数生长期的HEK293细胞进行实验,以 6.0×104细胞/mL 预先接种八孔板中培养36 h, 转移至显微镜的多点成像载物台。显微镜的环境维持系统维持37℃、5% CO2浓度。对八孔板内的多个位点进行长时自动成像:40X/0.6 NA物镜和ORCA-Flash 4.0相机(日本滨松) 进行成像(2 min/帧),持续观察3 h。通过逐帧观察TNT从长度大于10 μM开始到断裂所需的时间,统计出TNT的生存时间。
1.2.3药物处理 将7.0×104细胞/mL 预先接种八孔板中培养48 h后进行药物浓度梯度处理。使用EGTA(10、50、100、500 μM)、甲基β环糊精(10、100、500 μM)、CytoD(10、20、50、100 nM)、低渗(1%、5%、10%、25%)处理细胞1 h,并在0 min和60 min时间点处获取图像,统计分析不同药物浓度下对TNT数量的影响。为了分析药物对TNT的时间效应,进行时间成像(10 min/帧),统计分析2 h内药物对TNT数量的影响。
1.2.4荧光成像和分析 钙黏蛋白和微丝染色:EGTA、cytoD处理前后的细胞用4%多聚甲醛固定30 min后,用0.5% Triton-X 100细胞穿孔液通透化45 min;用10% FBS,0.1% TritonX-100 PBS封闭液室温处理1h。N-cad一抗4℃冰箱孵育过夜。PBS洗3次/5 min,AF647D ANTI-RABBIT二抗室温孵育4 h。取四甲基罗丹明(TRITC)结合的鬼笔环肽(phalloidin),与1×PBS以1∶100比例配制,稀释后的溶液再与DAPI与5 000∶1配制成核-F-actin染液,室温避光染色30 min,最后 PBS洗3次/5 min。用Zeiss 710 共聚焦显微镜于63X/1.4 NA物镜下分别在绿色(647 nm)、红色(564 nm)和蓝色(405 nm)通道对细胞成像。
膜胆固醇染色:Mbc处理前后的细胞经4%多聚甲醛固定30 min后;加入PI工作液对细胞核进行染色,室温孵育15 min;用PBS洗3次/5 min,在室温下用Filipin(PBS中1∶500)孵育2 h。在红色(535 nm)和蓝色(430 nm)通道对细胞成像。通过ImageJ测量有无Mbc处理的细胞的荧光强度。
Cav-EGFP成像:将转染的标记有Cav-EGFP荧光的HEK293细胞以2.5×105个细胞/mL的密度接种在共聚焦皿中,培养36 h后,用25%低渗处理1 h,并在绿色(488 nm)通道对细胞成像。通过ImageJ测量有无低渗处理的细胞的荧光强度。
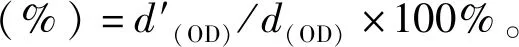
2 结果
2.1 TNT的形成过程及生存时间
通过对活细胞进行DIC时间成像,测量HEK293细胞间TNT的生存时间。图1(a)为HEk293细胞间形成TNT的过程,两个相互接触的细胞向相反的方向迁移(a1),TNT随两个细胞的分离牵拉形成(a2),长度逐渐增加直至断裂,其生存时间约为40 min。通过逐帧检查312个成像数据,本研究记录了TNT(n=207)自产生至断裂的生存时间,见图1(b)。大多数TNT的生存时间小于1 h,少数TNT的生存时间达到3 h。图1(b)箭头表示TNT生存时间的中位数,统计分析表明,HEK293细胞的TNT生存时间的中位数为40 min。

注:(a)中箭头标识TNT,比例尺:10 μM。
2.2 TNT结构的主要组成成分
为研究TNT的结构组分对其生成和维持的影响,需验证HEK293细胞的TNT的结构组分。通过荧光鬼笔环肽染色,首先确认了HEK293细胞间TNT含有其标志性骨架蛋白:微丝(F-actin),见图2(a),这与前人对TNT内细胞骨架的研究一致[26]。在对细胞间粘附蛋白的确认中,本研究聚焦于HEK293细胞普遍表达的N型钙黏蛋白(N-cadherin)[27]。免疫荧光成像显示,TNT末端与细胞连接处存在钙黏蛋白(图2(a)中箭头所示),提示该蛋白是TNT与细胞连接的锚定分子。在对膜组分的研究中,本研究选择了影响细胞膜硬度和流变性的关键成分:胆固醇[28]。利用Filipin荧光探针来标记细胞膜上的胆固醇,共聚焦成像显示,TNT的膜上含有较高水平的胆固醇,见图2(b)。

注:比例尺:20 μM。
2.3 TNT结构组分对TNT数量的影响
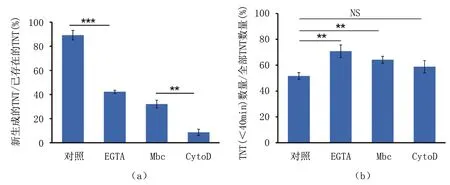
为研究TNT结构组分对其数量的影响,本研究通过药物浓度梯度实验分别干扰TNT的骨架蛋白、粘附蛋白和膜组分,并统计药物处理前后TNT的数量,见图3(a)。利用cytoD通过与G-actin结合而抑制F-actin生成的原理,研究发现50 nM cytoD处理可有效减少TNT数量。EGTA可以通过螯合钙离子而削弱细胞膜间N-cad的相互作用,结果表明,100 μM EGTA可导致TNT数量减少约60%。使用Mbc处理细胞,去除膜胆固醇,结果显示,100 μM Mbc处理可显著减少TNT的数量。此外,为研究膜张力对TNT数量的影响,通过低渗处理来增大膜张力,结果表明,低渗处理对TNT数量变化的影响很小。为进一步研究药物处理时间对TNT数量的影响,使用药物处理前与处理后TNT数量的比值来表征药物的作用效果,见图3(b)。与对照相比,三种药物分别处理细胞1 h后,TNT数量明显下降,继续处理至2 h,TNT数量变化趋于平缓。结合图3(a)结果提示,更高的药物浓度或更长的处理时间无法进一步减少TNT的数量。其中,EGTA和Mbc处理可将TNT数量减少约60%,而cytoD的作用最为明显,药物处理后TNT的数量减少80%。
为验证上述药物处理确实对三个组分产生靶向性破坏作用,本研究检查了药物处理前后细胞中三个组分变化。共聚焦成像显示,50 nM cytoD处理后细胞皮层微丝骨架的完整性下降。100 μM EGTA处理导致细胞间钙黏蛋白连接减少。100 μM Mbc处理后,细胞的Filipin染色荧光强度减弱,说明细胞膜上的胆固醇有明显下降,见图4(a)—(b)。为验证低渗处理增大膜张力,本研究测量了表达Cav-EGFP的HEK293细胞的荧光强度。作为对细胞膜张力敏感的膜蛋白,Cav-EGFP在低渗处理细胞中的丰度比对照组有明显减弱,表明经低渗处理的细胞膜张力增大,见图4(b)。最后,为排除药物处理因产生细胞毒作用而导致TNT数量减少,分别测定了EGTA(100 μM)、Mbc(100 μM)、cytoD(50 nM)、低渗(25%)处理1 h后细胞的琥珀酸脱氢酶水平。药物处理对细胞脱氢酶的酶活未产生明显影响,见图4(c)。通过上述实验证实,干扰微丝、钙黏蛋白和胆固醇可减少TNT数量。

注:比例尺:20 μM。
2.4 TNT结构组分对TNT生成频率和生存时间的影响
TNT的数量取决于TNT的生成频率(新生成TNT)和TNT的生存时间(已生成TNT)。为确定哪种TNT结构组分对其生成频率影响最大,以5 min间隔对HEK293细胞进行2 h活细胞成像,通过计算2 h内新生成TNT与起始TNT的数量比值以评估其生成频率,见图5(a)。与对照组相比,3种药物处理均有效抑制了TNT的生成。其中cytoD比EGTA、Mbc的抑制效果更强,仅为对照组的9.68%,表明F-actin对TNT的生成频率影响最大。
最后,本研究通过对比药物处理前后TNT生存时间中位数的变化,来考察不同结构组分对TNT的生存时间的影响,见图5(b)。在无药物处理的正常情况下,50%的TNT生存时间少于40 min。经EGTA或Mbc处理后,生存时间低于40 min的TNT所占比例明显增多。其中,EGTA处理组最为显著,其TNT生存时间少于40 min的比例高于对照组约20%。而cytoD处理未明显改变TNT生存时间的中位数。该结果提示,钙黏蛋白连接对TNT的生存时间影响最大。
注:**P<0.01,***P<0.001,NS表示无显著性差异。
3 讨论
为研究HEK293细胞间TNT的结构组分对其形成和生存时间的影响,本研究通过DIC显微镜成像,观察并记录了TNT从形成到断裂的生命周期。利用cytoD、EGTA、环糊精和低渗特异性干预TNT的微丝骨架、钙黏蛋白、胆固醇及膜张力,发现对前三者的破坏均会减少TNT的生成频率和生存时间。其中,破坏F-actin对TNT的生存频率的抑制作用最为明显,但对已存在的TNT的生存时间影响较小,表明F-actin对新生成的TNT影响较大。而cytoD对细胞中的骨架具有细胞毒性,不能作为临床药物应用。本研究表明,钙黏蛋白是影响TNT的生存时间的关键分子。因此,通过阻断细胞粘附蛋白(如钙粘蛋白)来减少TNT连接可能是筛选靶向TNT低毒药物的一个方向。未来有必要验证钙粘蛋白拮抗剂如合成线性肽、合成环状肽、非肽基拟肽等[29]对不同类型细胞中TNT数量的影响。此外,本研究还发现环糊精对TNT的生成频率和生存时间的作用均有一定抑制作用。考虑到环糊精作为药物增溶剂已被验证,对人体使用是安全的[30],未来需要进一步验证环糊精对不同细胞类型中TNT的抑制作用。
