牦牛酥油乳脂肪球膜蛋白分离纯化和蛋白组鉴定及功能分析
2022-07-25谈婷罗毅皓孙万成
谈婷,罗毅皓,孙万成
(青海大学 农牧学院,青海 西宁,810016)
牦牛酥油主要以牦牛乳为原料加工而成,其脂肪含量约为87.77%,蛋白质含量仅为1.98%[1]。乳脂肪球膜(milk fat globule membrane, MFGM)具有三层膜结构[2],乳脂球表面是一层厚10~20 nm的薄膜[3]。MFGM蛋白在MFGM中分布不对称,含量为奶牛MFGM的25%~60%,是乳中蛋白质总量的1%~2%[4]。MFGM蛋白主要组成有黏蛋白1(mucin1, MUC1)、嗜乳脂蛋白黄嘌呤氧化还原酶(xanthine oxidoreductase, XOR)、乳脂球表皮生长因子8、组织糖蛋白高碘酸薛夫6/7、脂肪酸转运体蛋白(CD36)、脂肪酸结合蛋白(fatty acid binding protein, FABP)和脂肪细胞分化相关蛋白(adipocyte differentiation related proteins, ADRP或ADPH)等[5]。
目前国内外对乳中蛋白质分离纯化的研究有很多。采用DEAE-52离子交换层析和SephadexG-100凝胶层析可分离纯化驴乳乳清中蛋白质[6]。通过钠离子磷酸盐缓冲溶液和蒸馏水,结合聚乙二醇辛基苯基醚溶液分离得到乳中MFGM蛋白[7]。用Tris-HCl缓冲液及DEAE SepharoseTMFast Flow离子交换柱从牛奶酪蛋白胶束中分离纯化β-酪蛋白和κ-酪蛋白[8]。利用树脂及SephadexG-1 50 层析分离纯化出牛奶中XDH/XO[9-10]。NGUYEN等[11]采用非标记定量液相色谱串联质谱法技术对水牛乳和牛乳MFGM蛋白质组进行比较,筛选出220个水牛乳MFGM蛋白质和234个牛乳MFGM蛋白质。李墨翰等[12]通过蛋白质组学研究驴初乳和驴常乳差异蛋白组,在驴初乳和驴常乳中分别鉴定到216和215种MFGM蛋白。利用聚丙烯酰胺凝胶电泳结合液质联用在人初乳MFGM蛋白中鉴定出1 076种蛋白,在牛初乳MFGM蛋白中鉴定出682种蛋白[13]。
目前国内外对MFGM蛋白质的研究多以乳汁为原料,研究其蛋白质组成和功能特性,对酥油中MFGM蛋白的研究鲜有报道。在青藏高原上,酥油多为牧民家庭手工制作,方法较为多样,可以将牛奶加热熬煮,上层为酥油(粗酥油),下层为乳清和奶渣;或者可以将牛乳静置发酵成全脂酸乳,对酸乳进行上下捶打直到出现脂肪球,加热熬煮浮出酥油[14-15]。酥油制作时将牦牛乳中大部分乳清排除,以酥油为原料提取MFGM蛋白可以在一定程度上减少乳清蛋白对提取结果的干扰,为此本论文利用牦牛酥油提取其MFGM蛋白,并进行纯化,再利用液质联用对纯化前后蛋白进行鉴定,将鉴定后的结果通过基因本体(Gene Ontology, GO)功能注释以及KEGG场景进行分析,对MFGM蛋白组成和潜在功能进一步挖掘,为后期深入研究酥油MFGM蛋白提供理论依据。
1 材料与方法
1.1 材料与试剂
酥油,青海省河南蒙古族自治县牧民家。
Real Band蛋白预染Marker、3kDa超滤管、costar 96孔板,上海生工生物工程股份有限公司;溴酚蓝,上海广诺化学科技有限公司;考马斯亮蓝R-250、SDS-PAGE凝胶制备试剂盒,福州飞净生物科技有限公司;甘氨酸、SDS、Tris、曲拉通X-100,北京索莱宝科技有限公司;福林酚、牛血清白蛋白V(bovine serum albumin,BSA)、Na2CO3、CuSO4、酒石酸钠、NaH2PO4、Na2HPO4、NaOH、KCl、KH2PO4、NaCl、蔗糖,天津市河东区红岩试剂厂。
1.2 仪器与设备
Q Exactive Plus液相色谱质谱联用仪,赛默飞世尔科技(中国)有限公司;AKTA pure 25蛋白质纯化系统、DEAE-Sepharose FF(DEAE琼脂糖凝胶),美国GE公司;Mini-PROTEAN Tetra Cell凝胶垂直电泳系统、GelDoc XR System凝胶成像系统,美国伯乐公司;5424台式高速离心机,湖南赫西仪器装备有限公司;ESJ110-413电子天平,上海良平仪器仪表有限公司;HH-6水浴锅,常州市金坛友联仪器研究所;PHS-3C 型pH计,上海佑科仪器仪表有限公司;UV-1780紫外可见分光光度计,岛津仪器(苏州)有限公司。
1.3 实验方法
1.3.1 牦牛酥油MFGM蛋白分离纯化及组分分析
1.3.1.1 牦牛酥油MFGM蛋白提取
参照文献[7]的方法,略有修改。用pH为7.4的钠离子磷酸盐缓冲溶液和蒸馏水对牦牛酥油中乳脂肪粗提物洗涤,加入体积分数为3.4% 的聚乙二醇辛基苯基醚溶液和2.6%的钠离子磷酸盐缓冲溶液溶解MFGM上的脂质而得到MFGM蛋白。
1.3.1.2 MFGM蛋白含量测定
用福林酚法(Lowry法)测定蛋白质含量。紫外可见双光束分光光度计在 500 nm 下比色测定,以 BSA 为标品制作标准曲线[16]。
1.3.1.3 牦牛酥油MFGM蛋白分离纯化
利用AKTA pure 25M蛋白质纯化系统阶跃梯度法洗脱。将MFGM蛋白用PBS稀释成2 mg/mL备用,用PBS平衡层析柱10个柱体积,取样品溶液500 μL上样,用PBS清洗阴离子交换柱,再用洗脱液进行洗脱,不同浓度NaCl洗脱液占比为30%、50%、80%,收集峰值处的溶液,放于离心管标记贮藏[17]。
1.3.1.4 阶跃梯度洗脱法提取MFGM蛋白FABP 3正交实验
根据单因素实验结果,以FABP 3得率为指标,通过L16(44)正交试验,考察PBS的pH、洗脱液浓度、洗脱流速、洗脱体积对FABP 3得率的影响,确定FABP 3最优纯化工艺。
1.3.1.5 SDS-PAGE
本研究通过SDS-PAGE根据分子质量大小对蛋白质进行分离,用5% 的浓缩胶和8% 的分离胶制作底胶,采用Tris-甘氨酸-SDS 为电泳缓冲液,分离胶采用25 mA电流,浓缩胶提高电流至35 mA。结束后用考马斯亮蓝R-250 染色1~2 h,再用脱色液脱色直至底胶清晰,采用Bio-Rad凝胶成像系统和image.lab软件以获得最优图像并拍照分析。
1.3.1.6 质谱检测及数据分析
质谱分析由迈维代谢公司完成。质谱分析使用Thermo公司的Q Exactive Plus液质联用系统进行。样品通过纳升流速的液相UltiMate 3000 RSLCnano系统进行分离。肽段样品经过上样缓冲液溶解,富集到C18捕获柱(3 μm, 120 Å, 100 μm×20 mm),再经分析柱(2 μm, 120 Å, 75 μm×150 mm)分离。利用2个流动相(流动相A:3% DMSO, 0.1%甲酸, 97% H2O和流动相B:3% DMSO, 0.1%甲酸, 97% ACN)建立分析梯度。液相的流速设置为300 nL/min。质谱DDA模式分析时,每个扫描循环中包含一个MS全扫描,以及随后的15个MS/MS扫描。HCD碰撞能量28;四级杆的筛选窗口1.6 Da;离子重复采集的动态排除时间35 s。
1.4 计算公式
MFGM蛋白得率按公式(1)计算:
(1)
式中:YMFGM,牦牛酥油MFGM蛋白得率,%;mMFGM,提取的MFGM蛋白冻干粉质量,g;m,原料酥油质量,g。
MFGM蛋白质含量按公式(2)计算:
(2)
式中:WMFGM,牦牛酥油MFGM蛋白含量,%;C1,福林酚测得蛋白质浓度,mg/mL;C0,MFGM蛋白粗品质量浓度,mg/mL。
AKTA pure 25M系统配有UV检测器,在洗脱过程中会形成紫外吸收曲线和紫外吸收峰。FABP 3含量按公式(3)计算:
(3)
如公式(4)(5)(6)所示,由朗伯-比尔定律可得:
(4)
CMFGM=0.1 g/50 mL=2 mg/mL
(5)
(6)
式中:YFABP 3,FABP 3得率,%;CFABP 3,所收集组分中FABP 3的质量浓度,mg/mL;A,组分平均紫外吸收,AU;S,紫外峰面积,由ATKA pure 25M系统自动积分算出,mL×mAU;V1,所收集组分的体积,mL;V2,上样量0.5 mL;d,UV紫外流通池长度,cm,根据AKTA pure 25M系统说明书,d=0.2 cm;Ext.coef,在使用波长下蛋白的消光系数。
经Uniprot数据库查询FABP 3(序列号:E5G7E7),再经过ExPASy工具输入该蛋白氨基酸序列算出FABP 3在280 nm下的消光系数为0.946 [L/(g·cm)]。
将公式(1)(2)(3)(4)整理得到公式(7)(8):
(7)

(8)
式中:C总,FABP 3在牦牛酥油中的质量浓度,mg/mL;V酥油,酥油融化的体积,mL;mMFGM,酥油粗提MFGM蛋白的总质量,mg。
1.5 数据处理与分析
使用SPSS 26.0进行方差分析;Q Exactive Plus产生的质谱数据通过MaxQuant (V1.6.2.10)进行检索,采用的数据库检索算法是MaxLFQ。检索使用的数据库是Uniprot中Bos的蛋白质组参考数据库。
2 结果与分析
2.1 牦牛酥油MFGM蛋白分离纯化及组分分析
2.1.1 牦牛酥油MFGM蛋白含量
将MFGM蛋白用蒸馏水溶解成2 mg/mL溶液后,用Lowry法测定蛋白质含量,以BSA为标准品,得到标准曲线y=0.001 4x+0.005 4,R2=0.993 2。根据公式(2)计算MFGM蛋白含量为22.28%。蛋白含量较低,表明MFGM蛋白提取后仍残留一些MFGM其他成分如磷脂、鞘磷脂、甘油三酸酯、胆甾醇及盐类[18]。
2.1.2 阶跃梯度洗脱法提取MFGM蛋白FABP 3正交试验
在单因素试验的基础上,为综合考虑各因素对牦牛酥油MFGM蛋白FABP 3得率的影响,进行正交试验确定最佳的纯化工艺条件,正交试验因素水平见表1,正交试验结果见表2。

表1 正交试验因素水平表L16(44)Table 1 Orthogonal experiment factors and levels L16 (44)
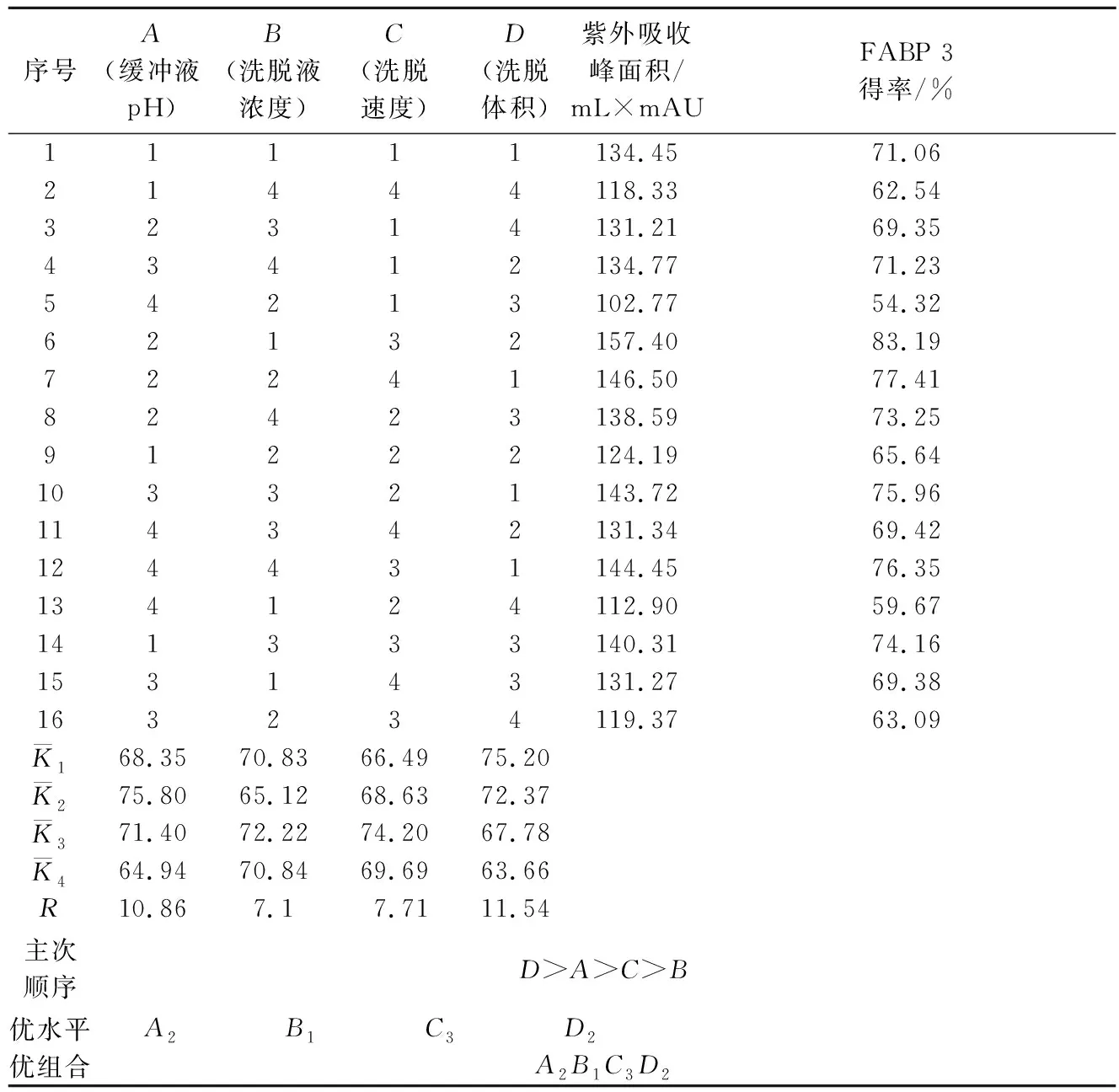
表2 正交试验结果表Table 2 Results of orthogonal test
对正交试验结果进行极差分析,如表3所示。各因素对牦牛酥油MFGM蛋白中FABP 3的提取效果影响次序为:RD>RA>RC>RB,即洗脱体积对牦牛酥油MFGM蛋白中FABP 3的提取效果影响最大,再依次是缓冲液pH、洗脱速度和洗脱液浓度。FABP 3的最优提取工艺组合为A2B1C3D2,即洗脱体积为50 mL,缓冲液pH为7.4,洗脱速度为1.6 mL/min,洗脱液浓度为0.50 mol/L时,该条件下,FABP 3的得率达83.19%。

表3 FABP 3提取正交试验方差分析表Table 3 FABP 3 extraction of orthogonal test variance analysis table
F检验结果表明,洗脱体积、缓冲液pH、洗脱液浓度、洗脱速度对MFGM蛋白FABP 3提取得率影响差异显著(P<0.05)。
2.1.3 FABP 3得率及浓度计算
利用AKTA pure 25M蛋白纯化系统,结合阴离子交换柱对牦牛酥油MFGM蛋白FABP 3洗脱纯化。阴离子交换柱交换基质由带正电荷的树脂或纤维素组成,其交换基质结合带有负电荷的蛋白质,这类蛋白质被吸附在柱子上,通过提高洗脱液中盐浓度等措施将吸附在柱子上的蛋白洗脱下来[19]。FABP 3等电点是6.73,将MFGM蛋白用pH 7.0的PBS溶解,使目标蛋白带负电荷上样后被吸附在柱子上,洗脱时进一步调整洗脱A液PBS的pH提高洗脱得率。洗脱条件选择和AKTA pure 25M操作方法在孙琳[17]研究基础上略有改动。
如图1利用AKTA pure 25M系统进行纯化操作。待柱平衡后,将V2体积的MFGM溶液注入AKTA pure 25M系统进行洗脱,洗脱过程中出现3个紫外吸收峰,第1个紫外峰为流穿峰,所收集的组分为杂蛋白[17];经SDS-PAGE证实,第2个紫外吸收峰为目的蛋白形成的洗脱峰,即所收集的组分是FABP 3;第2个紫外吸收峰的面积为S,代入公式(7)和公式(8),得到FABP 3得率和酥油中FABP 3的浓度。

图1 阶跃梯度洗脱层析图Fig.1 Step gradient elution chromatogram
2.1.4 粗提MFGM蛋白质和纯化MFGM蛋白组分分析
2.1.4.1 SDS-PAGE法分析MFGM蛋白质组分
取等量的粗提MFGM蛋白和纯化后的MFGM蛋白,用分离胶浓度为8%、浓缩胶浓度为5%的变性聚丙烯凝胶电泳分析样品中的蛋白质组成,结果如图2所示。
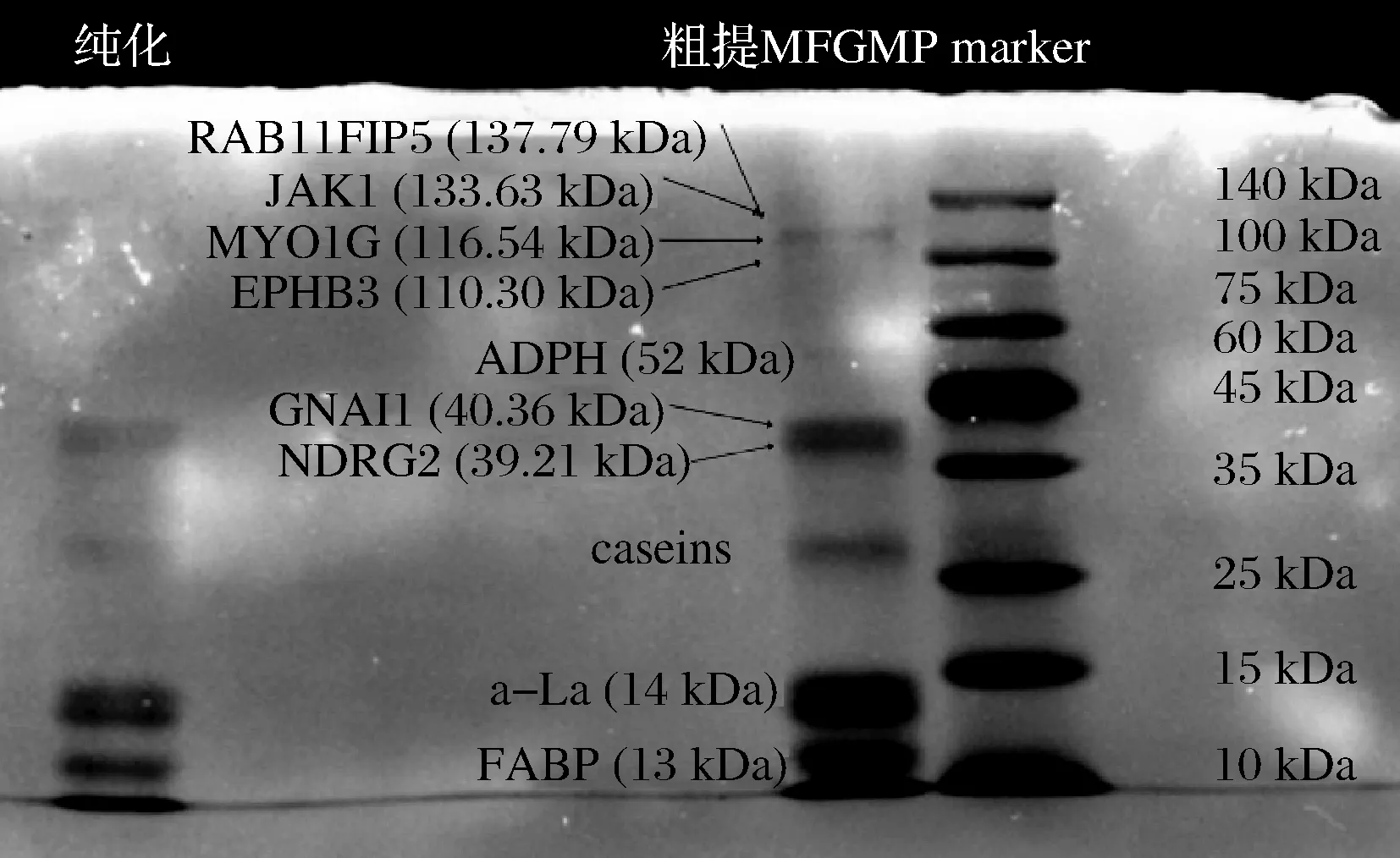
图2 MFGM蛋白经SDS-PAGE结果图Fig.2 SDS-PAGE results of MFGM protein
本研究粗提酥油MFGM蛋白鉴定出7个电泳条带,根据相关文献研究结果[20-22],和蛋白marker条带根据分子质量大小比对,从上至下,第1个条带显示蛋白可能是RAB11家族相互作用蛋白5(RAB11FIP 5)、肌球蛋白IG(JAK1)、受体蛋白酪氨酸激酶(MYO1G)和酪氨酸蛋白激酶(EPHB 3)。其中MFGM蛋白主要有FABP 3、鸟嘌呤核苷酸结合蛋白G(i) α-1(GNAI 1)、蛋白质NDRG2和脂肪细胞相关蛋白(ADPH)4种。粗提和纯化蛋白均在13 kDa处都形成了较明显的区代(图2),与FABP 3理论分子质量一致。粗提MFGM蛋白质中还含有部分未除去的酪蛋白、乳球蛋白和乳白蛋白。MFGM蛋白经AKTA pure 25M纯化后,去除了部分酪蛋白和乳清蛋白以及脂肪细胞相关蛋白(ADPH)和分子质量位于100 k~140 kDa的高分子质量蛋白,显著提高了牦牛酥油FABP 3的纯度。
2.1.4.2 LC-MS/MS分析MFGM蛋白组分
样品经质谱检测共鉴定到以FABP 3、脂蛋白脂肪酶、α-S1-酪蛋白、肌动蛋白,细胞质 1、L-乳酸脱氢酶、β-乳球蛋白、乳转铁蛋白等为主的31种蛋白。纯化后蛋白主要是FABP 3。
根据表4,粗提和纯化MFGM蛋白主要是 α-S1-酪蛋白和FABP 3,经iBAQ处理,粗提MFGM蛋白FABP 3含量为20.005%,纯化MFGM蛋白FABP 3含量为13.542%。
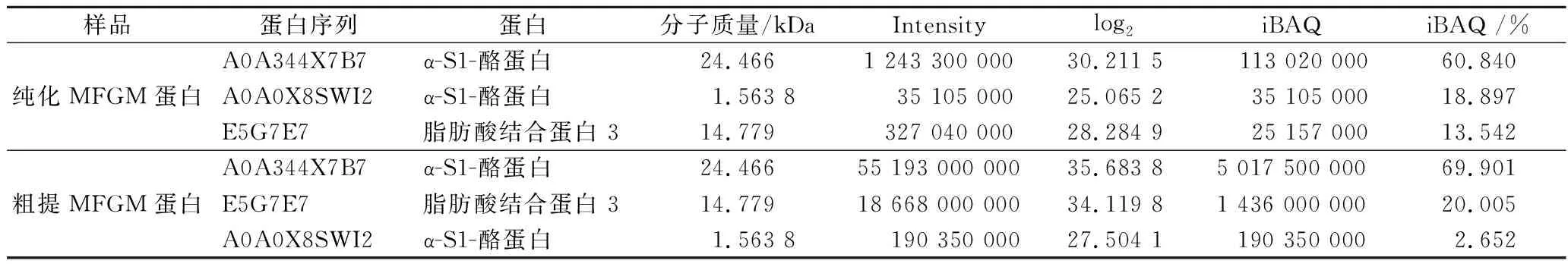
表4 iBAQ定量主要蛋白结果展示Table 4 Demonstration of iBAQ quantitative analysis of major proteins
2.1.4.3 粗提MFGM蛋白和纯化MFGM蛋白热图分析
热图分析结果如图3所示,纯化后脂肪球膜蛋白种类变少,说明在纯化过程中去除了转录调节因子等17种蛋白,纯化前后高丰度蛋白主要是α-S1-酪蛋白和FABP 3,其中FABP 3是MFGM蛋白中一种膜蛋白。

图3 粗提和纯化MFGM蛋白热图分析图Fig.3 Cluster analysis diagram of crude and purified MFGM protein注:红色表示蛋白表达量高;蓝色表示蛋白表达量低;每列表示一次重复试验,每行表示一个蛋白质
李玮轩[20]在驴初乳和常乳中鉴定到61种差异性表达MFGM蛋白。本实验中粗提MFGM蛋白和纯化MFGM蛋白差异蛋白种类见表5,其中列出了主要的17种差异蛋白,少于驴初乳和驴常乳差异性表达蛋白种类。

表5 粗提和纯化MFGM蛋白中的差异蛋白Table 5 Differential expressed protein of crude and purified MFGM protein
2.1.4.4 粗提MFGM蛋白和纯化MFGM蛋白GO注释
如图4所示,从生物过程、细胞组分、分子功能分析所有31种粗提MFGM蛋白和纯化MFGM蛋白,用GO功能注释分析对所有蛋白进行注释,分子功能富集分析中有22种蛋白主要富集在结合作用;28种蛋白在细胞解剖学实体组分内高度富集;有22种蛋白主要参与生物调节过程。

图4 粗提和纯化MFGM蛋白差异蛋白GO功能注释图Fig.4 Functional annotation of GO terms crude and purified MFGM protein
如图5所示,对粗提MFGM蛋白和纯化MFGM蛋白20种差异蛋白进行GO注释,参与的主要生物过程有生物调节、刺激反应、多细胞组织化过程、代谢过程等16类。在分子功能富集分析中,差异MFGM蛋白主要富集在结合作用、催化活性、分子功能调节器、转运等6类分子功能中。此外MFGM蛋白主要在细胞、细胞解剖学实体、细胞内等5类细胞组分内高度富集。以往研究表明MFGM蛋白可以通过上调Akt和mTOR蛋白激酶的表达,显著促进细胞生长,抑制C2C12细胞凋亡[23]。酥油MFGM蛋白GO注释分析可为MFGM蛋白生物学具体作用机制研究提供参考。

a-生物学过程(BP);b-细胞组成(CC);c-分子功能(MF)图5 粗提和纯化MFGM蛋白差异蛋白GO注释Fig.5 GO annotation of the differential protein between crude and purified MFGM protein
对筛选的差异蛋白进行了3个层级3个类别的GO注释。生物学过程(biological process,BP),细胞组成(cellular component,CC)与分子功能(molecular function,MF)的二级GO注释结果如图5所示。
2.1.4.5 粗提MFGM蛋白和纯化MFGM蛋白差异蛋白KEGG通路分析
20种差异蛋白参与的前15条通路如图6所示,参与的代谢途径分别是内质网中蛋白质加工、军团杆菌病、抗原的处理和表达、弓形虫病、吞噬体、程序性细胞坏死、代谢信号转导通路、麻疹、长寿调节通路-多个物种、甲型H1N1流感、雌激素信号通路、爱泼斯坦-巴尔二氏病毒感染、内噬作用、阿尔兹海默症、糖异生作用。其中差异蛋白参与最多的通路是内质网中蛋白质加工,FABP 3参与与免疫相关的过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)信号通路[24]。

图6 粗提和纯化MFGM蛋白差异蛋白KEGG通路分析图Fig.6 KEGG pathway analysis diagram of crude and purified MFGM protein
2.1.4.6 参与内质网中蛋白质的加工相关的蛋白及KEGG通路分析
由表6可知,通过在线KEGG通路检索,牦牛酥油MFGM差异蛋白中有3种蛋白参与内质网中蛋白质的加工。

表6 参与内质网中蛋白质的加工KEGG通路的蛋白Table 6 Proteins involved in the processing of the KEGG pathway for proteins in the ER
由图7可知,红色标注代谢物上调,蓝色标注代谢物下调。3种蛋白质在该通路中调控代谢物甘露糖寡糖a-1,3-葡萄糖苷酶上调进一步诱导凝集素的形成和去糖基化,进而调控蛋白质在内质网中的加工,进一步运输至高尔基体中对蛋白质加工;通过下调分子伴侣HtpG和热休克70 kDa蛋白1/2/6/8,进而抑制内质网相关降解过程。
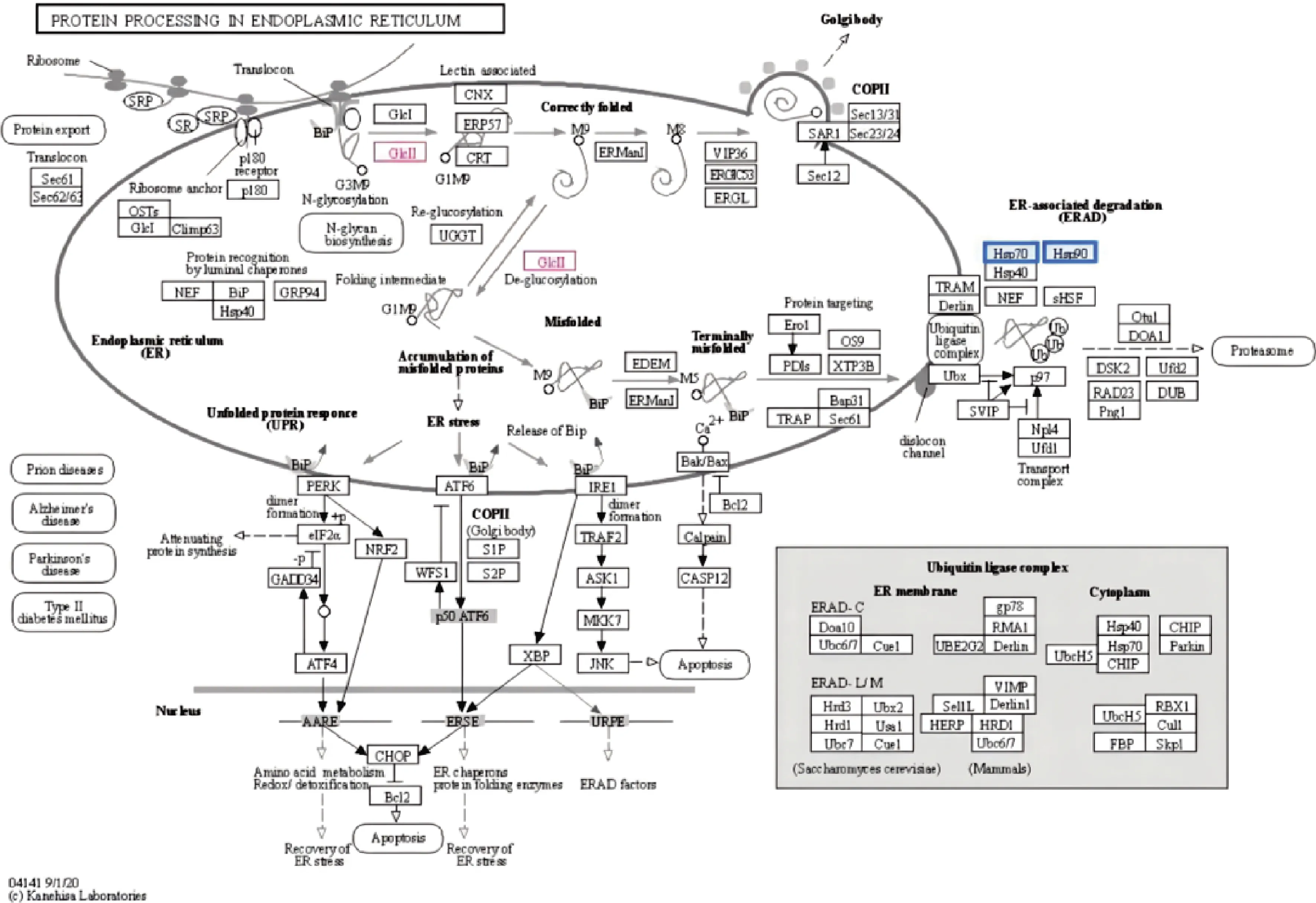
图7 内质网中蛋白质的加工Fig.7 Protein processing in endoplasmic reticulum
2.1.4.7 参与PPAR信号通路相关的蛋白及KEGG通路分析
KEGG代谢通路分析得出,牦牛酥油MFGM差异蛋白参与PPAR信号通路的蛋白质是FABP 3。
通过在线KEGG通路检索,牦牛酥油MFGM蛋白FABP 3参与内分泌系统——PPAR信号通路。PPAR是由脂肪酸及其衍生物激活的核激素受体[25]。PPAR 有3种亚型(PPARα、β/δ和γ),它们分别编码在一个单独的基因中,并结合脂肪酸和类花生酸[26],参与脂质代谢和炎症的控制,并在所有主要细胞类型的动脉粥样硬化病变中表达[27]。PPARα通过调节肝脏和骨骼肌中脂质代谢蛋白的基因表达,在清除循环或细胞脂质中发挥作用,控制许多参与细胞脂肪酸进入和氧化的基因的表达,在正常和病变心脏能量代谢基因调控中发挥作用[28]。PPARβ/δ参与脂质氧化和细胞增殖。推测FABP可以通过PPARγ促进脂肪细胞分化以提高血糖摄取[29]。
由图8可知,FABP的表达诱导肝脏骨骼肌、骨骼肌脂肪细胞、脂肪相关代谢物表达,进而使PPAR在3种亚型中均被不饱和脂肪酸和9-顺式-视黄酸激活后通过识别特异的核苷酸序列并与之结合来启动和调控FABP 3和FABP 4的表达。推测FABP 3可能参与其中与脂肪酸降解、胆汁酸合成、甘油磷脂代谢相关的类脂物代谢作用,FABP 4参与脂肪细胞分化,但并未通过该数据库查找到具体作用位点。为进一步探究脂肪酸结合蛋白3的作用位置和参与途径提供参考。

图8 PPAR信号通路Fig.8 PPAR signaling pathway
同时FABP的表达诱导了3种亚型PPAR信号通路的代谢,在a-亚型通路中,PPARα被不饱和脂肪酸、饱和脂肪酸、类十二烷酸、纤维化药物、非甾体抗炎药和9-顺式-视黄酸激活;PPARβ/δ被不饱和脂肪酸和9-顺式-视黄酸激活;PPARγ被不饱和脂肪酸、类十二烷酸、噻唑烷衍生物、非甾体抗炎药和9-顺式-视黄酸激活;3种亚型被激活后通过识别特异的核苷酸序列并与之结合来启动和调控线粒体解偶联蛋白1(uncoupling protein 1, UCP 1)的表达。UCP 1是来自小鼠棕色脂肪的线粒体解偶联蛋白,UCP 1是唯一在褐色脂肪组织(brown adipose tissue,BAT)中表达的解偶联蛋白质,有别于解偶联蛋白家族其他成员的功能,UCP 1的主要功能是参与BAT的产热调节和能量代谢来维持机体的能量代谢平衡[30]。目前有研究指出UCP 1基因启动子核苷酸片段形成的G-四链体构型调节其表达,具有诱导白色脂肪棕色化的潜力,在肥胖的防治中有一定的应用开发价值[31]。
3 结论
本论文对牦牛酥油中MFGM蛋白FABP 3的分离纯化工艺进行优化,得出最优条件:洗脱体积50 mL,缓冲液pH 7.4,洗脱速度1.6 mL/min,洗脱液浓度0.50 mol/L,该条件下FABP 3的得率达83.19%。
采用SDS-PAGE和液质联用对纯化前后酥油MFGM鉴定,共鉴定到31种MFGM蛋白和20种差异蛋白。GO分析结果表明,在生物过程方面,这些蛋白质参与生物调节、刺激反应、多细胞组织化过程、代谢过程等;细胞成分方面,在细胞、细胞解剖学实体、细胞内等5类细胞组分内高度富集;在分子功能方面,主要参与结合作用、催化反应、分子功能调节器、转运等等。
通过KEGG代谢通路分析可知,牦牛酥油MFGM蛋白纯化前后差异蛋白共参与15条KEGG代谢通路,其中有3种蛋白参与了内质网中蛋白质加工相关的KEGG通路,进而调控内质网蛋白质的加工;FABP 3参与了PPAR信号通路,推测可能参与其中与脂肪酸降解、胆汁酸合成、甘油磷脂代谢相关的类脂物代谢作用,为进一步探究牦牛酥油FABP 3的作用位置和参与途径提供参考。
