基于二氧化钛复合光催化材料的制备及其可见光光催化性能研究
2022-07-25郭婷婷尹云军
郭婷婷 尹云军 于 淼
(中国恩菲工程技术有限公司, 北京 100038)
0 前言
二氧化钛(TiO2)光催化材料在应用过程中存在光谱吸收范围窄、光利用率较低,以及难回收、光生电子- 空穴对易复合而失活等问题[1-2]。为了解决以上问题,研究人员大多利用半导体复合、非金属或金属氧化物掺杂等方法对二氧化钛进行改性[3-5]。其中,铋系光催化剂Bi2WO6、Bi2O2CO3、Bi2MoO6、BiOX(X=I, Br, Cl)具有高效的可见光响应能力,近年来备受关注。
制备Bi复合TiO2的光催化剂的方法主要包括溶胶- 凝胶法、水热法、乳液静电纺丝法等,产品包括Bi2WO6/TiO2、BiOCl/TiO2、BiOI/TiO2、Bi2S3/TiO2、BiVO4/TiO2等[6-7]。Bi的氧化物能够与TiO2形成异质结构的晶面,不仅能减少禁带宽度,扩大可见光区域的吸收,还能延长电子和空穴的分离时间,从而提高光催化降解污染物的效率。
Bi2O3- TiO2光催化氧化技术对有机污染物的降解能力强且无选择性,但是还存在对污染物的吸附能力差、光催化氧化后难以分离等缺点。由于光催化材料对水中微量污染物的吸附能力直接决定了光催化氧化降解的效果,为了解决上述问题,可以将TiO2负载到具有吸附和易分离功能的载体上,以增强材料的分离特性,并提高材料对污染物的吸附效果和可见光光催化氧化效果[8]。
本文采用溶胶- 水热- 煅烧法制备了具有高效可见光催化氧化作用的新型Bi2O3- TiO2纳米复合材料,并采用X射线衍射(XRD)、X射线光电子能谱(XPS)、扫描电镜(SEM)、透射电镜(TEM)、氮气吸附脱附和紫外可见固体漫反射能谱等手段,对Bi2O3- TiO2纳米复合材料的结构特性、表面形貌和光响应能力进行了表征。以甲基橙染料为目标污染物,在可见光辐照的条件下筛选出可见光光催化氧化性能最佳的Bi2O3- TiO2纳米复合材料,并研究了其降解甲基橙的效能。
1 实验材料与方法
1.1 实验试剂与用水
光催化复合材料制备实验中所用的主要药品为钛酸四丁酯(C16H36O4Ti)(阿拉丁试剂厂,中国)、五水合硝酸铋(Bi(NO3)3·5H2O)(阿拉丁试剂厂,中国)、无水乙醇(C2H6O)(北京化学试剂厂,中国)、冰醋酸(CH3COOH)(北京化学试剂厂,中国)、甲基橙(C14H14N3NaO3S)、1,4-苯醌(C6H4O2)(阿拉丁试剂厂,中国),聚乙二醇(PEG- 400)(默克公司,美国)。以上药品均为分析纯。实验所用水样均为人工采用超纯水配置(超纯水机,MilliQ Advantage A10, Millipore,美国)。
1.2 可见光光催化氧化反应装置
可见光光催化氧化反应装置如图1所示,由光源、反应器、冷却井、磁力搅拌器、蠕动泵和低温冷却机组成。采用300 W的氙灯发生装置(CEL- HXF300E7,中国)作为激发光源,通过滤光片将光源调节为3种光:紫外光(波长200~400 nm)、可见光(波长400~760 nm)和太阳光(波长200~760 nm)。反应器由锡箔纸包围,以免泄露紫外光,造成人体损害。采用磁力搅拌使光催化材料与水充分混合,利用低温冷却机和蠕动泵使光催化反应始终处于温度25 ℃的条件下。

图1 可见光光催化氧化反应装置示意图
1.3 材料表征方法
1.3.1 晶体结构表征
采用X射线衍射仪(XRD)(D8 Advance 普鲁克,德国)对样品进行测试,样品量为1.0 g,射线源为Cu- Kɑ,扫描范围10°~90°,利用Jade 6.0软件对测试结果进行晶格分析。
1.3.2 表面元素组成检测
采用X射线光电子能谱分析仪(XPS)(PHI Quantera SXM,日本)测试制备的光催化复合材料的表面元素和价态,样品含量大于5 mg,测试结果利用XPS peak分峰软件进行分析。
1.3.3 表面形貌表征
采用冷场发射扫描电子显微镜(FE- SEM,日立高科SU- 8010,日本)对光催化复合材料的表面形貌、元素含量进行测试和表征,测试台需要进行喷金处理。采用高分辨透射电子显微镜(HR- TEM,JME 2100F,日本电子)对复合材料的形貌、内部结构、晶格间距以及类型进行表征。
1.3.4 比表面积及孔径检测
采用氮吸附比表面积与孔分布测试仪(TRISTAR II 3020M, 美国麦克)对材料进行表面积、孔容积和孔分布等测试,采用氮气吸附脱附的方法,吸附脱附时间为10 h。
1.3.5 紫外可见漫反射分析
采用紫外- 可见分光光度计(U- 3900,日本日立)对材料进行固体漫反射测试,扫描范围190~900 nm。
2 结果与讨论
2.1 Bi2O3- TiO2纳米复合材料制备方法与表征
分别选取煅烧温度为400 ℃、500 ℃、600 ℃,制备Bi掺杂量为1%、5%、10%和12%的Bi2O3- TiO2纳米复合材料。
2.1.1 具体制备方法
取10 mL的钛酸四丁酯和5 mL冰醋酸缓慢加入40 mL无水乙醇中,边加边搅拌,得到A液;再取一定量的硝酸铋溶于50 mL去离子水中,充分混合得到B液;将B液逐滴滴入A液后搅拌5 h得到浅黄色溶胶。然后将溶胶移入水热反应釜中,在150 ℃的条件下反应12 h;待反应釜冷却后,将粉体进行抽滤、去离子水清洗、干燥等步骤;将干燥后的块状固体碾成粉末并置于管式炉中在空气条件下煅烧3 h,自然冷却后将复合材料置于干燥器中备用。
2.1.2 特性表征
2.1.2.1 晶体结构特性
在制备温度600 ℃下,不同铋掺杂量的Bi2O3- TiO2复合材料和TiO2的XRD对比如图2所示。从图2可知,Bi2O3- TiO2复合材料存在锐钛矿晶相。与TiO2的结果相比,不同铋掺杂量的Bi2O3- TiO2复合材料在39.67°、63.29°、77.25°的衍射峰(分别对应锐钛矿的(112)、(213)、(301))晶面呈现减弱或消失的现象。这间接地说明制备的纳米复合材料中含有铋的氧化物,但由于铋的掺杂含量低,在XRD谱图中未能检测到Bi2O3晶相。

图2 不同铋掺杂量Bi2O3- TiO2复合材料和TiO2的XRD对比
通过XRD的数据也可了解到,TiO2、Bi2O3- TiO2(1%-600 ℃)、Bi2O3- TiO2(5%-600 ℃)、Bi2O3- TiO2(10%-600 ℃)、Bi2O3- TiO2(12%-600 ℃)的平均晶体粒径都在50 nm以下。TiO2的粒径为43.2 nm,Bi2O3- TiO2(10%-600 ℃)的平均晶体粒径为11.6 nm。相比TiO2,Bi2O3- TiO2(10%-600 ℃)的平均晶体粒径更小,这说明在纳米复合材料制备的过程中,氧化铋的形成能够抑制TiO2晶格增长,降低纳米复合材料整体的平均晶体粒径。另外,晶体粒径随着煅烧温度和铋掺杂量的提高而增加,这是由于在Bi2O3和TiO2晶面间新生成了Bi- O- Ti异质晶面,该界面的产生可以提高光催化氧化效果[5],平均粒径的增加也反映了晶体的聚集程度增加。
不同煅烧温度下Bi2O3- TiO2复合材料和TiO2的XRD图谱如图3所示。由图3可知,不同煅烧温度下制备的复合材料均存在锐钛矿型TiO2,其对应的衍射峰是101。
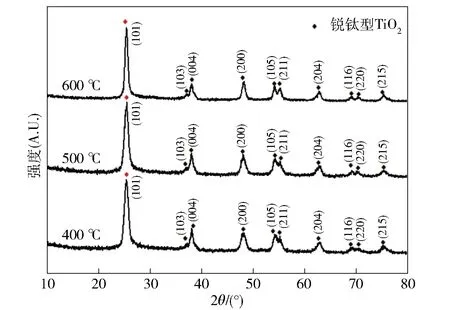
图3 不同煅烧温度下Bi2O3- TiO2纳米复合材料X射线衍射图谱
2.1.2.2 表面元素组成
利用XPS分析Bi2O3- TiO2(10%-600 ℃)纳米复合材料的表面元素和价态组成,结果如图4所示。

图4 Bi2O3- TiO2(10%-600 ℃)纳米复合材料的X射线光电子能谱图
从图4可以看出,纳米复合材料由钛(Ti)、铋(Bi)、氧(O)3种元素组成。图4(a)为Ti 2p 的高分辨电子能谱图,Ti 2p3/2 峰和 Ti 2p1/2峰分别对应的结合能为458.7 eV和464.8 eV,表明钛元素的价态为正四价,图中没有出现正三价和正二价的钛元素对应的衍射峰[7]。在图4(b)中,Bi 4f 7/2峰的结合能为158.8 eV, Bi 4f 5/2的结合能为164.5 eV,表明复合材料中含有氧化铋[9]。在图4(c)中,O 1s的结合能为529.6 eV,表明氧属于TiO2中的氧元素。上述检测结果表明,制备的Bi2O3- TiO2(10%-600 ℃)纳米复合材料含有TiO2和Bi2O3等物质。XRD和XPS的分析证明了纳米复合材料的主要元素构成,说明所选择的制备方法适宜。
2.1.2.3 表面形貌特征
Bi2O3- TiO2(10%-600 ℃)纳米复合材料的表面形貌特征和元素含量如图5所示。从图5可知,Bi2O3- TiO2(10%-600 ℃)纳米复合材料的颗粒分布均匀,仅有少量松散团聚现象,粒径为12~13 nm,与XRD计算结果一致。

图5 Bi2O3- TiO2(10%-600 ℃)纳米复合材料的电镜图
2.1.2.4 比表面积特性
氮气吸附脱附法分析的Bi2O3- TiO2(10%-600 ℃)纳米复合材料的比表面积和孔径分布如图6所示。从图6可知,纳米复合材料的比表面积为68.9 m2/g,介孔孔径范围为6.0~20.0 nm,孔径为15.3 nm。依据国际理论和应用化学联合会的规定,在相对压力0.7

图6 Bi2O3- TiO2(10%-600 ℃)纳米复合材料的比表面积和孔分布图
2.2 Bi2O3- TiO2可见光光催化特性研究
2.2.1 铋掺杂量优化
在煅烧温度为600 ℃条件下,制备了Bi掺杂量分别为1%、5%、10%和12%的Bi2O3- TiO2纳米复合材料,以10 mg/L的甲基橙溶液为目标污染物,研究这4种纳米复合材料可见光催化氧化甲基橙的降解效果。光催化剂的投加量均为1 g/L,进行1 h暗反应吸附平衡后,经过120 min的可见光光催化反应,结果如图7所示。
从图7可以看出,随着反应时间的增加,4种掺杂量的Bi2O3- TiO2纳米复合材料均能在可见光辐照的条件下对甲基橙产生不同程度的光催化氧化作用。随着铋掺杂量的增加,甲基橙的光催化氧化降解率逐渐升高。当反应进行120 min时,铋掺杂量为10%的复合材料光催化氧化降解甲基橙的效果最好(降解率达93.6%)。Bi2O3- TiO2纳米复合材料中所形成的Bi- O晶面数量随着铋掺杂量的增加而增多,而Bi- O晶面的数量增多不仅能够增加活性位点的数量,还可以作为电子的俘获中心,延长光生电子和空穴的寿命,从而提高纳米复合材料的光催化效果。因为Bi与TiO2的能带位置不同,Bi与TiO2的掺杂加速了光生载流子的转移和分离过程,从而诱导产生了更佳的催化剂和更好的光催化活性。Bi和TiO2在掺杂过程中形成了氧的空位缺陷,这些缺陷的存在充当了光生电子或空穴的捕获中心,形成了更多的光催化活性位,从而降低了TiO2的禁带宽度,改善了可见光的响应性能。因此,在一定范围内,Bi离子量越高,Bi2O3- TiO2纳米复合材料光催化剂的活性越好。当铋掺杂量高于最优值(10%)时,过高的铋含量造成大量的氧化铋晶体团聚,阻碍Bi- O- Ti纳米异质结构的生成,从而抑制光催化氧化效果。
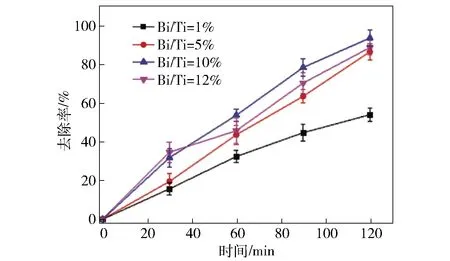
图7 不同铋掺杂量的Bi2O3- TiO2光催化降解甲基橙的效能
2.2.2 煅烧温度优化
在各种其他制备条件相同的情况下,Bi/Ti摩尔比均选取10.0%,分别制备了烧制温度是400 ℃、500 ℃、600 ℃的3种催化剂,研究了这3种可见光催化氧化甲基橙的降解效能。甲基橙初始浓度为10 mg/L,光催化剂的投加量均为1 g/L。实验过程中,先进行1 h的暗吸附反应,然后进行120 min光催化氧化验证降解效果。结果如图8所示。

图8 不同制备温度催化剂的甲基橙降解效果
由图8可知,温度400 ℃下制备的催化剂光催化效果较差,甲基橙的去除率仅为10.6%,烧制温度500 ℃与600 ℃下制备的催化剂光催化效果较好,120 min时去除率达到最大,分别为75.3%和86.7%。
实验结果表明,甲基橙的降解率随着煅烧温度的增加而提高。制备温度会影响颗粒的晶粒尺寸、晶体结晶度以及晶型,最终影响光催化效果。煅烧温度增加可以提高纳米复合材料的结晶度,在一定程度上降低纳米复合材料禁带宽度,提高光子利用率和光催化氧化效果。制备温度低,掺杂TiO2的晶体只有少数发生晶化,晶界的含量较少,相应的氧空位数较少,导致Bi掺杂的数量少;制备温度高时,满足TiO2晶体的晶化条件,相应地Bi掺杂的数量多。
3 结论
本文采用溶胶- 水热- 煅烧法在不同烧制温度下制备Bi掺杂量不同的Bi2O3- TiO2复合纳米材料,并探究了复合纳米材料的材料特性、光催化及吸附特性。主要结论如下:
1)TiO2、Bi2O3- TiO2(1%-600 ℃)、Bi2O3- TiO2(5%-600 ℃)、Bi2O3- TiO2(10%-600 ℃)、Bi2O3- TiO2(12%-600 ℃)的平均晶体粒径都在50 nm以下,其中TiO2的粒径为43.2 nm,Bi2O3- TiO2(10%-600 ℃)为11.6 nm。相比TiO2,Bi2O3- TiO2复合材料的平均晶体粒径更小。
2)铋掺杂配比优选结果显示,Bi/Ti摩尔比为10%的Bi2O3- TiO2纳米复合材料对甲基橙的降解效果最优,降解率可达93.6%;过高的铋含量造成大量的氧化铋晶体团聚,阻碍Bi- O- Ti纳米异质结构的生成,从而抑制光催化氧化效果。
3)在各种其他制备条件相同的情况下,煅烧温度600 ℃制备的催化剂最优。Bi/Ti摩尔比为10.0%,反应时间120 min时,光催化剂对甲基橙的去除率达到最大,为86.7%。
