母亲MTHFD1及MTHFD2基因多态性与子代先天性心脏病的关联
2022-07-25陈倩黄鹏宋欣俐刘亦萍孙梦婷王婷婷张森茂秦家碧
陈倩 黄鹏 宋欣俐 刘亦萍 孙梦婷 王婷婷 张森茂 秦家碧
(1.中南大学湘雅公共卫生学院流行病与卫生统计系,湖南长沙 410078;2.湖南省儿童医院心胸外科,湖南长沙 410007)
先天性心脏病(congenital heart disease,CHD)是新生儿中最常见的出生缺陷类型[1],也是导致婴儿死亡率升高的主要原因[2]。全球CHD 发病率约为0.9%,意味着全球每年至少有135 万CHD 患儿出生[3]。目前许多学者认为CHD 是由于遗传、环境等因素单独或综合作用的结果[4-5]。流行病学调查显示,孕期叶酸的摄入可降低40%~60%子代CHD 的发生[6]。叶酸缺乏可导致高同型半胱氨酸血症,国内外有研究表明母亲同型半胱氨酸水平升高与子代CHD发生相关[7-8]。亚甲基四氢叶酸脱氢 酶1 (methylenetetrahydrofolate dehydrogenase 1,MTHFD1)基因位于染色体14q24,编码的单一蛋白具有3 种酶的活性。MTHFD1基因编码的C1 四氢叶酸(tetrahydrofolic acid,THF)合成酶,通过其甲酰‐THF 合成酶活性催化甲酸和THF 向10‐甲酰‐THF 的转化,是一碳单位进入叶酸代谢的切入点[9]。 亚 甲 基 四 氢 叶 酸 脱 氢 酶 2(methylenetetrahydrofolate dehydrogenase 2,MTHFD2)是由第2 染色体上基因所编码的线粒体酶,该酶于1960 年首次在埃利希腹水肿瘤细胞中发现[10-11]。MTHFD2具有亚甲基四氢叶酸脱氢酶及环化水解酶的双重活性,在叶酸代谢途径中催化2个连续的反应,MTHFD1、MTHFD2是体内叶酸代谢产物相互转化反应中的关键酶[12]。母亲MTHFD1基因、MTHFD2基因缺陷可能会影响酶的活性,使叶酸代谢障碍及同型半胱氨酸再甲基化途径受阻,从而引起同型半胱氨酸蓄积造成高同型半胱氨酸血症。因此,母亲MTHFD1基因、MTHFD2基因单核苷酸多态性(single nucleotide polymorphism,SNP)可能通过影响叶酸与同型半胱氨酸代谢改变后代对CHD 的易感性。目前,关于母亲MTHFD1基因、MTHFD2基因与子代CHD关联的研究较少,既往研究只关注MTHFD1基因的个别位点(rs2236225、rs1950902、rs1076991、rs8010584)[13-20], 事 实 上,MTHFD1基 因、MTHFD2基因还有许多其他位点有待研究。本研究是基于医院开展的病例对照研究,旨在评估母亲MTHFD1基因、MTHFD2基因多态性及基因之间的交互作用与子代CHD的关联,为叶酸-同型半胱氨酸代谢通路上相关基因对CHD 的易感性提供流行病学依据,也为揭示叶酸预防出生缺陷的潜在作用机制提供线索。
1 资料与方法
1.1 研究对象
本研究采用以医院为基础的病例对照研究,选取2017 年11 月至2020 年3 月在湖南省儿童医院心胸外科就诊的683 例CHD 患儿的母亲作为病例组,选取同时间段内就诊于同一家医院并排除任何先天畸形的740例儿童的母亲作为对照组。本研究已获中南大学湘雅公共卫生学院伦理委员会审批(审批号:XYGW‐2018‐07),并进行了临床试验注册(注册号:ChiCTR1800016635)。
1.2 纳入和排除标准
病例组纳入标准:(1)经彩色多普勒超声和/或手术确诊患单纯性CHD(除心脏畸形外未合并其他系统畸形)患儿的母亲;(2)患儿母亲彼此间无亲缘关系;(3)自愿参加本研究并签署知情同意书。病例组排除标准:(1)患儿合并其他先天性疾病;(2)双胎或多胎妊娠;(3)非自然受孕;(4)民族为少数民族;(5)因患精神疾病、情绪极度不稳定而无法配合调查或对孕前、孕期暴露情况记忆不清;(6)与患儿无血缘关系;(7)无法提供血液样本;(8)无法完成问卷调查。
对照组纳入标准:(1)经病史询问及临床诊断排除了CHD和/或CHD以外的其他先天性疾病的患儿母亲;(2)与病例无亲缘关系,且对照彼此之间无亲缘关系;(3)经项目告知后,自愿加入研究并签署知情同意书。对照组排除标准:(1)双胎或多胎妊娠;(2)非自然受孕;(3)民族为少数民族;(4)因患精神疾病、情绪极度不稳定而无法配合调查或对孕前、孕期暴露情况记忆不清;(5)与患儿无血缘关系;(6)无法提供血液样本;(7)未完成问卷调查。
1.3 问卷调查
采用问卷调查以下内容:孕母的社会人口学特征(孕龄、文化程度、过去1年的家庭收入、民族和居住地)、家族史(近亲婚姻、先天畸形)、既往不良妊娠史(自然流产、死胎、死产、早产、低出生体重、妊娠高血压和妊娠糖尿病)、围孕期感冒和发热史、围孕期生活行为史(主动吸烟、被动吸烟、饮酒史等)、围孕期饮茶习惯、围孕期环境污染接触史、围孕期叶酸服用情况、孕母染发或烫发和饲养或亲密接触宠物等。
1.4 DNA的提取和基因多态性检测
在研究对象入组后24 h 内,由所在科室的护士采用乙二胺四乙酸抗凝管采集研究对象5 mL 外周静脉血。血液采集后立即于4℃冰箱内保存并在12 h 内低温运送回实验室,3 500 r/min 下离心15 min,分离血浆及血细胞并进行分装,标记研究对象分组及编号后保存于-80℃低温冰箱。参考已发表的文献所介绍的方法[21]筛选基因的待检位点。具体为:检索NCBI 数据库(https://www.ncbi.nlm.nih.gov/),查询并核实MTHFD1、MTHFD2基因的主要SNP 位点,并结合HapMap 数据库核实SNP位点信息,要求选择tanSNP时r2所设的阈值不小于0.8 且要求各位点最小等位基因频率(minor allele frequency,MAF)≥10%。最终选择了13个基因 位 点 (rs1950902、 rs2236225、 rs2236222、rs11849530、 rs1256146、 rs2236224、 rs1256142、rs34616731、 rs7571842、 rs702466、 rs828858、rs828903、rs1095966)作为本研究的待检基因位点。利用MassARRAY 飞行时间质谱(Agena iPLEXassay,San Diego,CA,USA)对MTHFD1、MTHFD2基因的13个SNP 位点进行检测,具体检测工作由博淼生物科技(北京)有限公司完成。
1.5 统计学分析
计数资料采用频数和百分率或构成比(%)表示,2 组间计数资料的比较采用卡方检验或Fisher确切概率法,等级资料的比较采用Wilcoxon秩和检验。涉及多重比较时,采用错误发现率(false discovery rate,FDR)校正的方法调整P值以控制假阳性率,得到校正P值(QFDR),并以QFDR≤0.05为差异具有统计学意义。在描述比较基因多态性位点基因型分布频率之前,对照组人群进行Hardy‐Weinberg平衡检验,P≥0.05则说明各基因频率达到遗传平衡。采用单因素和多因素logistic回归分析,分别计算未调整和调整的相对危险比(odds ratio,OR)及95%可信区间(confidence interval,CI),并控制潜在的混杂因素,以检验母亲MTHFD1、MTHFD2基因多态性与CHD 的关联强度。利用Haploview 4.2 软件计算不同SNP 位点之间的r2值,r2<0.8 表明SNP 位点之间不存在连锁不平衡;同时,利用四配子检验法构建单倍型,并分析各单倍型在病例组和对照组之间的分布。采用广义多因子降维法(generalized multifactor dimensionality reduction,GMDR)和logistic 回归法分析基因-基因交互作用,在模型有统计学意义的情况下,测试样本的准确度越大、交叉验证一致性越接近10,其模型越好。
2 结果
2.1 2组基线资料的比较
病例组和对照组的基线数据汇总见表1。结果显示,孕母居住地、文化程度、家庭年收入、家族成员有先天畸形史、近亲婚配史、既往不良妊娠史(死胎或死产、妊娠糖尿病、妊娠高血压)及围孕期感冒或发热史、叶酸补充、不良生活习惯(主动或被动吸烟、饮酒)、围孕期环境污染物接触史、围孕期孕母染发或烫发和饲养或亲密接触宠物等指标在2 组间的比较差异有统计学意义(P<0.05)。在后续多因素分析中,这些因素将作为混杂因素进行控制。

表1 病例组和对照组的基线资料比较 [n(%)]
2.2 对照组MTHFD1 和MTHFD2 基因位点Hardy‐Weinberg平衡检验
对 照 组MTHFD1和MTHFD2基 因 型Hardy‐Weinberg 平衡检验结果如表2~3 所示,对照人群MTHFD1和MTHFD2基因的13个位点的基因型分布均符合Hardy‐Weinberg 平衡定律(均P>0.05),表明对照组的样本人群具有良好的群体代表性。

表2 母亲MTHFD1基因型分布频率及对照组Hardy‐Weinberg平衡检验
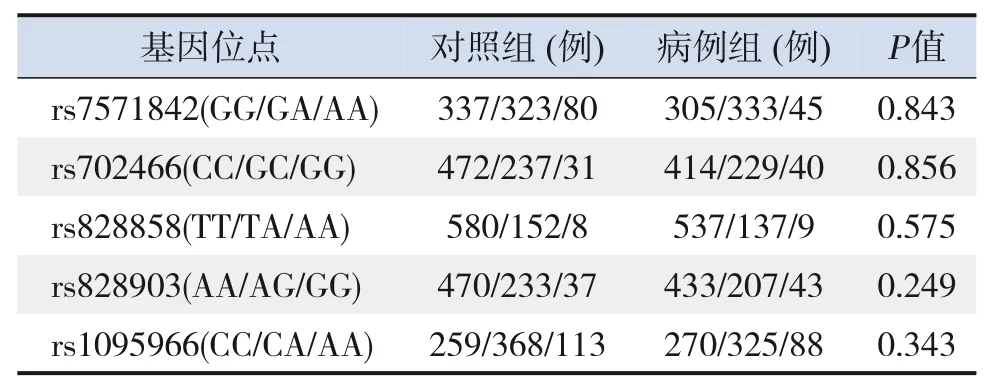
表3 母亲MTHFD2基因型分布频率及对照组Hardy‐Weinberg平衡检验
2.3 母亲MTHFD1 和MTHFD2 基因多态性与子代CHD的关联分析
母亲MTHFD1和MTHFD2基因上13个位点的SNP与子代CHD的关联分析结果如表4~5所示。在调整表1基线资料比较中差异有有统计学意义的混杂 因 素 后, 母 亲MTHFD1基 因rs1950902、rs11849530 和rs1256142 位 点 及MTHFD2基 因rs1095966位点的多态性与子代CHD存在关联。

表4 (续)

表4 母亲MTHFD1基因多态性与子代CHD的关联
在位点rs1950902 上,携带AA 基因型的母亲与携带GG基因型相比,子代CHD的风险显著降低(OR=0.57,QFDR=0.040)。该位点的隐性模型(OR=0.62,QFDR=0.048)和加性模型(OR=0.78,QFDR=0.040)可降低子代CHD的风险。
在位点rs11849530 上,携带GA (OR=1.49,QFDR=0.011)或GG(OR=2.04,QFDR=0.002)基因型的母亲与携带AA基因型相比,子代CHD的风险显著增加。该位点的显性模型(OR=1.62,QFDR=0.002)、隐性模型(OR=1.71,QFDR=0.009)和加性模型(OR=1.44,QFDR=0.001)与子代CHD 风险存在关联。
在 位 点rs1256142 上,携 带GA (OR=2.34,QFDR<0.001)或AA(OR=3.25,QFDR<0.001)基因型的母亲与携带GG基因型相比,子代CHD的风险显著增加。该位点的显性模型(OR=2.59,QFDR<0.001)、隐性模型(OR=1.77,QFDR=0.001)和加性模型(OR=1.78,QFDR<0.001)与子代CHD 风险存在关联。
在 位 点rs1095966 上,携 带CA (OR=0.68,QFDR=0.032)基因型的母亲与携带CC 基因型相比,子代CHD 的风险显著降低。该位点的显性模型(OR=0.68,QFDR=0.040) 和加性模型(OR=0.78,QFDR=0.032)可降低子代CHD的风险。

表5 母亲MTHFD2基因多态性与子代CHD的关联
2.4 连锁不平衡及单倍型分析
连锁不平衡分析显示,母亲MTHFD1和MTHFD2基因位点间不存在连锁不平衡(r2<0.8)。13个SNP位点共形成了3个单倍型块(Block)(图1)。SNP位点形成的单倍型在2组间的分布情况如表6 所示,Block1 内包含3个位点:rs2236225、rs2236224 和rs1256142,构成4 种单倍型:G‐G‐A、G‐G‐G、A‐A‐G 和G‐A‐G,其中G‐G‐G(OR=1.86,95%CI:1.53~2.26)、G‐A‐G (OR=1.35,95%CI:1.03~1.78)单倍型显著增加子代CHD的风险(QFDR≤0.05);Block2 内 包 含2个 位 点:rs1256146 和rs34616731,构成3 种单倍型:G‐T、A‐A、G‐A;Block3 内 包 含3个 位 点rs828858、rs828903 和rs7571842,构成4 种单倍型:T‐A‐G、T‐A‐A、A‐G‐G、T‐G‐G。

表6 SNP位点形成的单倍型在病例组和对照组中的分布情况
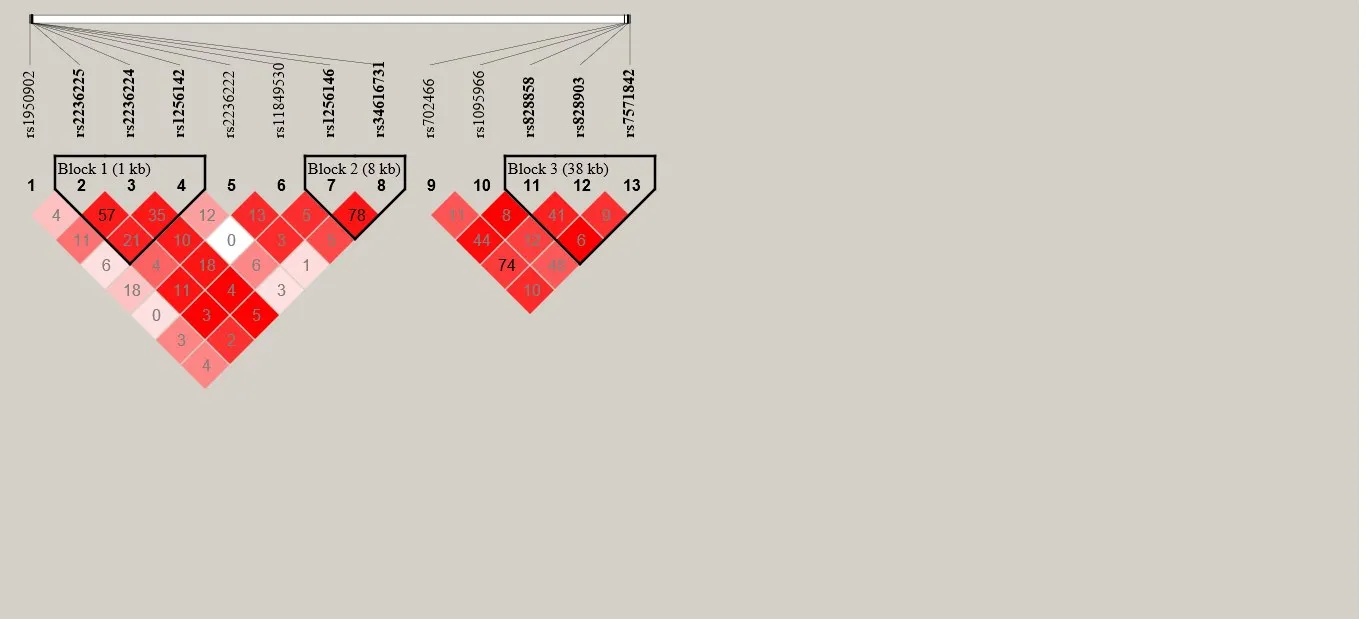
图1 MTHFD1 和MTHFD2 基因各位点连锁不平衡图 图中红色方框代表位点连锁不平衡的程度,颜色越深表示位点之间连锁不平衡强度越强。框中数值为连锁不平衡指标的具体值,接近于100,提示两位点之间连锁不平衡强度越强;接近于0,则提示两位点连锁不平衡强度越弱,即趋向于遗传平衡。框上方数字1~13分别对应数字上方的位点rs号。
2.5 基因-基因交互作用分析
运用GMDR 分析母亲MTHFD1和MTHFD2基因13个SNP 位点间的交互作用,结果如表7所示:2个位点(rs1950902、rs2236222)的一阶交互作用、3个位点(rs1950902、rs1256142、rs1095966)的二阶交互作用可能与CHD 的发生风险存在关联(P<0.05)。采用logistic回归法分析上述3个位点的二阶交互作用,显示母亲rs1950902 位点携带基因型GA+AA、 rs1256142 位点携带基因型GG、rs1095966 位点携带基因型CC(OR=0.02,95%CI:0.01~0.12),以及rs1950902 位点携带基因型GA+AA、rs1256142 位点携带基因型GG、rs1095966 位点携带基因型CC+CA(OR=0.32,95%CI:0.14~0.72) 可能降低子代CHD 的风险(QFDF<0.05),见表8。

表7 MTHFD1和MTHFD2基因位点间交互作用分析

表8 MTHFD1和MTHFD2基因位点间交互作用的logistic回归分析
3 讨论
CHD 是影响儿童健康水平和人口素质的重大公共卫生问题[22]。研究母亲叶酸代谢过程关键酶(如MTHFD1、MTHFD2)基因多态性与子代CHD的关联,可为判断亲代是否为高风险个体提供科学依据。但目前相关研究多倾向于关注患儿MTHFD1基因多态性与CHD发生风险的关联[13-19],涉及母亲MTHFD1基因多态性与子代CHD 风险的关联的流行病学证据还十分有限。Cheng 等[20]发现母亲MTHFD1基因rs2236225 位点多态性与子代CHD 存在有统计学意义的关联,并且指出,CHD患儿的母亲具有较低的叶酸水平及较高的血清同型半胱氨酸浓度,这从流行病学的角度部分解释了母亲rs2236225位点基因多态性和子代CHD发生的生物学合理性。然而,本研究未发现母亲MTHFD1基因rs2236225 位点多态性与子代CHD 发生风险的关联,与Song等[9]和Christensen等[15]研究结果一致。此外,本研究发现母亲MTHFD1基因rs1950902、rs11849530 和rs1256142 位点多态性与子代CHD 存在有统计学意义的关联,与Song等[9]研究结果一致。有研究者报道了MTHFD2基因多态性与癌症的关联[23],但目前尚无关于MTHFD2基因多态性与CHD关联的研究。
本研究分析了母亲MTHFD1 和MTHFD2基因13个 位 点(rs1950902、rs2236225、rs2236222、rs11849530、 rs1256146、 rs2236224、 rs1256142、rs34616731、 rs7571842、 rs702466、 rs828858、rs828903、rs1095966)的SNP 与子代CHD 的关联,结 果 表 明, 母 亲MTHFD1基 因rs1950902、rs11849530、 rs1256142 位 点 及MTHFD2基 因rs1095966位点的多态性与子代CHD 存在关联,没有观察到MTHFD1基因rs2236225 位点与子代CHD风险之间的显著相关性,可能是由于不同人群之间的遗传差异造成的,也可能是叶酸-同型半胱氨酸失衡对CHD 各亚型的易感性不同[24]。由于本研究中CHD 各亚型病例的样本量有限,我们没有分析特定CHD 亚型与母亲MTHFD1、MTHFD2基因多态性之间的关联。总的来说,本研究中涉及的一些多态性之前还没有得到证实,而且关于母亲MTHFD1、MTHFD2基因多态性与子代CHD关联性的文献仍然有限,需要更进一步、更明确的证据来明确其机制。
本研究在基因与疾病的关联分析中,13个位点共形成了3个单倍型块,Block1中的单倍型G‐G‐G和G‐A‐G显著增加了子代CHD的风险。多数学者认为CHD 具有多基因遗传疾病的特征,疾病的发生往往是由于多个基因共同作用的结果。不同基因之间或同一基因不同位点间可能通过相互作用影响疾病的发生发展,若研究忽略了基因-基因之间的交互作用,遗传变异的真实效应则将无法被准确地描述出来[25]。目前关于母亲基因-基因交互作用对子代CHD 影响的研究较少,且不同的研究所关注的基因及位点存在差异。本研究运用了GMDR 和logistic 回归法分析基因-基因的交互作用,结果显示,2个位点(MTHFD1rs1950902、MTHFD1rs2236222)的一阶交互作用、3个位点(MTHFD1rs1950902、MTHFD1rs1256142、MTHFD2rs1095966)的二阶交互作用可能与CHD的发生存在关联。
本研究存在以下局限性:第一,本研究是以医院为基础的病例对照研究,通过问卷访谈的方式回顾性收集研究对象及其配偶围孕期的相关暴露因素信息,可能存在回忆偏倚;第二,由于CHD 儿童是一个相对特殊的人群,不可能通过随机抽样来选择研究对象,且本次研究只选择了一家医院,结果的代表性有待进一步研究;第三,由于样本量的限制,本研究未对MTHFD1、MTHFD2基因多态性与不同CHD 亚型的关联进行评估。
综上所述,本研究显示,母亲MTHFD1基因rs1950902、 rs11849530、 rs1256142 位 点 和MTHFD2基因rs1095966 位点的多态性与子代CHD存在关联,MTHFD1、MTHFD2基因位点构成的单倍型(G‐G‐G 和G‐A‐G)也与子代CHD 的发生有关。MTHFD1、MTHFD2基因2个位点(MTHFD1rs1950902、MTHFD1rs2236222)的一阶交互作用、3个 位 点 (MTHFD1rs1950902、MTHFD1rs1256142、MTHFD2rs1095966)的二阶交互作用可能与子代CHD 的发生风险存在关联。然而,MTHFD1、MTHFD2基因的遗传变异影响CHD发生的作用机制仍不明确,未来还需要开展更多研究。
利益冲突声明:所有作者声明无任何利益冲突。
