不同热处理对藜麦蛋白质营养品质的影响
2022-07-23朱莹莹安双双董吉林申瑞玲
朱莹莹, 安双双, 王 雷, 董吉林, 申瑞玲
(郑州轻工业大学食品与生物工程学院1,郑州 450000) (河南省冷链食品质量安全控制重点实验室2,郑州 450000) (食品生产与安全河南省协同创新中心3,郑州 450000)
藜麦(ChenopodiumquinoaWilld.)是一种原产自南美洲的无麸质假谷物,与常见谷物相比,其富含维生素、矿物质和植物化学素,且蛋白质、中性脂肪和膳食纤维含量较高,而淀粉含量较低[1]。研究表明,不同品种藜麦籽粒中蛋白质占干质量的12%~23%,主要由11S球蛋白(37%)、2S清蛋白(35%)及少量醇溶谷蛋白(0.5%~7%)组成[2]。藜麦蛋白质被认为是一种优质食用蛋白,富含人体必需氨基酸且比例均衡,其赖氨酸(Lys,谷物第一限制性氨基酸)含量是小麦蛋白质的10倍以上[3],甲硫氨酸(Met,大豆主要限制性氨基酸)含量远高于大豆分离蛋白,且含有婴幼儿无法合成的组氨酸(His)。作为一种植物蛋白质,藜麦蛋白质不含胆固醇,长期摄入也不会诱发慢性代谢疾病,比动物蛋白质更有利于人体健康[4]。藜麦蛋白质消化水解产物具有抗氧化[5]、抑制血管紧张素转化酶(ACE)和抑制癌细胞增殖等活性[6,7]。然而,蛋白质功能特性、消化吸收及生理活性均受到加工处理过程的影响[8]。近年来,随着市场对藜麦健康食品的需求不断增加,加工处理对藜麦蛋白质营养品质影响的评价也成为了当前的研究热点。
热处理是食品加工中最常见的手段。蒸煮、杀菌、喷雾干燥等不同热处理方式会改变植物蛋白质二级结构,使α-螺旋含量和无规则卷曲含量上升,而β-折叠含量下降,进而不同程度地影响其消化速率[9]。不同热处理温度对植物蛋白质结构带来的影响也存在差异,Rocha等[10]发现135 ℃下处理芸豆蛋白质更容易导致二硫键的交联。此外,热处理过程,糖和氨基酸发生美拉德反应,也会一定程度改变植物蛋白质氨基酸模式,同时影响其消化产物的生理活性。李菊芳等[11]发现微波处理菜籽饼粕蛋白质使其水解产物抗氧化活性明显提高。苋菜种子蛋白经过挤压膨化处理后,其消化产物展现更高的抗炎活性[12]。目前关于不同热处理对藜麦蛋白质营养品质、消化特性以及其消化产物生理活性的影响鲜有报道。本研究比较不同热处理方式对藜麦蛋白质氨基酸组成和体外消化特性的影响,研究不同热处理后藜麦蛋白质体外消化水解产物抗氧化活性和调节3T3-L1脂肪细胞胰岛素抵抗模型葡萄糖代谢的影响,以期为藜麦蛋白质的深加工与功能性应用提供参考。
1 材料与方法
1.1 材料与试剂
藜麦籽粒:青藜2号,2018年9月自青海省海西州藜麦实验基地收获,机械脱壳后真空包装,在干燥、通风、室温环境储藏。胃蛋白酶(≥3 200 U/mg)、胰蛋白酶(≥10 000 BAEE U/mg)、1,1-二苯基-2-三硝基苯肼(DPPH)、Trolox、DMEM完全培养基、小牛血清、胰岛素; NaOH、HCl、乙醇,均为分析纯; MTT细胞增殖及细胞毒性检测试剂盒、BCA蛋白浓度检测试剂盒、葡萄糖测定试剂盒。
1.2 仪器与设备
XQ200型多功能高速粉碎机,G70D20CN1P-D2微波炉,TPN26MPS-SSL电蒸箱,TWCL-B恒温电磁炉,MG38CB-AA烤箱,K9840全自动凯氏定氮仪,FCD-3000电热恒温鼓风干燥箱,SX-4-10箱式马弗炉,S433D氨基酸分析仪,全波长酶标仪,SpectraMax Gemini EM荧光酶标仪,OP-160ⅡCO2培养箱,BH-FD-0.2冷冻干燥机。
1.3 方法
1.3.1 藜麦分离蛋白(QPI)的提取
藜麦除杂,水洗除皂苷,40 ℃下烘干水分至(10±2)%,随后磨粉并过80目筛,并使用石油醚(10%,m/V)脱脂,在室温下风干,脱脂藜麦粉分散在水中,料液比1∶12,用2 mol/L NaOH调节pH至9.5,35 ℃下搅拌2 h,离心获得上清液。用2 mol/L HCl调节pH至4.5,离心得到蛋白质沉淀。将沉淀水洗至中性,冷冻干燥后得到QPI,并于4 ℃下储存。
1.3.2 QPI的热处理
参考文献[13,14]确定QPI的热处理方案。微波干热:取20 g QPI调节含水量至20%并平衡12 h 后置于耐热聚乙烯袋,平摊使厚度约0.2 cm,使用微波炉在560 W条件下微波处理3 min,记作QPI-MW;蒸制:取20 g QPI置于不锈钢蒸盘,平摊至厚度约0.2 cm,置于电蒸箱,常压蒸制15 min(自电蒸箱温度升至100 ℃起开始计时),记作QPI-SM;煮制:取20 g QPI按1∶40加蒸馏水调成悬浊液,置于恒温电磁炉100 ℃恒温煮制15 min,边煮边搅拌,记作QPI-BL;烘焙:取20 g QPI调节含水量至10%平衡12 h后置于烤盘,平摊厚度约0.2 cm于烤箱烘焙,温度160 ℃,5 min,记作QPI-BK。热处理后样品均冷却至室温后重新于冷冻干燥机冷冻干燥,于4 ℃下储存待用。
1.3.3 QPI蛋白质含量及近似组分分析
QPI蛋白质纯度:GB 5009.5—2016方法,氮转化系数N=5.85;含水量:GB 5009.3—2016方法;脂肪含量:GB 5009.6—2016方法;灰分含量:GB 5009.4—2016方法;剩余组分为总碳水化合物含量。
1.3.4 氨基酸组成分析
参考GB 5009.124—2016中的方法,使用氨基酸分析仪进行分析。配备Na+型磺酸基强酸性阳离子交换树脂色谱柱(型号LCK K06/Na),进样体积0.05 mL。氨基酸含量表示为mg/g蛋白。
1.3.5 氨基酸评分(AAS)[15]
AAS=样品中某种必需氨基酸含量/FAO模式中同种氨基酸含量×100%
(1)
1.3.6 体外消化特性测定
将蛋白悬浮液(100 mg/mL)与含胃蛋白酶(2 000 U/mL消化物)的模拟胃液以1∶1(V/V)比例混合稀释,调节pH至3.0。水浴摇床中孵育消化(37 ℃),分别在模拟胃消化0、30、60、90、120 min时取样测定。将胃消化产物与含有胰酶(100 U胰蛋白酶活性/mL消化物)和猪胆汁提取物(最终混合物中10 mmol/L)的模拟肠液按1∶1的体积比混合,调节pH至7.0,分别在模拟肠消化0、30、60、90、120 min时取样测定,2 h后得到肠消化产物,并做3次平行实验。各阶段待测试样经沸水灭酶,离心后得到上清液,通过凯氏定氮法测定上清液中蛋白含量进而计算胃肠消化率[16]。最终胃肠消化产物经离心后冷冻干燥,于4 ℃储存以备进一步实验。消化率按照式(2)计算。
PD=(CS-CB)/CSample×100%
(2)
式中:PD为蛋白质消化率/%,CS为上清液中的蛋白质含量/mg/mL,CB为空白样中蛋白质含量/mg/mL,CSample为样品中的蛋白质含量/mg/mL。
1.3.7 抗氧化活性测定
1.3.7.1 DPPH自由基清除能力
参考文献[17]报道方法,稍作修改。使用超纯水配制蛋白消化水解产物至终质量浓度0.5、1、2、4、6、8 mg/mL,取不同浓度的样品1 mL分别与3 mL0.02 mol/L的DPPH溶液混合,室温静置反应20 min,使用酶标仪测定其在517 nm下吸光度值(A1)。阴性对照组以95%乙醇替代DPPH,按如上步骤测定吸光度值(A0),空白组以超纯水代替样品,测定吸光度值(A2),按式(3)计算:
DPPH自由基清除能力=1-(A1-A2)/A0×100%
(3)
1.3.7.2 氧自由基吸收能力(ORAC)
参照文献[18],稍作改动。具体如下:黑色96孔板底部分别加入20 μL磷酸缓冲液(空白对照)或待测样品(0.5、1、2、4、6、8 g/L),37 ℃下暗处反应10 min,加入200 μL荧光工作液,37 ℃暗处继续反应20 min,加入20 μL自由基诱发剂(ABAP),37 ℃下,激发波长485 nm,发射波长 538 nm,使用荧光酶标仪测定其150 min 内荧光强度变化,每5 min测定1次。记录不同样品测定荧光熄灭曲线下面积(AUCs)与空白对照孔荧光熄灭曲线下面积(AUCb),计算两者差值。以不同浓度Trolox代替样品测定结果绘制标准曲线,带入样品计算样品ORAC值。结果以每克样品的Trolox当量表示。
1.3.8 藜麦蛋白消化产物对胰岛素抵抗3T3-L1脂肪细胞葡萄糖代谢的影响
1.3.8.1 MTT法测定体外胃肠消化产物对3T3-L1脂肪细胞增殖的影响
3T3-L1小鼠前体脂肪细胞接种于含10%胎牛血清,1%青霉素和1%硫酸链霉素的DMEM高糖培养基中,37 ℃,5% CO2培养箱中培养并传代,于对数生长期时进行实验。将3T3-L1脂肪细胞接种于96孔板内,接种密度为1×105/mL,达到约80%融合时,换以含不同质量浓度(0.3、0.6、0.9、1.2、1.5 mg/mL)蛋白消化产物(不添加样品组为对照)的DMEM培养基孵育48 h,然后每孔加入MTT(5mg/mL)10 μL继续孵育4 h,移出培养基,每孔加入200 μL二甲基亚砜,采用酶标仪于570 nm处测定吸光度。细胞增殖率按式(4)计算:
细胞增殖率=(样品组吸光度/对照组吸光度)×100%
(4)
1.3.8.2 3T3-L1脂肪细胞胰岛素抵抗模型的构建与鉴定[19]
3T3-L1细胞接种于12孔板中,细胞融合2 d达到接触抑制后进行诱导分化实验,用含0.5 mmol/L IBMX、1 μmol/L Dex、10 mg/L Ins的培养基培养48 h,换用含5 mg/L Ins的培养基培养48 h,再用DMEM培养基继续培养,每2 d换液1次,培养6 d,分化为成熟脂肪细胞,待细胞分化完全后,将成熟的3T3-L1脂肪细胞分为正常组和诱导组(分为4组),正常组给予DMEM培养基,诱导组中含有1 μmol/L的Dex,分别在诱导12、24、36、48 h后用葡萄糖氧化酶试剂盒测定培养基中的葡萄糖含量,按式(5)计算葡萄糖摄取量。
葡萄糖摄取量=空白组葡萄糖含量-诱导组葡萄糖含量
(5)
1.3.8.3 蛋白消化产物对胰岛素抵抗3T3-L1脂肪细胞葡萄糖摄取量的影响
在最佳诱导时间的基础上构建3T3-L1脂肪细胞胰岛素抵抗模型,分为模型组和加样组,模型组给予DMEM培养基,加样组中含有不同质量浓度(0.625、1.250 mg/mL)的藜麦蛋白消化产物,干预36 h后测定培养基中葡萄糖的含量。
1.3.9 数据统计与分析
所有实验均重复3次,实验数据以平均值±标准差(X±SD)表示。采用SPSS 20.0进行显著性分析(ANOVA,t检验,P<0.05),采用Origin 7.5软件进行作图。
2 结果与讨论
2.1 热处理对藜麦QPI中蛋白质及其他组分含量的影响
如表1所示,未处理QPI样品蛋白质含量为89.8 g/100 g,其余营养组分按含量从高到低依次包括淀粉、水分、灰分和脂肪。本研究提取QPI蛋白质纯度高于Abugoch等[20]的77.2%,低于Ruiz等[13]的90%~93%,与何兴芬[21]的87.17%结果相近。经过不同方式热处理后,各组样品蛋白质含量无显著性差异(P>0.05),说明微波、蒸制、煮制和烘焙4种热处理方式对QPI蛋白质纯度无明显影响。此外,4种热处理对所提取QPI中淀粉、灰分和脂肪含量的影响也不显著(P>0.05)。是QPI-SM和QPI-BL组样品中含水量显著高于QPI组、QPI-MW组和QPI-BK组(P<0.05),说明蒸制和煮制处理能够增加QPI样品含水量,这与马艺超[22]对苦荞的研究结果一致。热变性蛋白质的结合水能力增加,蒸煮处理不仅导致蛋白质热变性,同时环境中存在大量蒸汽和水分,使得水分与蛋白质结合,变得不易挥发。
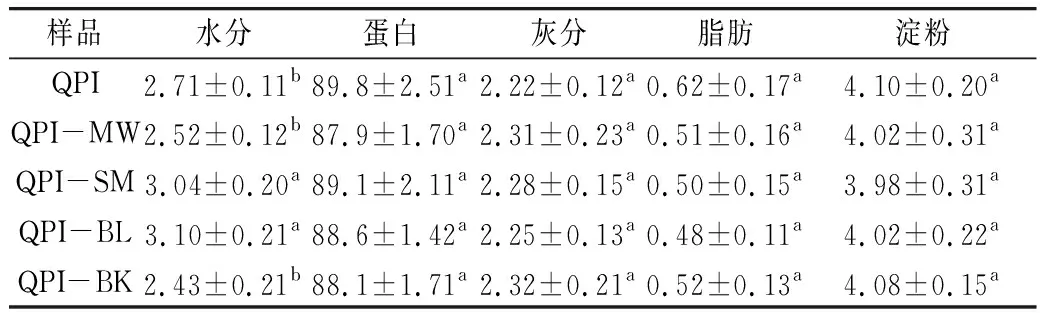
表1 不同热处理藜麦QPI营养组分分析/g/100 g
2.2 热处理对藜麦QPI的氨基酸组成影响
氨基酸是蛋白质的基本组成成分,蛋白质主要以氨基酸形式被机体吸收利用,因此藜麦蛋白质营养品质的高低主要取决于必需氨基酸的含量和组成[23]。如表2所示,QPI中氨基酸组成丰富,含有人体必需的8种氨基酸,以及婴幼儿无法合成的His,与之前报道一致[24]。QPI样品中Glu含量最高,其次是Asp和Arg,而Met+Cys含量最低,该结果与Abugoch等[20]采用碱溶液提取藜麦蛋白的结果相一致。经过4种不同热处理后,QPI必需氨基酸含量发生一定变化:蒸制、煮制和烘焙处理后QPI中必需氨基酸(包括His)总量显著降低(P<0.05),而微波处理对QPI总必需氨基酸含量无显著影响(P>0.05)。此外,不同热处理还改变了QPI氨基酸组成:微波处理主要降低了Trp、Phe+Tyr、Gly和Ala含量,增加了Met+Cys、Arg和Val含量;蒸制处理主要降低了His、Phe+Tyr和Gly含量,增加了Arg、Pro、Val和Met+Cys含量;煮制处理降低了His、Gly、Phe+Tyr、Leu、Pro、Thr、Ala、Ser和Glu含量,增加了Arg、Trp和Val含量;烘焙处理降低了His、Trp、Pro和Gly含量,增加了Arg、Val和Met+Cys含量。可能是QPI样品含有淀粉杂质,不同热处理导致了不同程度的美拉德反应,从而改变的氨基酸含量和组成,但是具体原因有待进一步研究。
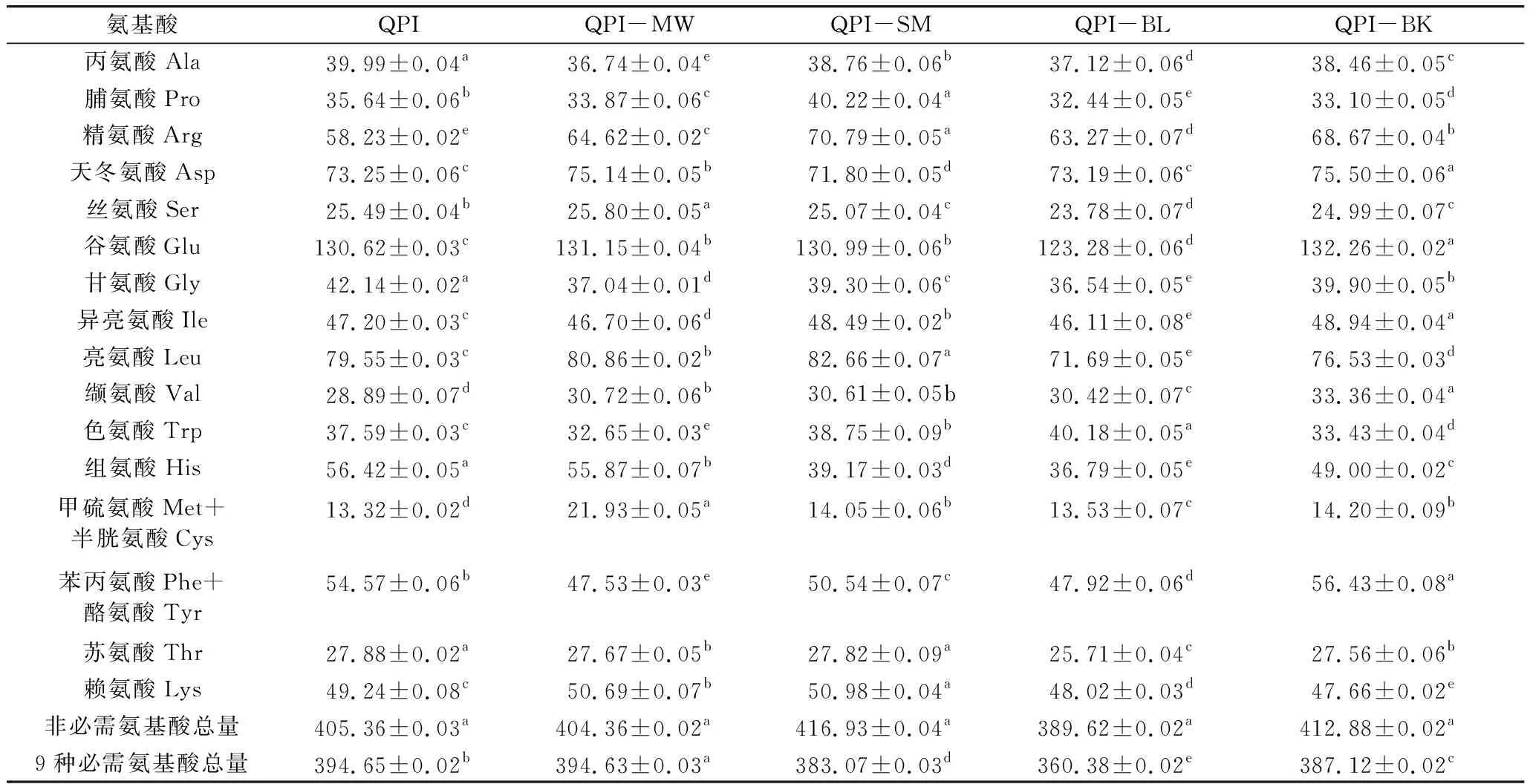
表2 不同热加工方式藜麦氨基酸组成/mg/g 蛋白
表3为与FAO推荐人体必需氨基酸模式比较所得QPI中人体必需氨基酸评分,一般认为评分越接近100,说明样品中氨基酸模式越接近于推荐值,其营养价值越高[25]。对于热处理前后的QPI样品,Lys最接近100,Thr、Phe+Tyr、Leu和Ile分值在100附近,说明这几种氨基酸基本可以满足推荐要求。QPI中Trp和His评分较高,均大于300,经过不同热处理后虽然评分有所降低,但仍然都大于200,这表明QPI是这两种氨基酸膳食补充剂的优质来源。Met+Cys和Val的评分较低,这一定程度的限制了QPI的营养价值,然而值得注意的是,微波处理将Met+Cys的评分从41.63提高至68.53,烘焙处理将Val评分从62.8提高至72.52,这说明这2种热处理可以改善QPI营养价值。经不同热处理后QPI各组分氨基酸含量发生变化,大部分必需氨基酸仍可以满足推荐需求,可作为高品质蛋白成分在食品中添加应用。
2.3 热处理对藜麦QPI体外消化特性影响
体外模拟蛋白质消化过程可以了解蛋白质在胃、肠内的消化情况,并通过消化率反映出蛋白质被消化、吸收的程度。如图1所示,随着消化时间的延长,各组QPI消化率逐渐增加。各组QPI在胃消化前期(0~60 min)及肠消化前期(120~180 min)的消化速率分别高于对应消化阶段的后期(60~120 min,180~240 min),这可能与消化过程中底物浓度的降低有关。微波和煮制处理分别使QPI的最终消化率显著提升(P<0.05),而蒸制和烘焙则对蛋白质的消化率产生了不利影响。Huang等[26]和Sun等[27]的研究也发现不同热处理方式对植物蛋白质消化率的影响存在差异,挤压膨化和高温高压处理能显著提高蛋白质消化率,而烘焙则对蛋白质消化率无显著影响,这可能与不同热处理过程中蛋白质分子结构变化有关。此外,Opazo-Navarrete等[28]发现热处理温度不同,蛋白质消化率也有差异。随着蛋白质热处理温度的升高(60~120 ℃),蛋白质消化水解率下降,这是因为过高的温度会导致蛋白质变性和聚集,进而会影响酶的可接近性。
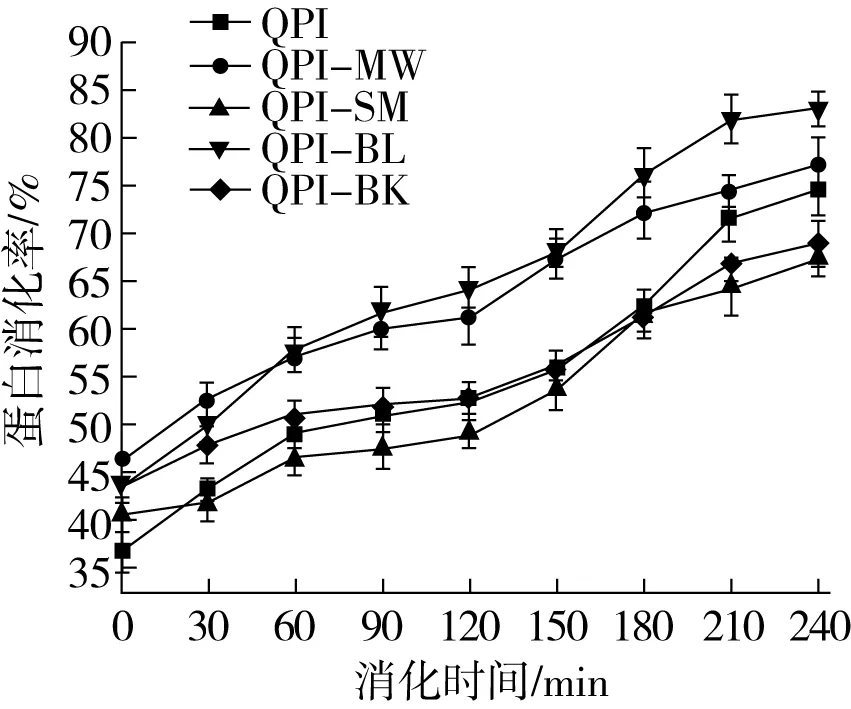
图1 热处理后QPI的体外胃肠消化率
2.4 热处理对藜麦QPI消化产物体外抗氧化活性影响
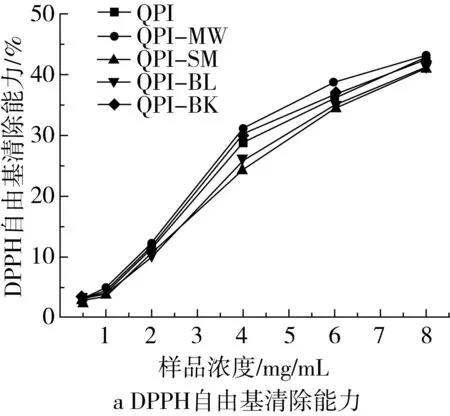
由图2可知,QPI消化产物具有抗氧化作用,热处理一定程度影响其抗氧化能力。在测定质量浓度范围内(0.5~8.0 mg/mL),不同热处理 QPI消化产物均展现出DPPH自由基清除能力,且随着样品浓度的增加清除能力增强。这是由于经过体外消化后,QPI大部分被水解为多肽或者氨基酸,肽类具有电子供体物质可以阻断自由基的链式反应。微波处理和烘焙处理后,QPI消化产物DPPH自由基清除能力增强。这与李苗云等[29]关于发酵酸肉的报道一致,他们发现,微波和烘焙处理有助于增强发酵酸肉多肽体外清除DPPH自由基能力。这可能是由于加热使蛋白质高级结构受损,其中疏水基团暴露,更易与DPPH自由基发生结合,从而达到清除目的。蒸制和煮制降低了QPI消化产物DPPH自由基清除能力,可能是由于这两种热处理方式更利于其亲水基团暴露。在测定质量浓度范围内(0.5~8.0 mg/mL),各组样品氧自由基吸收能力变化与其DPPH自由基清除能力大体一致。
2.5 热处理藜麦QPI消化产物对3T3-L1脂肪细胞增殖的影响
图3反映了QPI消化产物对3T3-L1前体脂肪细胞增殖的影响。对照组中,表现出稳定的细胞活力(100%生长率)。在不同样品的作用下,细胞活力表现出明显差异。当样品浓度较低时,热处理前后QPI消化产物均对细胞的增殖有促进作用,随着浓度的进一步增加,细胞活力明显下降,最终表现出细胞毒性。当质量浓度在0.625 mg/mL左右时细胞增殖促进作用最好,当质量浓度在1.25 mg/mL时可基本稳定在正常状态(±20%)。因此,后续实验过程中,为了防止细胞活力下降,样品质量浓度应设置在1.25 mg/mL以下。
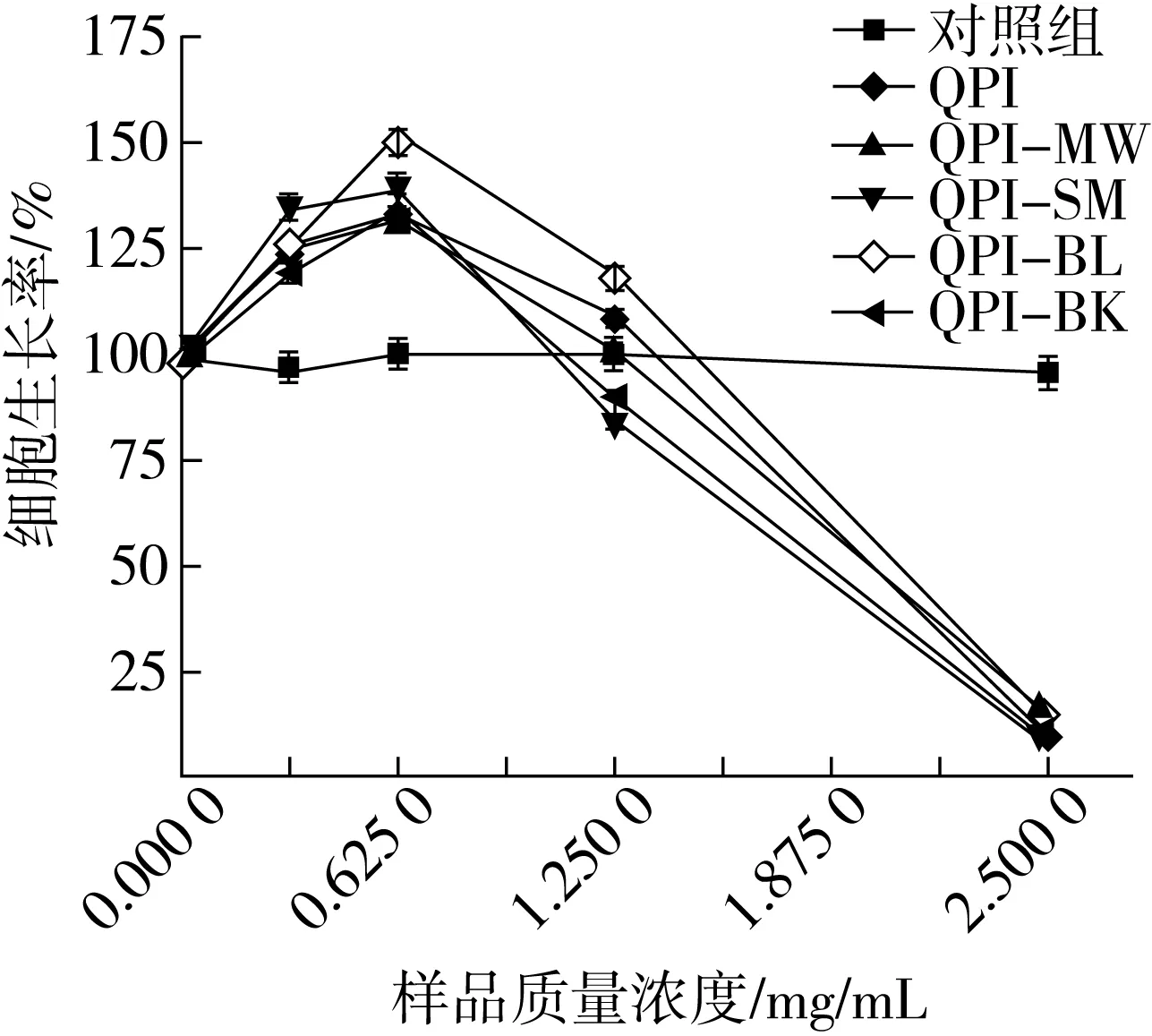
图3 热处理藜麦QPI消化产物对3T3-L1脂肪细胞增殖的影响
2.6 热处理QPI消化产物对3T3-L1脂肪细胞胰岛素抵抗模型葡萄糖代谢的影响
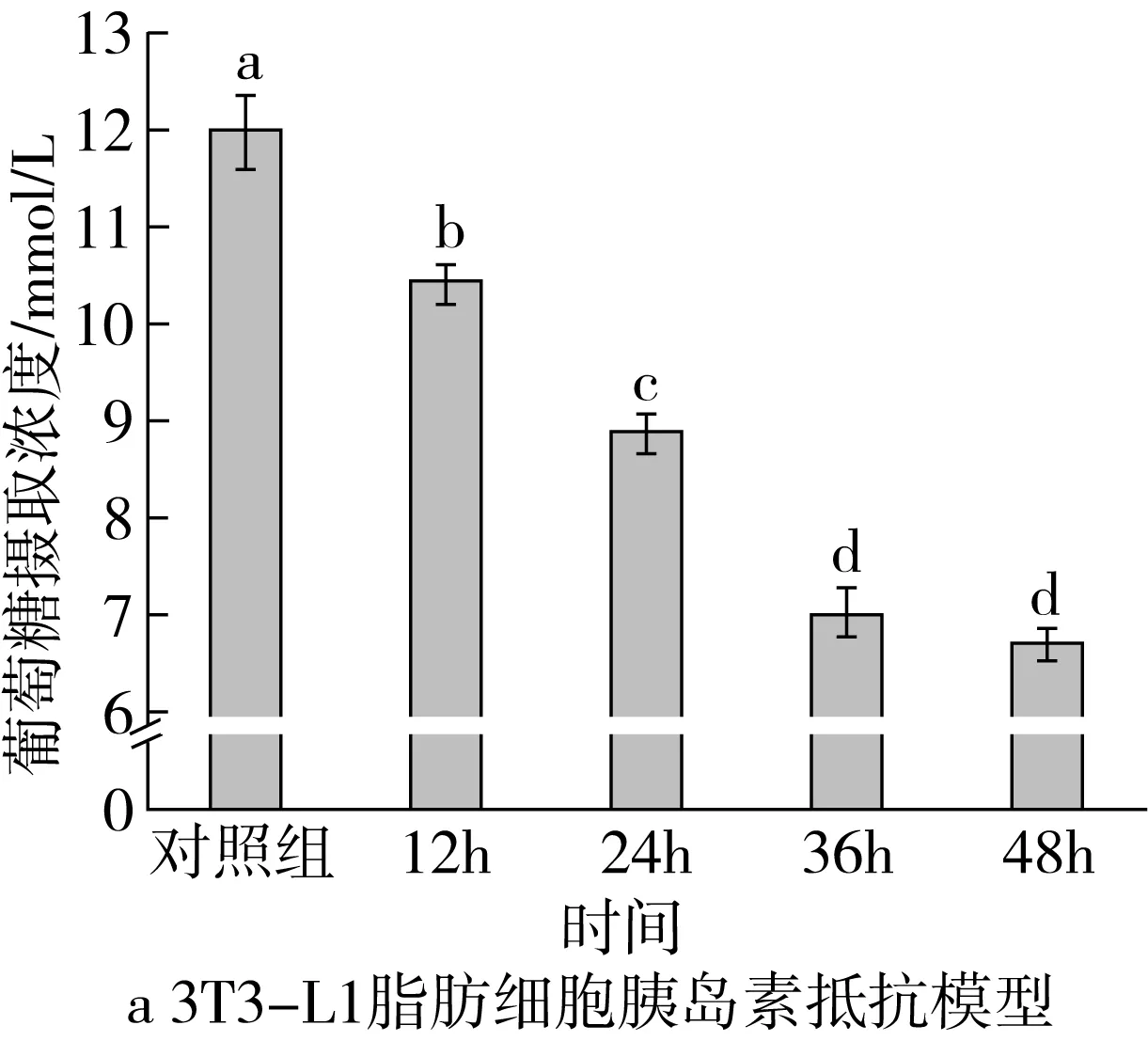
胰岛素抵抗是指由于各种原因使得靶器官组织对葡萄糖的摄取和利用效率降低,是Ⅱ型糖尿病的重要标志。在体内可将葡萄糖的消耗(血糖)量作为表现特征,体外实验则可将培养基中葡萄糖的含量作为测定指标[30]。图4显示了不同诱导时间对3T3-L1脂肪细胞产生胰岛素抵抗的影响,随着诱导时间的逐渐增长,细胞对葡萄糖的摄入量逐渐减少,当诱导时间为36 h时,摄取量可减少40.45%,产生显著的抵抗效果,因此确定胰岛素抵抗细胞模型的诱导时间为36 h。在此基础上,测定不同质量浓度QPI消化产物(0.625、1.250 mg/mL)对3T3-L1脂肪细胞胰岛素抵抗模型葡萄糖摄取量的影响。未处理QPI消化产物能够一定程度地促进3T3-L1脂肪细胞胰岛素抵抗模型对葡萄糖的摄取,这表明藜麦QPI消化产物具有改善胰岛素抵抗从而预防Ⅱ型糖尿病发生的作用。高剂量QPI-SM、QPI-BL和QPI-BK消化产物组细胞对葡萄糖的摄取量显著高于未处理QPI消化产物组(P<0.05),这说明不同蒸制、煮制和烘焙处理提高了藜麦QPI消化产物改善胰岛素抵抗的作用。目前,已有多项研究发现热处理能够提高植物蛋白质消化产物的生理活性,这主要是由于热处理改变植物蛋白质分子结构及消化特性,从而改变消化产物中多肽的组成,导致其生理活性改变。本研究中热处理前后藜麦QPI消化产物中的多肽组成差异,有待进一步研究。
3 结论
藜麦QPI中氨基酸含量丰富,热处理后氨基酸组成虽然发生变化,但大部分必需氨基酸仍可以满足推荐摄入需求,可作为优质蛋白质来源在食品中添加应用。QPI具有良好的体外消化性,微波处理和煮制处理能进一步提高其终消化率。QPI消化产物具有DPPH自由基清除能力和氧自由基吸收能力,微波和烘焙处理增强其抗氧化能力。此外,QPI消化产物能够促进3T3-L1脂肪细胞胰岛素抵抗模型对葡萄糖的摄取,从而改善胰岛素抵抗,蒸制、煮制和烘焙处理可一定程度提高该效果。今后,热处理对QPI分子结构影响、QPI消化产物肽的级分与其生物活性关系的相关研究还需进一步开展。
